Bloqueo de los nervios maxilar y alveolar mandibular en el conejo
Maxillary and mandibular alveolar nerve blocks in rabbits
Contacto: lc268@cornell.edu
Resumen
El dolor orofacial derivado de una patología endo o periodontal puede ser severo y, a menudo, conlleva situaciones asociadas con una calidad de vida baja, así como secuelas potencialmente mortales. El control del dolor en intervenciones quirúrgicas orofaciales ha mejorado significativamente durante los últimos años; en el conejo, el abordaje multimodal para su manejo es el más recomendado. Desafortunadamente, el uso de opiáceos en esta especie puede estar asociado con una disminución de la motilidad intestinal y cecal pronunciada, la cual puede tener consecuancias drásticas. Así, el uso de la analgesia locorregional es una alternativa interesante al empleo de analgésicos parenterales que permite minimizar sus efectos secundarios. En este artículo, se describe y propone el uso de dos bloqueos nerviosos que pueden tener un amplio uso clínico en el tratamiento del dolor orofacial: el bloqueo del nervio maxilar y del nervio alveolar mandibular.
Palabras clave: conejo, bloqueo nervioso, articaína, nervio maxilar, nervio mandibular alveolar, dolor orofacial.
Clin. Vet. Peq. Anim, 2018, 38 (2): 71-75
Summary
Orofacial pain associated with dental disease is often severe and may lead to poor quality of life as well as a series of potentially life-threatening sequelae. Pain control modalities for orofacial surgical interventions have improved over time; a multimodal approach to analgesia in the rabbit is now recommended. Rabbits, however, pose specific issues when using certain classes of analgesic drugs as they are especially prone to reduced gut motility from opioid medications. The use of local and regional anaesthetic techniques, therefore, has the potential to reduce the need for parenteral analgesics, and thus help minimize their undesirable side-effects. In this review, we propose and describe two different nerve blocks that can be used in procedures involving orofacial pain, namely, the maxillary and mandibular alveolar nerve blocks.
Keywords: rabbit, nerve block, articaine, maxillary nerve, mandibular alveolar nerve, orofacial pain.
Clin. Vet. Peq. Anim, 2018, 38 (2): 71-75

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
La popularidad del conejo como animal de compañía se ha ido incrementando en los últimos años. Solo en los Estados Unidos, se estima que como mínimo 1,4 millones de familias tienen al menos un conejo como mascota.1
A menudo, el conejo se presenta en la clínica con patología periodontal, con frecuencia secundaria a un manejo inadecuado.2 Como animal de laboratorio el conejo es, además, el modelo básico para, entre otros, el estudio de implantes óseos y dentales.3
En clínica veterinaria, se plantean con frecuencia diversas intervenciones quirúrgicas maxiloorofaciales, como extracciones o drenaje de abscesos, para resolver casos avanzados de patología dental. El dolor asociado con la patología orofacial a menudo reduce la calidad de vida de estos animales. Carencia de apetito o anorexia completa, deshidratación, íleo gastrointestinal, pérdida de peso, inmunosupresión, lipidosis hepática e incluso la muerte pueden ser algunas de las secuelas si no se tratan estos problemas de forma rápida y adecuada.4-7
El tratamiento del dolor orofacial es complicado y, a menudo, conlleva la prescripción de fármacos como antiinflamatorios no esteroideos u opiáceos. Estos últimos, desafortunadamente, pueden causar en el conejo una reducción drástica de la motilidad intestinal7 que puede provocar la muerte.
Las técnicas de anestesia regional maxilofacial en otras especies, como el perro y el gato, han mejorado el manejo del dolor en cirugía y procesos maxilofaciales, endo y periodontales. La anestesia locorregional en esta región tiene el potencial de disminuir los efectos secundarios de los opiáceos descritos anteriormente y facilitar un retorno al comportamiento normal de esta especie después de intervenciones maxiloorofaciales.
En la literatura se describen diversos abordajes convencionales para el bloqueo de los nervios maxilar y alveolar mandibular.5,6 Sin embargo, la anatomía específica del conejo dificulta identificar algunas de las referencias anatómicas específicas de estos bloqueos, lo que hace que estas técnicas resulten difíciles y de eficacia dudosa.
El objetivo de este artículo es describir de manera sistemática dos bloqueos nerviosos usados frecuentemente en otras especies y que pueden tener en conejos un eventual uso frecuente. Estos bloqueos son el bloqueo del nervio maxilar y el bloqueo del nervio alveolar mandibular.
Bloqueo del nervio maxilar
Las indicaciones de este bloqueo incluyen extracciones ipsilaterales del cuadrante maxilar, cirugía periodontal, biopsias, terapia endodóntica, maxilectomías, rinotomías, rinoscopias o cirugía del paladar, entre otras.
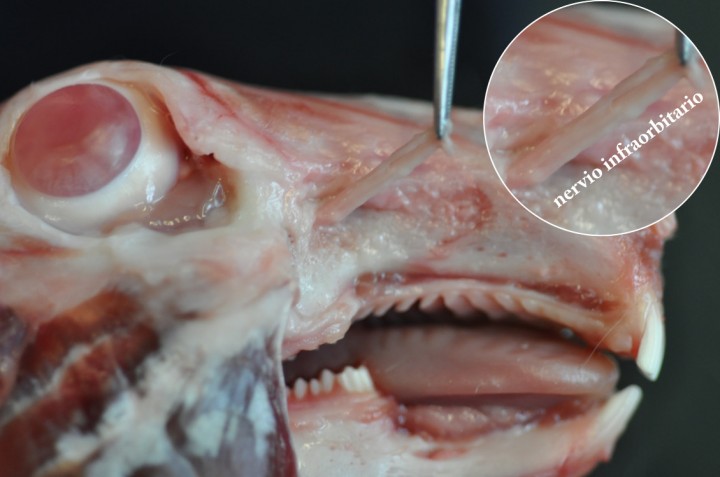
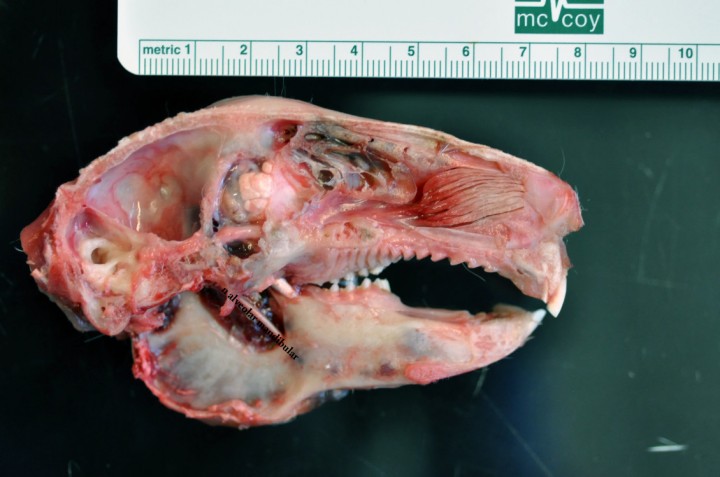
La anatomía del conejo en esta región difiere algo de la de otras especies domésticas. La introducción de una aguja en el foramen infraorbitario del conejo tal y como está descrita en la literatura para otras especies resulta muy compleja, por no decir imposible, debido a la dificultad para localizar mediante palpación este foramen y a la facilidad de dañar el nervio debido a su tamaño (Fig. 1). Así mismo, incluso cuando se trata de introducir una aguja en cadáveres, la aguja termina a menudo en la cavidad nasal y no en el canal infraorbitario o en la fosa pterigopalatina como sería la intención.
Figura 1
Disección de la cabeza del conejo. Nótese el nervio infraorbitario saliendo del foramen infraorbitario en dirección rostral y el tamaño del nervio.
El bloqueo del nervio maxilar a nivel de la fosa pterigopalatina desensibilizará el cuadrante ipsilateral maxilar entero, incluyendo los dientes, la encía asociada, el hueso alveolar, la pulpa dentaria, así como los tejidos duros y blandos del paladar y la mucosa nasal (excepto a nivel del septo, que queda inervado por el nervio etmoidal).
El nervio maxilar entra en la fosa pterigopalatina a través del foramen alar (fusión de la fisura orbitalis y del foramen rotundum). El nervio cigomático se divide del nervio maxilar inmediatamente distal al foramen alar. El nervio cigomático se divide en los nervios cigomaticofacial y cigomaticotemporal. El nervio maxilar discurre en dirección rostral, colocándose entre la bulla alveolaris y el ala ossis presphenoidalis, dorsal a la lámina perpendicularis ossis palatine. La primera rama del nervio trigémino, el nervio oftálmico, atraviesa este mismo foramen junto con el nervio maxilar. La arteria maxilar avanza paralela y en proximidad al nervio maxilar. Justo caudal al tuber alveolare, la arteria maxilar origina la rama bucal que avanza en dirección ventral. A este nivel, el nervio maxilar atraviesa el hueso palatino a través del foramen maxillaris (foramen esfenopalatino).6
El tamaño de la aguja de elección para realizar este bloqueo varía desde 25G (16 mm) hasta 27G dependiendo del tamaño del paciente. En el New Zealand White (aproximadamente 4 kg) resultan adecuadas agujas de 25G.
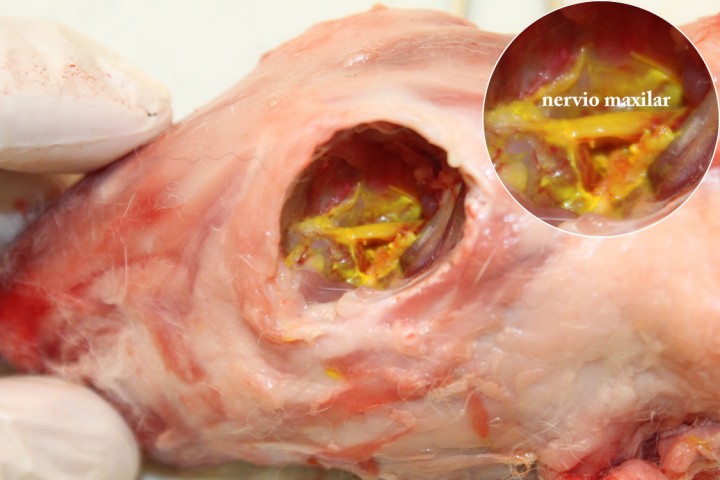
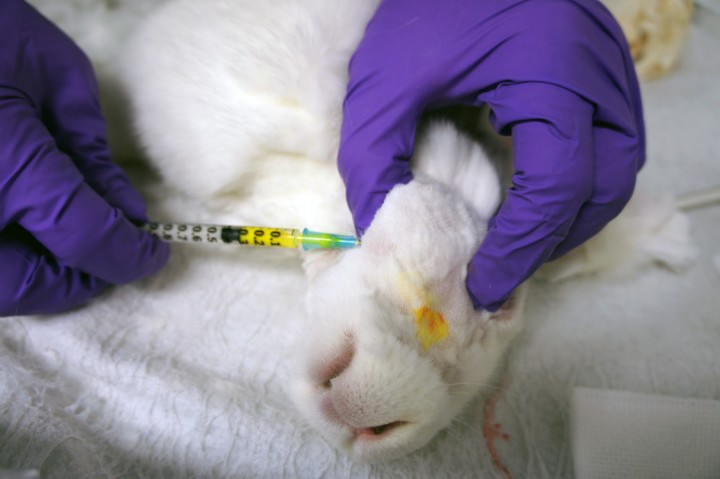
En estudios previos (a la espera de ser publicados) no se encontraron diferencias ni en la migración ni en la precisión de la inyección cuando se compararon dos volúmenes de inyección diferentes en conejos de aproximadamente 4 kg (New Zealand White) (Fig. 2). Los anestésicos locales más usados son lidocaína (1 mg/kg) y bupivacaína (1 mg/kg). Si se usan estas dosis, el volumen a administrar sería de 0,05 ml/kg si se utiliza lidocaína 2% o bupivacaína 0,5%. Por esta razón, en conejos se recomienda el uso de anestésicos locales menos concentrados, a saber, lidocaína 1% o bupivacaína 0,25%.8
Figura 2
Disección de la cabeza de un conejo New Zealand White después del bloqueo del nervio maxilar utilizando un colorante de tejido con un volumen de 0,25 ml. Nótese el nervio maxilar totalmente teñido.
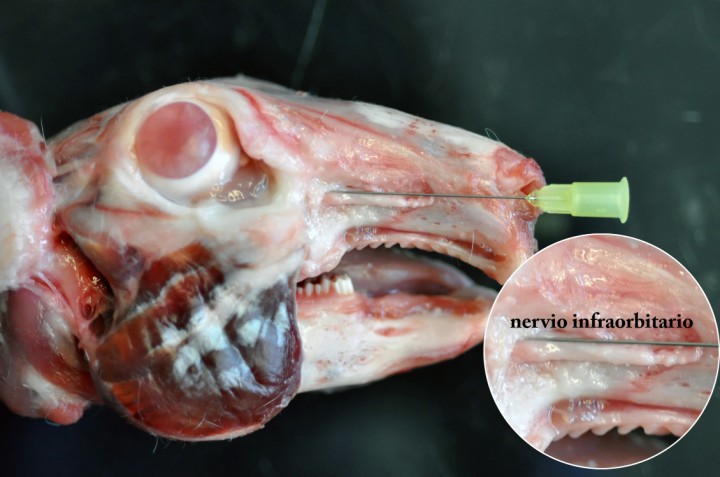
Debido a que el foramen infraorbitario no se detecta muy claramente y resulta posible dañar el nervio infraorbitario (Fig. 3), el abordaje aconsejado al nervio maxilar en esta especie no es el infraorbitario, sino el subcigomático (manuscrito a la espera de publicación).
Figura 3
Disección de la cabeza de un conejo New Zealand White. Nótese el nervio infraorbitario saliendo del foramen infraorbitario en dirección rostral. Nótese también el tamaño del nervio que dificulta la introducción de una aguja sin dañar el nervio.
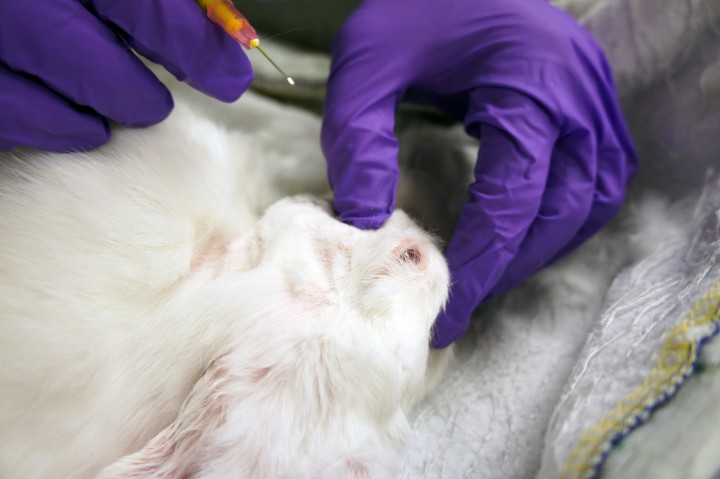
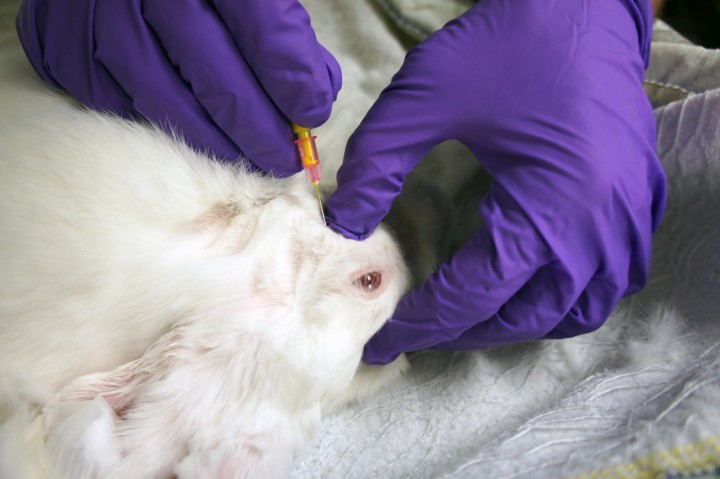
Para realizarlo, se coloca el conejo en decúbito lateral para palpar fácilmente el tuber faciale rostral al os zygomaticum (Fig. 4). Inmediatamente caudal al tuber faciale y ventral al hueso cigomático se encuentra el punto de inyección. La aguja se introducirá en dirección dorsomedial, buscando el contacto con el tuber alveolare. En este momento, la aguja se recoloca para encontrar el borde caudal del tuber alveolare. Cuando se encuentre este borde, la aguja se debe introducir algunos milímetros más en dirección dorsomedial. Una vez que la aguja se encuentra en esta posición, se depositará el anestésico local previa aspiración (Fig. 5) debido a la proximidad de las arterias maxilar y bucal. Durante la inyección debe sentirse ausencia de resistencia a la administración del anestésico. En un estudio clínico realizado en 7 conejos (New Zealand White) utilizando la técnica descrita y usando articaína 2% con epinefrina como anestésico local, se vio una diferencia clara en la tolerancia a la fuerza ejercida por un analgesímetro Von Frey comparado con el lado contralateral (no bloqueado).8
Figura 4
Con el conejo en decúbito lateral, el tuber faciale se puede palpar fácilmente, rostral al os zygomaticum. Nótese el dedo pulgar palpando el tuber faciale.
Figura 5
Con el conejo en decúbito dorsal nótese el dedo pulgar palpando el borde ventral del hueso cigomático, inmediatamente caudal al tuber faciale. La aguja se introducirá en una dirección dorsomedial, buscando el contacto con el tuber alveolare.
A este nivel, el anestésico local bloqueará el nervio maxilar y, posiblemente, el nervio cigomaticofacial, así como la rama dorsal del nervio oculomotor.
Como complicaciones asociadas a este bloqueo tendríamos que considerar la posibilidad de dañar el globo ocular y el riesgo de lesión de los vasos adyacentes.
Bloqueo del nervio alveolar mandibular
Este bloqueo se puede usar en conjunción con los bloqueos del nervio lingual (a menudo bloqueado a la vez) y del nervio bucal para realizar extracciones dentarias, cirugía periodontal, biopsias y mandibulectomías.
La anatomía del conejo en esta área resulta similar a otras especies y, por consiguiente, es fácil realizar este bloqueo de forma efectiva.
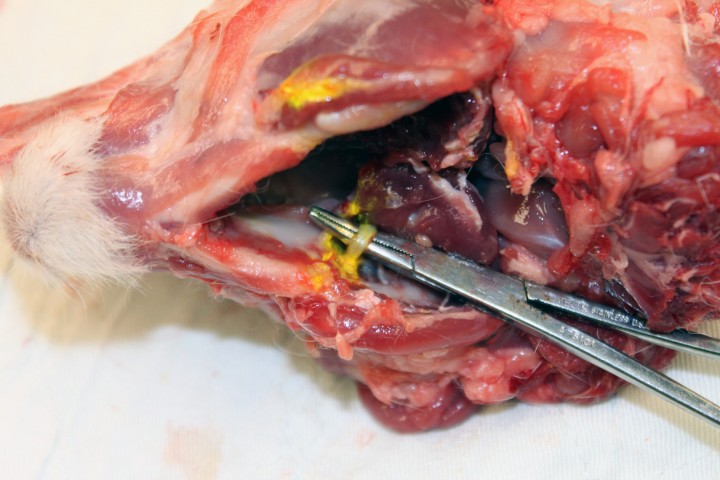
El nervio alveolar mandibular es una rama del nervio trigémino (rama mandibular). La rama mandibular se divide en el nervio alveolar mandibular y en el nervio milohioideo. Estos dos nervios avanzan en dirección ventral y algo rostral, medial al ramus mandibulae y lateral a los músculos pterigoideos. El nervio alveolar mandibular entra en el canal mandibular a través del foramen mandibular (Fig. 6) y cursa en dirección rostral donde emergen las ramas que inervarán los dientes, así como las ramas mentales.6
Figura 6
Disección de la cabeza del conejo. Nótese que se ha hecho un corte sagital en la línea media. Esta disección muestra la parte medial de la mandíbula izquierda. Se han extraído los músculos pterigoideos para exponer el nervio alveolar mandibular. Nótese cómo el nervio entra en el canal mandibular a través del foramen mandibular.
En este bloqueo, la laceración de venas como la submental, a nivel de la incisura vascular, la labialis superior y/o la alveolar inferior pueden dar lugar a pequeños hematomas si resultan penetradas con la aguja de modo accidental. Así mismo, la punción de la arteria facial, sobre la incisura vascular, o de la arteria lingual a nivel del foramen mandibular puede causar hematomas de mayor entidad.
El bloqueo de este nervio desensibilizará las piezas dentarias del área mandibular ipsilateral. Debe recordarse que la inervación sensitiva de la mucosa del área lingual proviene del nervio lingual y la de la mucosa del área bucal, del nervio bucal.
Para efectuar este bloqueo se recomienda el empleo de agujas de entre 25 y 27G dependiendo del tamaño del conejo.
En un estudio cadavérico previo se administraron volúmenes diferentes en conejos de aproximadamente 4 kg (New Zealand White) sin que se apreciasen diferencias en cuanto a precisión del bloqueo para ambos volúmenes (alto y bajo) (Fig. 7).8 Un volumen de inyección de 0,05-0,1 ml/kg es adecuado.
Figura 7
Disección de la cabeza de un conejo New Zealand White después del bloqueo del nervio alveolar mandibular utilizando un colorante a un volumen de 0,15 ml.
Debido a la limitación encontrada en esta especie para abrir la boca de modo amplio, se recomienda el abordaje extraoral para este bloqueo. La incisura vascular se puede palpar en el borde ventral de la mandíbula. Con el conejo en decúbito lateral y la cabeza rotada ligeramente para exponer el espacio intermandibular, el punto de inyección se sitúa medial al músculo pterigoideo. La aguja se introduce en dirección lateral hasta hacer contacto con el aspecto medial de la rama mandibular. Posteriormente, se avanza cuidadosamente con un ángulo de unos 45º en dirección caudal hacia la articulación temporomandibular, siguiendo el aspecto medial de la rama mandibular (Fig. 8). Cuando se estime que la aguja se sitúa a un nivel proximal al foramen mandibular, y previa aspiración, se administra el anestésico local. Se recomienda posicionar la aguja proximal al foramen mandibular, ya que si se posiciona a nivel del foramen, el anestésico local puede no bloquear el nervio dado que, en ese punto, éste desaparece dentro del canal mandibular. Como ya se ha mencionado, existe riesgo de formación de hematomas debido a la presencia de vasos en esta área.
Figura 8
Conejo New Zealand White en decúbito lateral y con la cabeza rotada ligeramente para exponer el espacio intermandibular durante un bloqueo del nervio alveolar mandibular. Nótese el dedo pulgar palpando la incisura vascular en el borde ventral de la mandíbula. La aguja se introducirá medial al músculo pterigoideo con dirección lateral hasta hacer contacto con el aspecto medial de la rama mandibular. Posteriormente, se avanzará cuidadosamente con un ángulo de unos 45º en dirección caudal hacia la articulación temporomandibular, siguiendo el aspecto medial de la rama mandibular y la dirección del nervio alveolar mandibular.
Si el volumen administrado es elevado o la aguja se introduce muy proximal, cerca de la articulación temporomandibular, es posible bloquear la rama lingual. Este hecho no debe ser considerado como una complicación, ya que en algunos casos el nervio lingual se bloquea de forma intencionada, sobre todo si durante la cirugía va a ser necesario resecar colgajos gingivales durante la extracción de piezas dentarias.
Conclusión
En conclusión, por todo lo expuesto, el bloqueo de los nervios maxilar y alveolar resulta posible y efectivo en el conejo. Como sucede con cualquier técnica de anestesia locorregional, el conocimiento detallado de la anatomía local facilita el aprendizaje de la misma y reduce el riesgo de posibles complicaciones.
Fuente de financiación: este trabajo no se realizó con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: el autor declara que no existe conflicto de intereses.
Bibliografía
- 1.
Association, A.V.M. U.S. Pet Ownership & Demographics Sourcebook, American Veterinary Medical Association, 2012, Schaumburg, IL.
- 2.
Harcourt-Brown FM. The progressive syndrome of acquired dental disease in rabbits. J Exotic Pet Med 2007. 16:146-157.
- 3.
Stubinger S. y Dard M. The rabbit as experimental model for research in implant dentistry and related tissue regeneration. J Invest Surg 2013. 26: 266-282.
[PubMed] - 4.
Lennox AM. Diagnosis and treatment of dental disease in pet rabbits. J Exotic Pet Med 2008. 17: 107-113.
- 5.
Lichtenberger M. y Ko J. Anesthesia and analgesia for small mammals and birds. Vet Clin North Am: Exotic Anim Pract. 2007. 10: 293-315.
[PubMed] - 6.
Popesko P, Rajtová V, Horák J. A Colour Atlas of Anatomy of Small Laboratory Animals Volume 1: Rabbit, Guinea Pig, W.B. Saunders Company. 2003.
- 7.
Shahbazian A, Heinemann A, Schmidhammer H, et al. Involvement of μ-and κ-, but not δ-, opioid receptors in the peristaltic motor depression caused by endogenous and exogenous opioids in the guinea-pig intestine. British J of Pharmacol 2002.135: 741-750.
[PMC] - 8.
de Matos R, Campoy L. Investigation of extraoral approaches to maxillary and inferior alveolar nerve blocks in rabbits. International Conference on Avian Herpetological and Exotic mammal medicine (ICARE), Venice 25-27 March 2017.