Bradicardia y bradipnea intensas asociadas a la colocación de un tubo de drenaje torácico en un perro
Intense bradycardia and bradypnea associated with a thoracic drainage tube in a dog
C. Serrano-Casorran, J. J. Esteban-Jiménez, P. Casas-Trasobares, J. Rodríguez-Gómez, M. C. Aceña-Fabián, A. Unzueta-Galarza
Contacto: carolina.serrano@unizar.es
Resumen
Se presenta en consulta una perra mestiza, hembra de un año y medio de edad para realizar una esterilización electiva. Tras el hallazgo de efusión pleural en la valoración preoperatoria se diagnosticó quilotórax idiopático, el cual fue tratado quirúrgicamente. Durante la anestesia se produjo una complicación: una parada cardiorrespiratoria que podría asociarse a un reflejo vagal por el estímulo físico de un tubo de drenaje torácico.
Palabras clave: Quilotórax, Toracotomía, Bloqueo anestésico paravertebral, Conducto torácico, Reflejo vagal.
Summary
A 1.5-year-old female mongrel dog was brought to the Hospital to perform an elective sterilization. After discovering a pleural effusion in the preoperative evaluation, a idiopathic chylothorax was diagnosed that was surgically treated. During maintenance of anaesthesia, a complication occurred: a cardiac arrest that could be associated with a vagal reflex by physical stimulation of a thoracic drainage tube.
Keywords: Chylothorax, Thoracotomy, Anaesthetic paravertebral block, Thoracic duct, Vagal reflex.
Introducción
La efusión pleural hay que tenerla en cuenta en el momento de realizar una anestesia dado que el riesgo de que aparezcan complicaciones es elevado. Cabe destacar la especial necesidad de una monitorización avanzada que incluya capnografía, pulsioximetría, electrocardiografía, mediciones cada 5 minutos de la presión arterial con método Doppler y un control adecuado de la ventilación controlando los valores de espirometría.
La naturaleza de la efusión pleural es variada y una de las posibilidades es que se trate de linfa.1 La etiología del quilotórax es diversa, pero en todas está relacionada con una alteración del drenaje del conducto torácico. Puede tratarse de una obstrucción,2 ya sea total o parcial del conducto torácico asociada a dirofilariosis, trombos en la vena cava caudal, tumores como el linfosarcoma mediastínico, hipertensión linfática o incluso traumatismos. En caso de no poder hallar el origen, se clasificaría como quilotórax idiopático.3
El objetivo de este trabajo es describir una complicación grave asociada a la colocación de un tubo de drenaje torácico en un perro tras la resolución quirúrgica de un quilotórax.
Caso clínico
Se realiza una valoración preoperatoria a una perra mestiza, no esterilizada, de un año y medio de edad y 18 Kg para realizar una ovariohisterectomía de conveniencia. En la anamnesis los dueños refieren que desde el momento de la adopción (dos meses antes) muestra debilidad, delgadez, disnea y toses esporádicas. Se detectan alteraciones respiratorias y palidez de mucosas con tiempo de rellenado capilar aumentado.
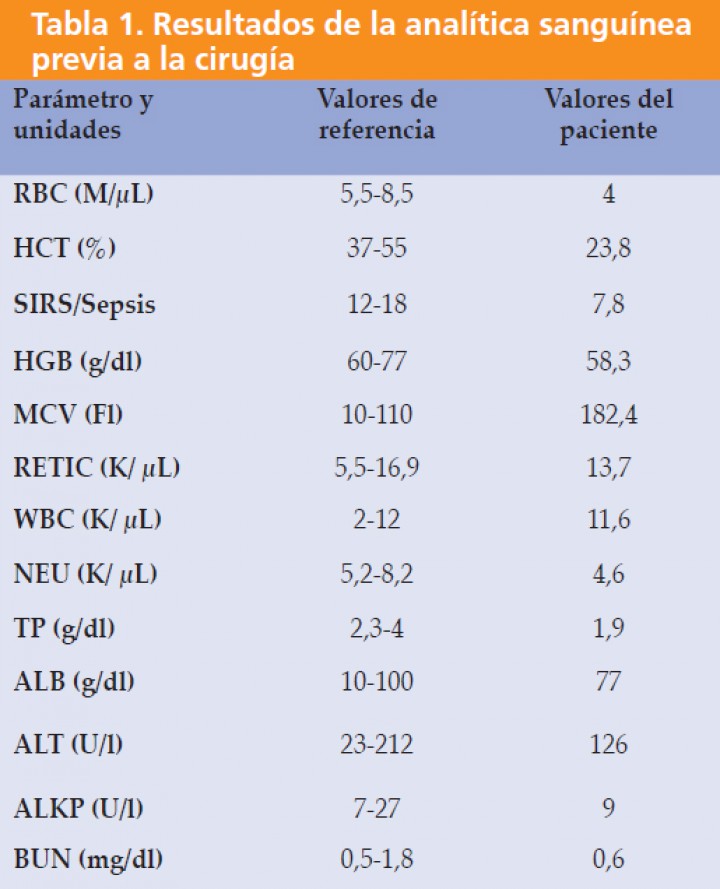
Se realizó analítica sanguínea (Tabla 1), la cual reveló una anemia de tipo regenerativa, así como serología de Leishmania y Dirofilaria (DAT y ELISA), resultando negativas. La radiografía de tórax reveló efusión pleural y en la ecocardiografía no se detectaron anormalidades a excepción de la efusión pleural. En la Tomografía Computarizada (TC) no se detectó nada reseñable que justificara la efusión pleural.
RBC: glóbulos rojos; HCT: hematocrito; SIRS: síndrome de respuesta inflamatoria sistémica; HGB: hemoglobina; MCV: volumen corpuscular medio; RETIC: reticulocitos; WBC: leucocitos; NEU: neutrófilos; TP: proteínas totales; ALB: albúmina; ALT: alanina aminotransferasa; ALKP: fosfatasa alcalina plasmática; BUN: nitrógeno uréico en sangre.
Se analizó una muestra del líquido libre obtenida mediante punción torácica, resultando el cultivo negativo y el análisis de la celularidad compatible con quilotórax. Además, se determinó colesterol y triglicéridos en el líquido pleural y en suero para confirmar el quilotórax. El alto contenido de triglicéridos (en la efusión pleural respecto al nivel de triglicéridos en suero) y de colesterol en el líquido pleural confirmó que la efusión era linfa (Tabla 2). Tras descartar las posibles causas de quilotórax del diagnóstico diferencial, se asumió el origen idiopático. Se trató quirúrgicamente a través de una toracotomía por el 9º espacio intercostal derecho mediante la ligadura del conducto torácico4 y la vena ácigos, junto con la omentalización del espacio pleural.
Anestésicamente, se trata de un procedimiento de dificultad elevada. El paciente se clasificó como ASA IV; no sólo presentaba alteraciones hemodinámicas, sino también respiratorias, tratándose de una enfermedad sistémica grave,5 de manera que son fundamentales la valoración y cuidados preoperatorios.6 Se llevó a cabo electrocardiograma previo, sin detectarse ninguna alteración. Dado el bajo nivel de albúmina mostrado en la analítica previa a la cirugía, se decidió administrar plasma antes de someter al paciente a la intervención.
Se preoxigenó con mascarilla durante todo el periodo preanestésico (20 minutos) y se cateterizaron dos vías periféricas endovenosas: una para la administración de fármacos y la otra para la administración de fluidoterapia (Lactato de Ringer Hartmann Braun®, Barcelona, España) a un ritmo de 3 ml/Kg/h. Se premedicó mediante inyección intramuscular de una mezcla de dexmedetomidina (Dexdomitor® Laboratorios Esteve, Barcelona, España) 2 µg/Kg como tranquilizante/sedante7 y metadona (Metasedin® Laboratorios Esteve, Barcelona, España) 0,3 mg/Kg como analgésico y sedante. Una vez premedicado, se procedió a la inducción anestésica con propofol (Propovet® Laboratorios Esteve, Barcelona, España) 1 mg/Kg, combinado con midazolam (Midazolam Normon, Madrid, España) 0,2 mg/Kg). La tráquea se intubó con un tubo endotraqueal del número 9 y se conectó a un circuito circular cerrado, colocando al paciente en decúbito lateral izquierdo. Se procedió a la administración intravenosa de atracurio (Tracrium GlaxoSmithKline, Madrid, España) 0,1 mg/Kg para poder ventilar mecánicamente. El mantenimiento se llevó a cabo con Isofluorano (Isoflo® Laboratorios Esteve, Barcelona, España) con una fracción espirada de 1,1 %-1,3 % y una mezcla de gases (oxígeno y aire al 50 %).
Se ventiló mecánicamente con una PEEP de 4 cm de H20 y la presión pico no superó los 15 cm de H20, suficiente para mantener una saturación del 99 %, un volumen Tidal y volumen minuto por encima de los requerimientos mínimos necesarios.8 Se monitorizó en todo momento al paciente: temperatura, capnografía, pulsioximetría, electrocardiografía, y presión arterial.
Se realizó un bloqueo de los nervios intercostales mediante una combinación de lidocaína al 2 % (Lidocaína B. Braun Barcelona, España) 6 mg/Kg y bupivacaína al 0,5 % (Bupivacaina B. Braun Barcelona, España) 2 mg/Kg. Se realizó introduciendo la aguja en forma percutánea, lo más próxima a la unión costo-vertebral, sobre el borde caudal de la costilla. La solución anestésica se administró después de haber atravesado los músculos intercostales, sin ingresar al espacio pleural. Se bloquearon los nervios adyacentes intercostales; dos craneales y dos caudales a la incisión (4 espacios infiltrados en total).5
La única complicación que se produjo fue tras la colocación de un tubo de drenaje torácico (Pleuracan® Braun, Melsungen, Alemania) a través del séptimo espacio intercostal derecho al finalizar la intervención y previo al despertar del paciente, cuando éste ya llevaba un tiempo respirando espontáneamente.
Al colocarse el tubo de drenaje torácico, se produjo un descenso lento y progresivo de la frecuencia cardíaca (bradicardia sinusal) y respiratoria, además de una reducción paulatina de la presión arterial del paciente y reducción brusca del CO2 espirado.9,10
La primera medida fue reducir los gases anestésicos al mínimo hasta llegar a una fracción espirada de 0,5 %. En valores todavía de bradicardia y bradipnea se optó por volver a conectar el sistema de ventilación mecánica y administrar un primer bolo intravenoso de atropina (Atropina B. Braun, Barcelona, España) como parasimpaticolítico, a una dosis de 0,01 mg/Kg, para acelerar el ritmo cardíaco y evitar la estimulación vagal mediada por receptores muscarínicos del tipo M2. Existe controversia con dosis bajas de atropina, dado que está descrito que el uso de dichas dosis puede provocar un efecto bradicardizante paradójico debido al bloqueo de receptores muscarínicos presinápticos; sin embargo, es la dosis descrita en caso de producirse un reflejo vagal, que fue la sospecha que nosotros tuvimos.11
La segunda medida de urgencia fue tratar de remontar la presión arterial mediante el aumento de flujo intravenoso de fluidos isotónicos a 20 ml/Kg/h y un bolo intravenoso de hipertónico salino 7,5 % Braun® 5 ml/Kg. La frecuencia cardíaca era de 20 lpm. No era posible medir la tensión arterial mediante método Doppler y no se obtenía pulso. Se administró seguidamente un bolo de expansor plasmático (Hemohes Braun® Melsungen, Alemania) a 5 ml/Kg y se administraron otros dos bolos intravenosos de atropina a 0,01 mg /Kg espaciados 6 minutos con una dosis de adrenalina a 0,02 mg/Kg que consiguieron aumentar la frecuencia cardíaca a 50 ppm; la presión arterial sistólica se pudo medir en valores de 70 mm Hg, pero ante la escasa respuesta al tratamiento se optó por retirar por completo el tubo de drenaje torácico.
La frecuencia cardíaca del paciente aumentó a 180 lpm inmediatamente, al igual que la presión arterial, y el paciente comenzó a respirar de modo autónomo. Después, ambos valores comenzaron a disminuir lentamente hasta que se mantuvieron estables en valores de referencia.
El paciente se recuperó en la UCI del hospital sin que se describiese complicación12-14 o secuela alguna. El mantenimiento analgésico se realizó con una combinación de metadona y lidocaína administrada en perfusión intravenosa constante.
Discusión
En este caso se plantea la posibilidad de que la parada cardiorrespiratoria aguda fuese producida por un reflejo vagal, causado probablemente por una estimulación física directa del tubo de drenaje torácico con el nervio vago o alguna de sus ramas.
Se describe la misma clínica en procedimientos de cirugía ocular o por estimulación del vago en cirugías cervicales o colocación de sondas nasogástricas.13,15 Asimismo, cabe destacar que nuestro paciente apenas respondió a la terapia medicamentosa con atropina o adrenalina y que se produjo el accidente anestésico de modo súbito, al igual que la recuperación, coincidiendo ambos hechos con el momento de la manipulación del tubo de drenaje torácico. A pesar de que si el paciente sufriera un reflejo vagal, éste debería haber respondido a la administración de atropina,16 la ausencia de respuesta podría explicarse por un estímulo mecánico constante del tubo de drenaje sobre el vago, que originaría la bradicardia y bradipnea solamente corregida tras la retirada del tubo de drenaje.
Hay escasas referencias bibliográficas sobre este accidente anestésico colocando un tubo de drenaje torácico, pero dada la rápida respuesta del paciente tras la retirada del tubo, nuestra hipótesis es que fue el factor que desencadenó el reflejo vagal causante del proceso.11,14 En medicina humana, aunque en un bajo porcentaje (1-2 %), está descrito el reflejo vagal debido a un estímulo mecánico por la colocación de un tubo de drenaje torácico. Por lo tanto, consideramos que nuestra hipótesis puede ser válida y explicar la rápida recuperación producida tras la eliminación del agente causal y la ausencia de respuesta a la previa administración de fármacos.15
Fuente de financiación: Este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: Los autores declaran que no existe conflicto de intereses en los datos publicados.
Bibliografía
- 1.
Rodríguez-García JF. Chylothorax in the dog and cat. Small animal and exotics. Proceedings of the North American Veterinary Conference. Orlando: The North American Veterinary Conference Gainesville; 2006 Volume 20, 7-11 January, 2006: 1491-1493.
- 2.
Myers NC, Engler SJ, Jakowski RM. Chylothorax and chylous ascitis in a dog with mediastinal lymphangiosarcoma. J Am Anim Hosp Assoc 1996; 32 (3): 263-268.
- 3.
Espino L, Santamarina G, Vila M, et al. Idiopathic chylothorax in a dog. Med Vet. 2001;18(9): 547-551.
- 4.
Nishimura M., Aikawa T, Sadahiro S, et al. The atelectactic lungs caused by the fibrosing pleuritis due to idiopathic chylothorax treated successfully with the pericardectomy, omentalization and long term negative pressure care in a cat. Jap J of Vet Anesth & Surg 2013, 44:17-21.
- 5.
Ludwig LL. Surgical emergencies of the respiratory system. The Vet Clin of North Am, (Small Anim Pract) 2000; 30(3): 531-53.
[PubMed] - 6.
Gonzalez IA. Anestesia en cirugía torácica. En: Rodriguez GJ, Martinez SMJ, Graus MJ, editores. Cirugía en la clínica de pequeños animales, el tórax. Zaragoza: Servet, 2011;258-264.
- 7.
Belda E, Laredo FG, Escobar M, Agut A, Soler M. Agonistas α-2 adrenérgicos en sedación y anestesia veterinaria. An Vet 2005; (21): 23-33.
- 8.
Matsumoto K. Changes in thorax-lung compliance during general anesthesia with mechanical ventilation in response to various intraoperative maneuvers. Jap J of Vet Anesth & Surg 2006, 55(6):704-707.
[PubMed] - 9.
Kawasaki K, Hoshino K, Takahashi M, et al. Sudden bradycardia and hypotension in five patients under spinal anesthesia during transurethral resection of the prostate. Masui. 2002, 51(9): 992-995.
[PubMed] - 10.
Kim YS. Nasogastric and nasoenteric tube insertion. En: Pfenninger JL, Fowlder GC, eds. Pfenninger & Fowler’s Procedures for Primary Care. Philadelphia: Elsevier Mosby; 2011. chap 203.
- 11.
Fragio AC. Parada cardiorespiratoria. En: Fragio AC editor. Manual de urgencias en pequeños animales. Barcelona. Multimedia ediciones veterinarias; 2014. p. 139-163.
- 12.
Liptak JM, Monnet E, Dernell WS, et al. Pneumonectomy: four case studies and a comparative review. J Small Anim Pract 2004, 45(9):441-447.
[PubMed] - 13.
Meakin LB, Salonen LK, Baines SJ, et al. Prevalence, outcome and risk factors for postoperative pyothorax in 232 dogs undergoing thoracic surgery. J Small Anim Pract 2013, 54(6): 313-317.
[PubMed] - 14.
Da Silva CA, Monnet E. Long-term outcome of dogs treated surgically for idiopathic chylothorax: 11 cases (1995-2009). J Am Vet Med Assoc. 2011, 239(1):107-113.
[PubMed] - 15.
Epstein E, Jayathissa S. Chest tube drainage of pleural effusions an audit of current practice and complications at Hutt Hospital. N Z Med J. 11; 125(1354):26-35.
[PubMed] - 16.
Ward EW and Hughes TE. Sudden death following chest tube insertion: an unusual case of vagus nerve irritation. J of Trauma 1994, 36(2):258–259.
[PubMed]