Mesotelioma peritoneal en una rata (Rattus norvegicus) mascota
Peritoneal mesothelioma in a pet rat (Rattus norvegicus)
R. Domingo, J. Jiménez, C. Moragas
Contacto: roger@curemelsaltres.com
Resumen
Los mesoteliomas peritoneales en ratas se han descrito principalmente en condiciones experimentales por la exposición a contaminantes industriales. En este caso, se describe una hembra de rata (Rattus norvegicus) mascota con distensión abdominal y ascitis diagnosticada de mesotelioma peritoneal espontáneo.
Palabras clave: rata, Rattus norvegicus, distensión abdominal, ascitis, mesotelioma peritoneal, neoplasia, ecografía.
Clin. Vet. Peq. Anim, 2019, 39 (2): 83-87
Summary
Peritoneal mesothelioma in rats has been mainly described in experimental conditions under the exposure to industrial contaminants. In this case, we describe a female pet rat (Rattus norvegicus) with abdominal distension and ascites diagnosed for spontaneous peritoneal mesothelioma.
Keywords: rat, Rattus norvegicus, abdominal distension, ascites, peritoneal mesothelioma, neoplasia, ultrasound.
Clin. Vet. Peq. Anim, 2019, 39 (2): 83-87
Introducción
La creciente popularidad de las ratas (Rattus norvegicus) como animales de compañía abre la puerta a la descripción de nuevas patologías que hasta el momento sólo habían sido descritas en animales de experimentación. En este artículo se describe el caso de una hembra de rata con distensión abdominal diagnosticada de mesotelioma peritoneal por histopatología; este es el primer caso de esta neoplasia descrito en ratas domésticas.
Caso clínico
Hembra de rata mascota de 1,5 años y 380 g de peso, atendida por distensión abdominal súbita de 4 días de duración. La paciente convivía en la misma jaula con otras dos hembras, adquiridas juntas a la edad de 1 mes en una tienda de mascotas.
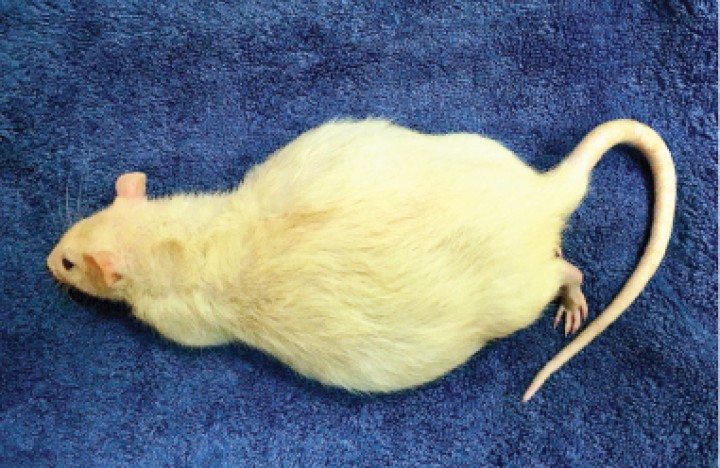
El examen físico confirmó la distensión abdominal con ausencia de masas palpables (Fig. 1). La radiografía mostró una pérdida de visualización de serosas y leve meteorismo, compatible con ascitis. Se procedió a la sedación de la paciente con 2 mg/kg de midazolam s.c. (Midazolam Normon, Tres Cantos) para el estudio ecográfico. La ecografía reveló gran cantidad de líquido libre abdominal con ecos internos, sugerente de alta celularidad y múltiples lesiones nodulares, levemente irregulares de 2-3 mm hipoecoicas y otras más ecogénicas repartidas por todo el omento y peritoneo (Fig. 2). Por punción ecoguiada se retiraron 20 ml de líquido ascítico de color marrón rojizo. El resto del estudio ecográfico abdominal no mostró alteraciones. Se planteó un diagnóstico diferencial de neoplasia difusa, metástasis peritoneal o granulomas peritoneales.
Figura 1
La paciente con distensión abdominal por acumulación de líquido ascítico.
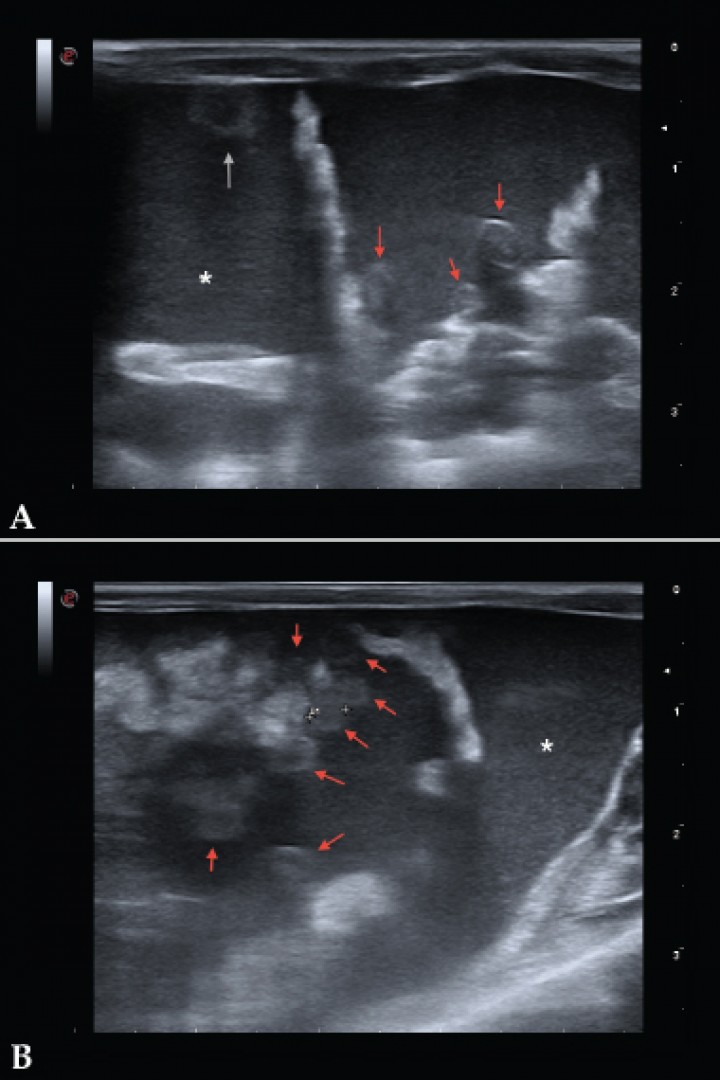
Figura 2
Imágenes ecográficas de la cavidad abdominal. Se observan varios nódulos de 3 mm aproximadamente, hipoecoicos (algunos se observan más ecogénicos que otros) y de superficie levemente irregular; uno localizado en la superficie de la pared ventral peritoneal (flecha gris) y otros en omento (flechas rojas). Abundante líquido libre abdominal con abundantes ecos internos (asterisco).
Se inició un tratamiento preventivo con doble antibioterapia, enrofloxacino 10 mg/kg/12 h PO (Alsir 5%, Ecuphar, Barcelona) y metronidazol 30 mg/kg/12 h PO (Flagyl susp. oral, Sanofi, Barcelona), junto con meloxicam 0,4 mg/kg/12 h PO (Meloxoral 1,5 mg/ml, Fatro Ibérica, Sant Just Desvern).
El resultado del análisis de líquido ascítico (Tabla 1) en un laboratorio externo mostró un exudado con alta celularidad de hematíes y algunos leucocitos. El estudio citológico mostró una celularidad de morfología mastocítica y la presencia de células polimorfonucleares eosinófilas. En base a los resultados, se orientó el diagnóstico diferencial hacia un proceso de tipo no infeccioso. Se decidió suspender la antibioterapia y se propuso a los propietarios realizar una biopsia de las lesiones. Frente a la sospecha de un proceso neoplásico, y para evitar el sufrimiento del animal, los propietarios prefirieron no continuar con el protocolo diagnóstico.
Se decidió administrar un tratamiento paliativo con meloxicam (Meloxoral 1,5 mg/ml, Fatro Ibérica, Sant Just Desvern) a dosis de 0,2 mg/kg/24 h PO de forma indefinida junto con protector gástrico (40 mg/kg/24 h de hidróxido de aluminio PO, Vetgastril, Pharmadiet, Hospitalet de Llobregat). Un mes más tarde, los propietarios observaron disminución de la actividad del animal, separación del resto del grupo e hiporexia. La distensión abdominal había empeorado notablemente y se procedió a la eutanasia humanitaria a petición de los propietarios.
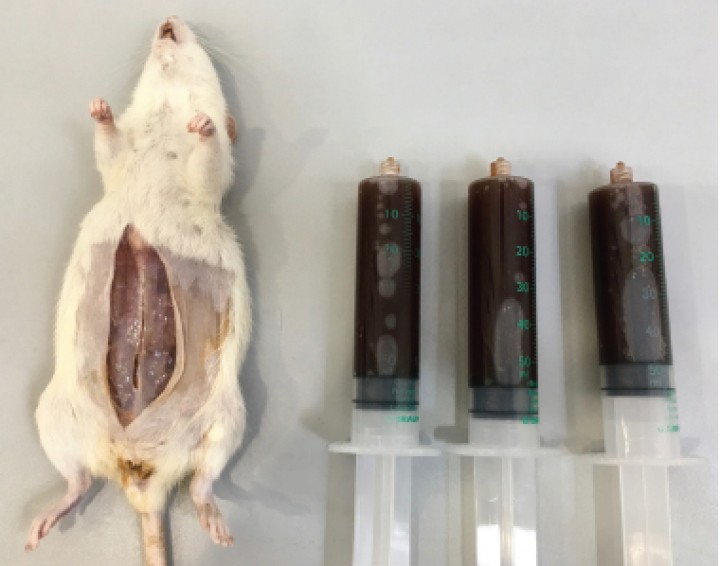
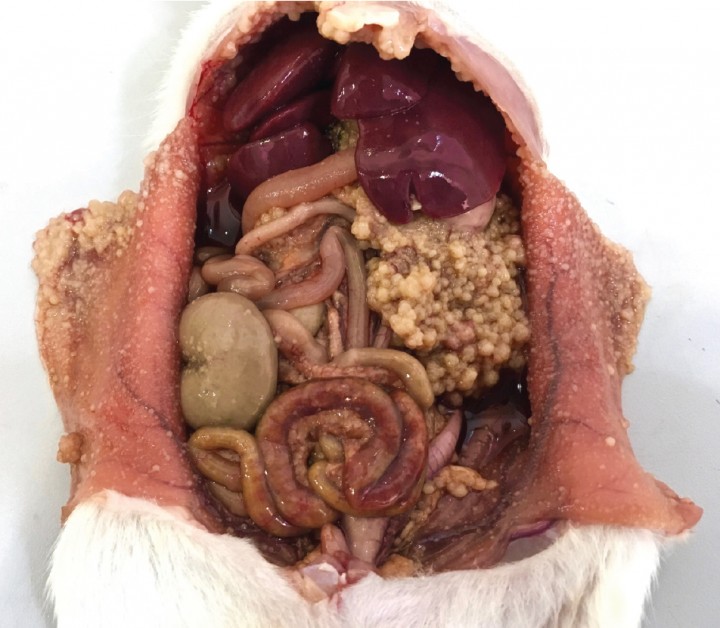
En la necropsia se retiraron 150 ml de líquido ascítico marrón rojizo (Fig. 3) y se observó un fino granulado (1 mm) adherido a toda la cavidad peritoneal con nódulos dispersos de mayor tamaño (2-3 mm). El omento, el mesenterio y el diafragma se encontraban recubiertos de tumoraciones de un diámetro de 2-4 mm, al igual que las serosas de algunos órganos (intestinos, riñones) (Fig. 4). Las tumoraciones no invadían el interior de los órganos o la musculatura. Se tomaron muestras en formalina tamponada al 10 %.
Figura 3
Líquido ascítico retirado de la cavidad abdominal en el momento de la necropsia.
Figura 4
Imagen macroscópica de la cavidad abdominal con el peritoneo y la superficie de los órganos y el omento recubiertos por tumoraciones.
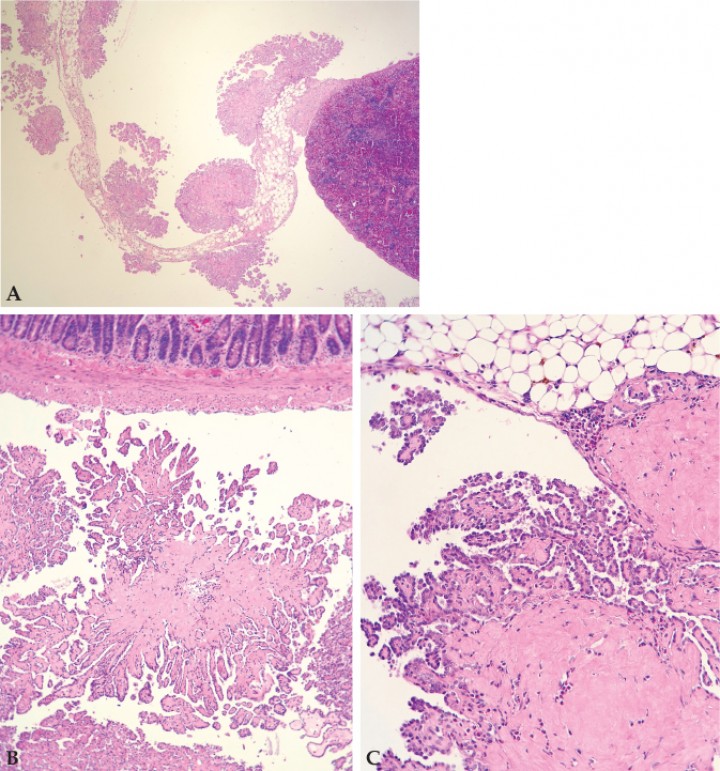
Se procedió a la preparación de las muestras en bloques de parafina y tinción con hematoxilina-eosina. Los resultados del estudio histopatológico revelaron un mesotelioma en el peritoneo visceral. Las células neoplásicas mesoteliales se organizaban en crecimientos papilares en el peritoneo visceral de diversos órganos y omento/tejido adiposo mesentérico, los cuales se apoyaban en una cantidad generalmente baja de estroma. Las células mesoteliales se caracterizaban por un núcleo de redondo a elíptico con la cromatina laxa y 0-2 nucléolos muy pequeños, así como por la presencia de escaso citoplasma. La anisocitosis y anisocariosis eran moderadas, mientras que el pleomorfismo y la anaplasia eran de grado bajo. El índice mitótico era muy bajo (0-1 mitosis por campo de 40 aumentos). En algunos focos, el estroma estaba expandido por depósitos de material eosinófilo amorfo, interpretado como probable amiloide intratumoral, así como por infiltrados de granulocitos y mastocitos, y depósitos de hemosiderina. También se encontraron otras lesiones como depósitos intracitoplasmáticos de pigmento marrón verde en el riñón, hematopoyesis extramedular moderada y hemosiderosis leve de macrófagos en el bazo, pero sin relación evidente con la presentación clínica (Fig. 5).
Figura 5
(A) Crecimientos papilares de células mesoteliales neoplásicas en el peritoneo visceral del bazo (Hematoxilina-eosina, x5,76). (B) Intestino (Hematoxilina-eosina, x14,4). (C) Mesotelioma con formaciones papilares adherido a tejido adiposo y mesenterio con material eosinófilo intratumoral compatible con amiloide (Hematoxilina-eosina, x28,8).
Discusión
La presencia de neoplasias en ratas es habitual, especialmente los fibroadenomas mamarios, los tumores de células intersticiales y los adenomas pituitarios; algunas cepas de ratas utilizadas en experimentación también suelen ser proclives a presentar otras neoplasias como leucemias linfocíticas y neoplasias adrenales o pancreáticas.1,2 En este caso describimos un mesotelioma peritoneal espontáneo, que en conocimiento de los autores no había sido previamente descrito en ratas mascota. La bibliografía consultada describe principalmente mesoteliomas inducidos experimentalmente en ratas de laboratorio usadas como modelo para el estudio de los mesoteliomas humanos.3,4
La aparición de mesoteliomas suele estar relacionada con la exposición a contaminantes industriales (amianto, erionita, torio y mica) y radiación, aunque en ganado se atribuye habitualmente a causas congénitas.5-9 La bibliografía consultada hace referencia a otros casos de mesoteliomas en animales, como mesoteliomas espontáneos en ratas de laboratorio de la cepa F344/N,4,10 mesoteliomas malignos en hámsteres sirios (Mesocricetus auratus) infectados experimentalmente por virus simio 40 (SV40),6,8 mesotelioma en ratones suizos (Mus musculus) expuestos a poliomavirus,7 un mesotelioma peritoneal espontáneo en una hembra de conejo (Oryctolagus cuniculus) con distensión abdominal,7 mesotelioma pericárdico en 5 Golden Retriever11 y mesoteliomas en peritoneo, pericardio y sacos aéreos de pollos infectados por el virus de la leucosis aviar.8
Los estudios recientes con ratas sugieren que una causa inicial puede desencadenar varias reacciones que incrementen el riesgo a padecer mesotelioma. El agente tóxico, infeccioso o inflamatorio desencadenante actúa a distintos niveles causando alteraciones en el ADN, en la regulación del crecimiento y la proliferación celular, además de una inflamación crónica que provoca la liberación de radicales libres y oxidantes con efecto mutagénico por parte de los macrófagos.4,6
Desde que el animal entra en contacto con el agente etiológico hasta que desarrolla el mesotelioma pueden pasar de meses a años, dificultando el establecimiento de la relación directa causa-efecto.3,6,8,9 En este caso, no hay conocimiento en la historia clínica del animal de contacto con amianto u otros minerales ni con radiación desde la adquisición. En humanos menos del 50 % de los casos de mesotelioma peritoneal maligno están causados por amianto.5 En los casos relacionados con el amianto, éste es mayormente inhalado y llega a la cavidad peritoneal migrando por el sistema linfático; suelen ir asociados a una gran exposición ambiental y la presencia de mesoteliomas pleurales.6
La presencia de mesoteliomas espontáneos se produce con una incidencia baja en machos de rata de la cepa F344/N (3,2 %) y suelen originarse en la túnica vaginal. En hembras de esta cepa, la presentación es todavía menor (0,17 %) y se originan en varias zonas del peritoneo.4 Se desconoce el origen genético de la paciente por provenir de un criadero de alimento vivo para mascotas, aunque no es posible descartar que en la línea genética de sus antecesores pudiera haber individuos de la cepa F344/N.
El estudio histopatológico no reveló la presencia de virus ni procesos inflamatorios crónicos en las muestras examinadas que hubieran podido desencadenar la aparición del mesotelioma.
El cuadro clínico en animales con mesotelioma peritoneal es de distensión abdominal (ascitis), pérdida de condición corporal conforme la patología progresa y obstrucciones intestinales secundarias a las adhesiones.3,7 En este caso se observó distensión abdominal con gran cantidad de líquido exudado en la cavidad peritoneal como síntoma principal, sin otras alteraciones iniciales. Conforme la patología progresó, la paciente mostró hiporexia y apatía, probablemente asociadas al dolor abdominal y la dificultad de movimiento.
Los hallazgos en la necropsia son consistentes con los descritos previamente por otros autores.3,7
La ecografía ha demostrado ser una buena herramienta para orientar el diagnóstico y ayudar a la retirada segura de líquido ascítico. El análisis del líquido ascítico permite descartar un proceso infeccioso pero no es útil para el diagnóstico definitivo de este tipo de neoplasia. La abundante presencia de mastocitos en el líquido ascítico no debe confundirse con un mastocitoma, ya que las ratas presentan grandes cantidades de mastocitos maduros de forma fisiológica en tejidos mucosos que están en contacto con el medio externo, como es el tracto intestinal.12
En este caso, los propietarios no quisieron continuar adelante con el tratamiento y tampoco está descrito ningún protocolo de quimioterapia para ratas mascotas con mesotelioma, aunque existen estudios prometedores en animales de experimentación con curcumina intraperitoneal.13 En humanos los tratamientos que se han mostrado más efectivos para el mesotelioma maligno peritoneal son la cirugía citorreductiva junto con quimioterapia caliente intraperitoneal.5
Los mesoteliomas son neoplasias poco frecuentes tanto en perros y ratas como en humanos;4,8 es más habitual en machos que en hembras y el mesotelioma pleural es más frecuente que el peritoneal.5 En este caso, describimos un mesotelioma peritoneal en una hembra de rata, sin exposición aparente a agentes ambientales tóxicos ni virus. Este caso plantea la necesidad de incluir el mesotelioma peritoneal en el diagnóstico diferencial de las ratas mascota con distensión abdominal.
Agradecimientos
A Carles Joan Sallés (Noah’s Path) por el diagnóstico histopatológico, la descripción y las imágenes histológicas proporcionadas. A la propietaria por permitirnos la toma de muestras e imágenes post-mortem para su estudio.
Fuente de financiación: este trabajo no se realizó con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran que no existe conflicto de intereses en los datos publicados.
Bibliografía
- 1.
Haines, V. L.: The Ancient Rat. Vet Clin Exot Anim 2010; 13:95-105.
- 2.
Kohn D. F., Clifford C. B.: Biology and Diseases of Rats. En Fox J. (Ed): Laboratory Animal Medicine, 2nd Ed., Academic Press, 2002; 121-165.
- 3.
Craighead J.E., Akley N. J., Gould L. B., Libbus B.L.: Characteristics of Tumors and Tumor Cells Cultured From Experimental Asbestos-Induced Mesotheliomas in Rats. Am J Pathol 1987;129(3):448-462.
[PMC] - 4.
Blackshear P.E., Pandiri A.R., Ton T.T., et al.: Spontaneous Mesotheliomas in F344/N rats are characterized by dysregulation of cellular growth and immune function pathways. Toxicol Pathol 2014; 42(5):863-876.
[PubMed] - 5.
Kim J., Bhagwandin S., Labow D. M.: Malignant peritoneal mesothelioma: a review. Ann Transl Med 2017; 5(11):236-247.
[PMC] - 6.
Carbone M., Ly B. H., Dodson R. F., et al: Malignant Mesothelioma: Facts, Myths and Hypotheses. J Cell Physiol 2012; 227(I):44-58.
[PubMed] - 7.
Lichtensteiger C. A., Leathers C. W.: Peritoneal mesothelioma in a rabbit. Vet Pathol 1987; 24:464-466.
[PubMed] - 8.
Cicala C., Pompetti F., Carbone M.: SV40 Induces Mesotheliomas in Hamster. Am J Pathol 1993; 142(5):1524-1533.
[PubMed] - 9.
Wagner J.C., Skidmore J.W., Hill R.J., Griffiths D.M.: Erionite exposure and mesotheliomas in rats. Br J Cancer 1985; 51:727-730.
[PMC] - 10.
Gould D.H.: Mesotheliomas of the tunica vaginalis propria and peritoneum in Fischer rats. Vet Pathol 1977; 14(4):372-379.
[PubMed] - 11.
Machida N., Tanaka R., Takemura N., Fujii Y., Ueno A., Mitsumori K.: Development of pericardial mesothelioma in golden retrievers with a long-term history of idiopathic haemorrhagic pericardial effusion. J Comp Pathol 2004; 131(2-3):166-175.
[PubMed] - 12.
Saavedra, Y.: Actividad de los mastocitos de la mucosa intestinal en ratas con hipersensibilidad y mecanismos neuroendocrinos reguladores de la función mastocitaria. Tesis doctoral 2005.
- 13.
Pouliquen D.L., Nawrocki-Raby B., Nader J. et al: Evaluation of intracavitary administration of curcumin for the treatment of sarcomatoid mesothelioma. Oncotarget 2017; 25 8(34):57552-57573.
[PubMed]