Mieloma múltiple en el gato
Multiple myeloma in the cat
C. de la Riva, N. Rayón, N. del Castillo
Contacto: cdelafra@gmail.com
Resumen
El mieloma múltiple (MM) en gatos supone menos del 1 % de todas las neoplasias malignas, con una edad media de presentación de 12-14 años. Se trata de una enfermedad sistémica, en la que se produce una expansión clonal de células plasmáticas con la consecuente síntesis de inmunoglobulinas (Ig). En el gato suele cursar con un cuadro inespecífico de debilidad generalizada y anorexia, y es la presencia de hiperglobulinemia la que debe orientar al clínico a incluir el MM entre los diagnósticos diferenciales. En este artículo se revisan los signos clínicos, el diagnóstico y las opciones terapéuticas descritas hasta el momento.
Palabras clave: mieloma múltiple, inmunoglobulinas, gato, proteinuria.
Clin Vet Peq Anim 2020, 40 (1): 7-14
Summary
Multiple myeloma (MM) in cats accounts for less than 1% of malignancies, the average age of presentation is 12-14 years. It is a systemic disease, in which there is a clonal expansion of plasma cells that results in the synthesis of immune globulins (Ig). Its course in cats is nonspecific, with generalized weakness and anorexia. The presence of hyperglobulinemia should make the clinician suspicious of this disease. This article is a review of the clinical signs, diagnosis and treatment options described in the literature.
Keywords: multiple myeloma, immune globulins, cat, proteinuria.
Clin Vet Peq Anim 2020, 40 (1): 7-14

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
Los desórdenes relacionados con el mieloma (MRD, por sus siglas en inglés) tienen lugar cuando las células plasmáticas o los precursores de linfocitos B productores de inmunoglobulinas (Ig) se transforman y proliferan como células neoplásicas. Normalmente, esta proliferación es monoclonal, aunque se han descrito proliferaciones biclonales y policlonales.1
Dentro de los MRD se incluyen el mieloma múltiple (MM), el plasmocitoma extramedular (EMP, por sus siglas en inglés; cutáneo y no cutáneo), la enfermedad de Waldenströms (macroglobulinemia de IgM), el plasmocitoma óseo solitario (SOP, por sus siglas en inglés) y los linfomas y leucemias secretores de Ig (lo que incluye la leucemia de células plasmáticas).1 De todas ellas, el MM es la presentación más frecuente, tanto en el perro como en el gato.
El MM supone menos del 1 % de todas las neoplasias malignas y menos del 2 % de los tumores hematopoyéticos en el gato, con una edad de presentación de 12-14 años.1-4 No se ha confirmado predisposición racial ni sexual, aunque el macho podría estar sobrerrepresentado.1
Se trata de una enfermedad sistémica con origen en la médula ósea (MO) en la que se produce una expansión clonal de células plasmáticas que da lugar a la síntesis de Ig1,2,5 y que puede extenderse a otros órganos, a diferencia del plasmocitoma, que es un tumor sólido de células plasmáticas que se origina generalmente en la piel, el músculo o el hueso.
Se desconoce la etiología de esta neoplasia, tanto en medicina humana como veterinaria. En personas se ha asociado a entornos de la industria agrícola, a productos derivados del petróleo y a la exposición crónica a estímulos antigénicos. A nivel molecular, el MM se ha asociado con la sobreexpresión del oncogen c-myc (en personas) y la proteína del ciclo celular ciclina D (tanto en personas como en el perro).1,3,5 No se ha demostrado en la especie felina relación con la infección del virus de la leucemia felina (FeLV) ni de la imnunodeficiencia (FIV).1,2,5
El MM felino suele cursar con un cuadro inespecífico de debilidad generalizada y anorexia, al igual que en el perro. Una característica que debe hacer sospechar de esta enfermedad es la presencia de hiperglobulinemia, acompañada en muchos casos de proteinuria. Así como en el perro es frecuente la afectación ósea y la consecuente cojera, en el gato la presentación más común incluye la infiltración neoplásica de órganos abdominales.1,2,6,7
En este artículo se muestra una imagen global del MM en gatos y sus diferencias con la presentación en la especie canina, así como su tratamiento.
Patogenia
Como se ha mencionado, el MM es la consecuencia del crecimiento monoclonal de las células plasmáticas neoplásicas en la MO, lo que deriva en un exceso de síntesis de paraproteínas y la infiltración de diferentes tejidos por parte de las células tumorales.1 El término paraproteína hace referencia tanto a la molécula de Ig como a alguno de sus componentes (cadenas ligeras o pesadas).1,2 La fuga de cadenas ligeras libres en la orina da lugar a proteinuria. Por lo tanto, esta producción homogénea de paraproteínas origina un pico de proteínas, normalmente monoclonal, tanto en suero como en orina.3,5
Las gammapatías más comunes en personas, perros y gatos son las de las inmunoglobulinas IgG e IgA, y, solo en algunos casos, las de la IgM.5
Mientras que en el MM del perro es frecuente encontrar hiperglobulinemia de tipo IgG o de IgA con una frecuencia similar (50 % de cada tipo), en el gato, lo más habitual es identificar una gammapatía monoclonal de IgG (80 % de los casos)1,8 con mayor frecuencia que de IgA (20 % de los casos).9,10 Es importante recalcar la posibilidad de diagnosticar hiperglobulinemias biclonales en algunos casos1,5 o, incluso, policlonales.3,11
Otros diagnósticos diferenciales que cursan con gammapatía monoclonal son las gammapatías monoclonales de origen desconocido, las infecciones crónicas [por ejemplo, Leishmania, Erlichia, piodermas y peritonitis infecciosa felina (PIF)] y otras neoplasias linforreticulares [como leucemia linfoblástica aguda (LLA) o linfoma de tipo B].5,11 Se ha descrito el desarrollo de MM en un gato con infección por Anaplasma platys, Bartonella y Mycoplasma.12
En raras ocasiones, se pueden observar MM no secretores, por lo que la ausencia de una gammapatía monoclonal no excluye por completo un posible diagnóstico de MM.1,2
Signos clínicos, consecuencias fisiopatológicas y procedimiento diagnóstico
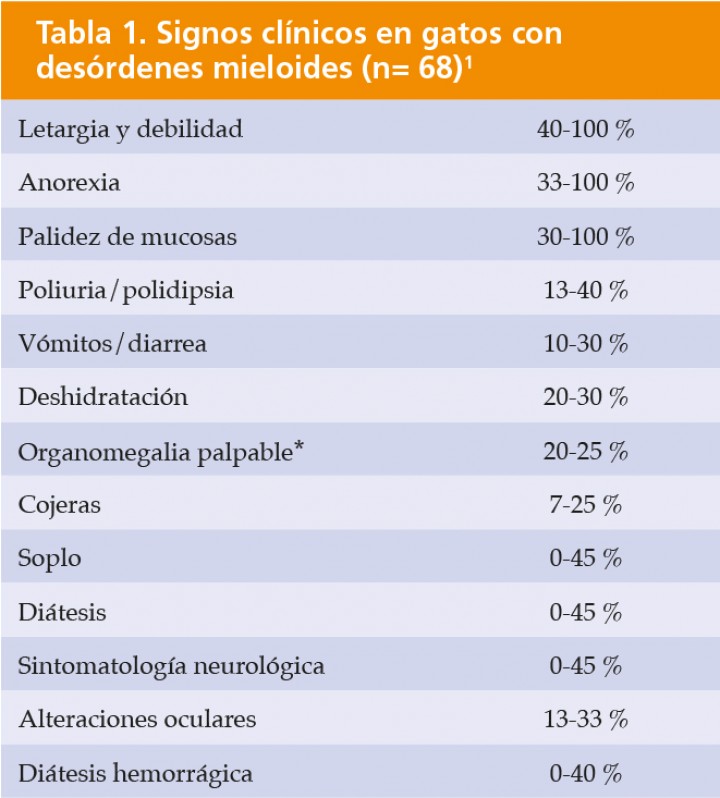
La presentación clínica en gatos con MM es muy variable. Los signos clínicos suelen ser inespecíficos, tales como depresión, infecciones crónicas, anorexia, enfermedad renal, vómitos y diarreas, pérdida de peso, alteraciones neurológicas y diátesis hemorrágicas.5,11 Se han descrito casos de cojera, paresia y ataxia.4 Al igual que en el perro, los signos clínicos pueden estar presentes mucho tiempo antes del diagnóstico, desde 1 mes hasta 1 año (Tabla 1). Las principales complicaciones a largo plazo del MM en el gato son similares a las descritas en el perro: enfermedad renal, alteraciones hemostáticas, infecciones y compresión de la médula.1,2,6-8,11
* Véase Tabla 4
Los signos clínicos se asocian a los efectos de las paraproteínas en la circulación sistémica y a la infiltración neoplásica de las células tumorales en los diferentes órganos, así como a su presencia en la MO, por lo que, de forma secundaria a la proliferación neoplásica en la MO, puede advertirse anemia y plasmocitosis.1,2,3,11
Por lo tanto, en los gatos con MM puede desarrollarse:
1. Síndrome de hiperviscosidad: hace referencia a los signos clínicos derivados de un aumento de la viscosidad de la sangre en pacientes con MRD, policitemia vera y eritrocitosis como síndrome paraneoplásico.1 En gatos con MRD suele ser secundaria a macroglobulinemia por IgM.1,3,5 Las manifestaciones clínicas más frecuentes derivadas de la hiperviscosidad sanguínea son los síntomas neurológicos (ataxia e incoordinación), las retinopatías y la cardiomiopatía (2/3 de los gatos con MM presentan cardiomegalia en las radiografías torácicas, y, más de la mitad, soplo cardíaco durante la exploración física).1,2,11,13-15
2. Diátesis hemorrágica: en gatos es menos común que en el perro, pero se han descrito casos de efusiones hemorrágicas pleurales y peritoneales. Los mecanismos por los que se producen son la trombocitopatía debida al recubrimiento de las plaquetas con paraproteínas –lo que conduce a una disfunción– y la interferencia con los factores de coagulación. Otras causas potenciales de sangrado incluyen anomalías en la formación y polimerización de la fibrina, fragilidad tisular asociada a amiloidosis, hipervolemia secundaria a la hiperviscosidad y trombocitopenia verdadera (50 % de los gatos con MM). Un cuarto de los gatos con MM tiene signos clínicos de sangrado;1 los más comunes son epistaxis, hemorragia intraocular y sangrado gingival. Los tiempos de coagulación pueden estar aumentados.1,2,3,11
3. Citopenias: anemia (normocítica, normocrómica, no regenerativa), como consecuencia de enfermedad crónica o anemia hemorrágica secundaria a coagulopatía. La presencia de pancitopenia es más frecuente en animales con afección severa de la médula ósea.1-3 Se ha descrito MM eritrofagocitario tanto en personas como en perros y gatos.1,16
4. Hipercalcemia: en el estudio de Patel y cols. (2005), el 20 % de los gatos diagnosticados de MM presentaron hipercalcemia en base a la concentración total de calcio sérico. Es importante diferenciar entre el calcio total y el calcio ionizado. Se puede encontrar hipercalcemia con aumento del calcio total, pero con valores de calcio ionizado normales, ya que las paraproteínas se unen al calcio sérico, sin afectar al calcio ionizado. También se postula que la hipercalcemia sea secundaria a resorción ósea5 cuando existen lesiones líticas en los huesos, o al desarrollo de hipercalcemia maligna por la secreción de sustancias PTH like por parte del tumor (en cuyo caso también se ve aumentado el calcio ionizado).11
5. Enfermedad renal: (presente hasta en 1/3 de los pacientes) puede ser el resultado de la infiltración de las células neoplásicas en el riñón, de la proteinuria de Bence Jones (de cadena ligera) y/o de la disminución de la tasa de filtración glomerular (TFG) debido a la hiperviscosidad o la deshidratación. De forma secundaria, si hay hipercalcemia, se predispone al desarrollo de azotemia prerrenal por deshidratación o de enfermedad renal intrínseca por nefrotoxicidad endógena del calcio. La sintomatología principal es la presencia de poliuria y polidipsia, situación de difícil identificación por parte del propietario en esta especie.1-3,6,7
6. Proteinuria de Bence Jones: se ha descrito en el 40 % de los gatos con MM. La síntesis de cadenas ligeras y pesadas está equilibrada en la producción de Ig no neoplásicas, pero en el caso del MM, se sintetiza un exceso de productos de cadena ligera, es decir, de bajo peso molecular, que se filtran a nivel renal. Su presencia en la orina produce precipitados de proteínas y, posteriormente, lesiones renales.1,2,7,11
7. Infecciones secundarias: la inmunodeficiencia asociada a MM es probablemente un fenómeno secundario a la disminución de la producción de Ig funcionales, la supresión de la diferenciación y de la funcionalidad normal de los linfocitos B en respuesta a la presencia de estimulación antigénica, el aumento de la destrucción de globulinas gamma y/ o la leucopenia derivada de la infiltración medular (cito/pancitopenias).1,3
8. Lesiones óseas: pueden variar entre la presencia de áreas líticas discretas o, incluso, osteopenia difusa (20-58 % de los gatos). Los huesos con mayor actividad hematopoyética parecen estar más afectados, de forma que, de mayor a menor frecuencia, se han descrito lesiones en la columna vertebral, la pelvis, las costillas y los huesos largos proximales y distales.1-3,11,13,17 La incidencia de lesiones óseas identificadas por radiografía varía enormemente en función de los artículos consultados (8-65 %).1
9. Organomegalia: es el hallazgo más habitual en las pruebas de diagnóstico por imagen en los gatos con MM, con sobrerrepresentación en el hígado y el bazo, seguido de renomegalia y cardiomegalia.1,3,6,7
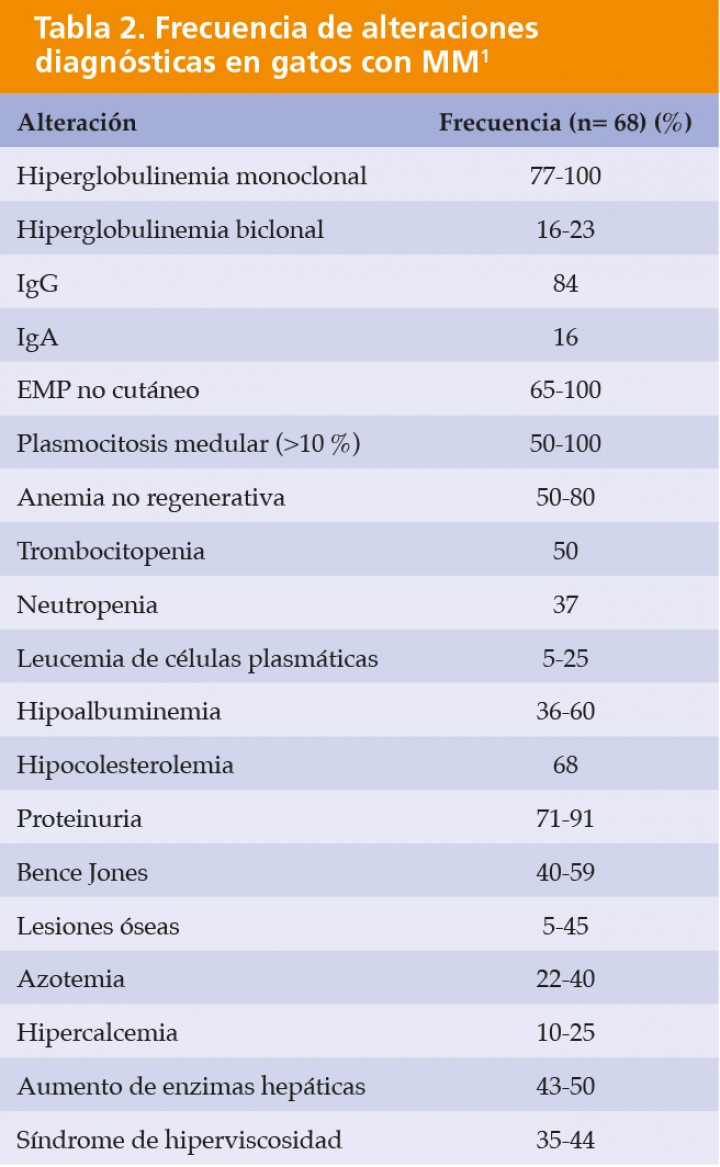
En resumen, tras la exploración física y los resultados de los análisis sanguíneos de un gato con sintomatología inespecífica, la primera pista para sospechar de MM en gatos es la presencia de hiperglobulinemia (Tablas 2 y 3), descrita hasta en el 87,7 % de los casos en el estudio con mayor población de gatos hasta el momento.2
EMP: plasmocitoma extramedular.
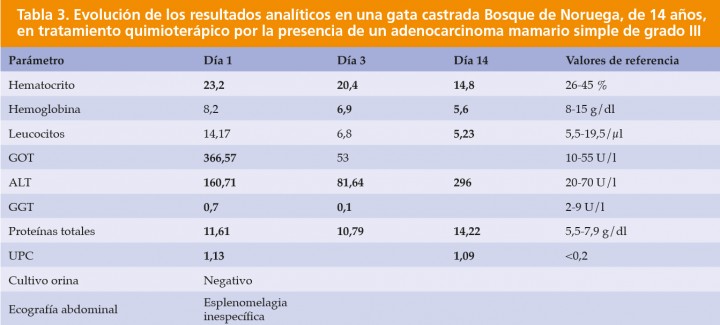
Nota: la gata convivía con más gatos, uno de los cuales había fallecido recientemente por peritonitis infecciosa felina. La sintomatología clínica de la paciente era totalmente inespecífica, con decaimiento, pérdida de peso y anorexia. Debido a la presencia de enfermedades infecciosas en el núcleo familiar, se descartó la presencia de leucemia, inmunodeficiencia, Neospora, Toxoplasma y peritonitis infecciosa felina durante su hospitalización con terapia de soporte.
Nota 2: los valores fuera de rango aparecen en negrita en la Tabla.
ALT: alanina aminotransferasa; GGT: gamma glutamil transferasa; GOT: glutamato oxalacetato transaminasa; UPC: ratio proteína/creatinina en orina.
Ante la sospecha de un tumor de células plasmáticas, debe realizarse un procedimiento diagnóstico mínimo que incluya un hemograma completo con estudio del frotis, una bioquímica sanguínea completa que incluya, al menos, calcio total, y un urianálisis completo con UPC (ratio proteína/creatinina en orina). También está indicado realizar pruebas de coagulación, si hay hemorragias, y la exploración del fondo de ojo. Las pruebas de diagnóstico por imagen (como radiografías de tórax y ecografía abdominal) pueden ser de gran utilidad.
Así, los hallazgos más habituales en gatos con MM son la anemia no regenerativa (55-68 %), la azotemia y la hiperglobulinemia. También se han descrito algunos casos con hipoalbuminemia, hipercalcemia e hipocolesterolemia1,2,6-8,11 (Tabla 4).
* Según el estudio de Platel y cols. (2005), en el 40 % de los gatos se detectó infiltración de órganos (con preferencia por bazo, hígado y ganglios linfáticos). Por otro lado, Mellor y cols. (2006) describen infiltración de órganos en el 50 % de los gatos con MM en el momento del diagnóstico.
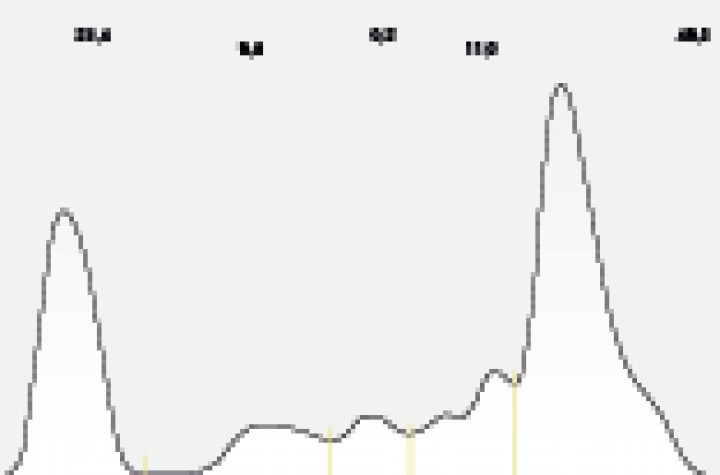
Una vez identificada la hiperglobulinemia, es necesario realizar una electroforesis sérica para demostrar que es monoclonal, con un pico en la región de las beta o de las gamma globulinas. Como ya se ha comentado, puede darse con menor frecuencia la presentación poli o biclonal (Figs. 1 y 2).
Figura 1
Proteinograma de un gato Común Europeo con hiperproteinemia mantenida (10 g/dl) en tratamiento por la presencia de linfoma hepatoesplénico con quimioterapia. Este gato resultó positivo a calicivirus por PCR.
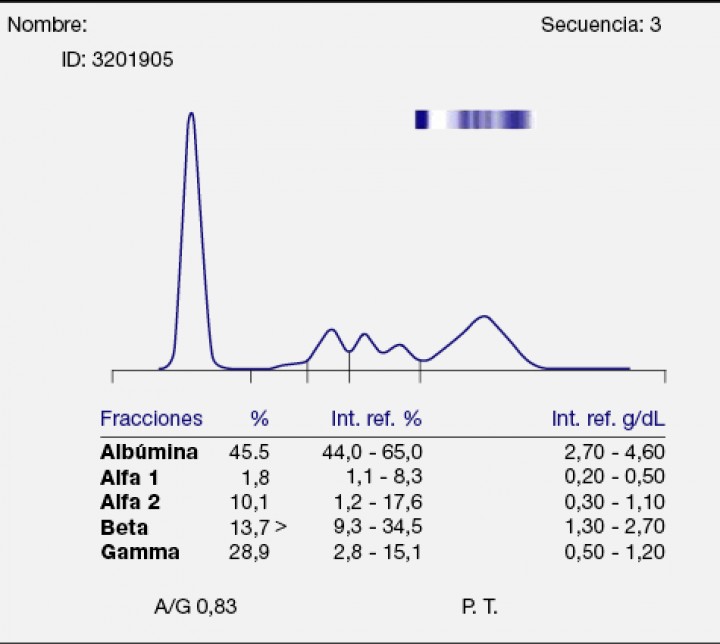
Figura 2
Proteinograma de la gata de la Tabla 3 que permite confirmar la sospecha de mieloma múltiple por la presencia de gammapatía monoclonal.
La realización de un urianálisis completo tiene como objetivo descartar la existencia de infecciones secundarias y confirmar la presencia de proteinuria, con un especial interés por la identificación de las proteínas de Bence Jones (cadena ligera).2
La ecografía abdominal con aspirado de los órganos con organomegalia y/o imagen compatible con infiltración neoplásica (hipoecogenicidad difusa o nodular en el bazo, patrón hiperecogénico difuso en el hígado) es recomendable para confirmar la infiltración del órgano por células plasmáticas tumorales (más del 50 % de los gatos)3 (Fig. 3). Las radiografías óseas pueden ayudar a detectar las lesiones líticas compatibles con infiltración neoplásica.
Figura 3
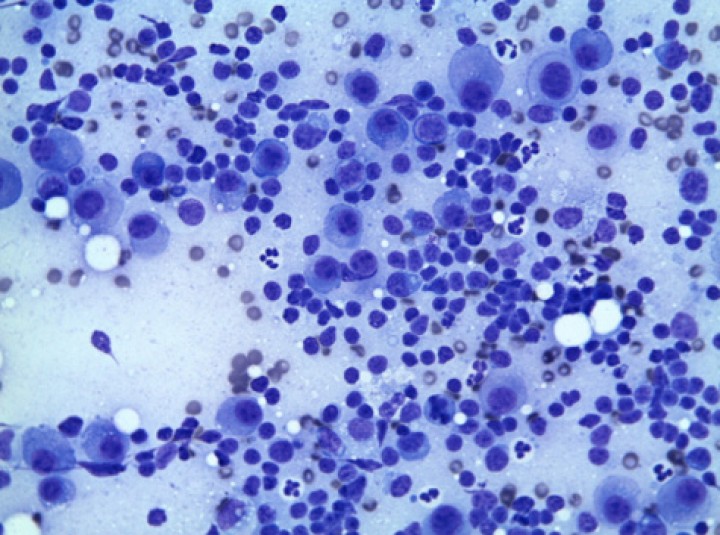
Citología de la médula ósea de la gata de la Figura 2 que confirma la presencia de mieloma múltiple. La citología muestra elevada densidad celular compuesta por células redondas de 30-50 micras de diámetro de morfología plasmocitoide. El citoplasma se muestra densamente basófilo con una imagen perinuclear clara (Golgi) y el núcleo, redondeado, muestra un patrón formando múltiples grumos heterocromáticos. El plemorfismo es severo y se observan numerosas mitosis (>1 por campo-40X). Diff-quick, 40X. Imagen cedida por David Sardón, HCV UAX.
Por lo tanto, la confirmación del diagnóstico de MM en el gato requiere del cumplimiento de, al menos, dos de los siguientes criterios (Tabla 4):
- Punción/biopsia de MO: recuento mayor al 10 % de células plasmáticas en el gato, destacando la presencia de atipias celulares.
- Hiperproteinemia: confirmada mediante proteinograma con hiperglobulinemia, normalmente por gammapatía monoclonal.
- Presencia de la proteína de Bence Jones en la orina (40 % de los gatos con MRD/MM).
- Infiltración orgánica de células tumorales.
- Radiografías óseas: identificación de lesiones líticas secundarias a la infiltración neoplásica.
Ya que en el gato el grado de infiltración de la MO puede no ser tan marcado como en otras especies, se ha sugerido que la alteración de la morfología de las células plasmáticas, así como la identificación de infiltración neoplásica en las vísceras, puede ser la clave del diagnóstico de una MRD, aún con una infiltración de la MO menor al 10 %.1,2,6,7
Mellor y cols. (2008) proponen una reclasificación de las MRD pues, entre otras cosas, en la actualidad no se sabe si la presentación extramedular es primaria o secundaria a la infiltración de la MO, ya que el 67 % de los gatos con MM bien diferenciado presentaron como primer signo la infiltración orgánica. Por otro lado, sugieren diferenciar estos desórdenes en función del grado, ya que la supervivencia media para los MRD de bajo grado o intermedio fue de 252 días, frente a los 14 días de supervivencia en aquellos gatos con MRD de alto grado (Tabla 5).
Tratamiento
El tratamiento del MM debe enfocarse no solo en el control de la neoplasia, sino también de la sintomatología asociada:3
- Fluidoterapia con cristaloides: para corregir la deshidratación, mejorar el estado cardiovascular, manejar la hipercalcemia y la azotemia, en caso de que estén presentes.
- Antibióticos: necesarios para el control de las posibles infecciones secundarias concurrentes, como, por ejemplo, infección de orina, o como profiláctico, en el caso de la presencia de citopenias.
- Analgesia: controlar el dolor debe ser un objetivo fundamental, ya que las alteraciones óseas asociadas al mieloma pueden ser especialmente dolorosas.
- Bifosfonatos: se emplean para el manejo de la hipercalcemia, del dolor óseo y del retraso de la resorción ósea. En perros la dosis recomendada de pamidronato es de 1-2 mg/kg i.v. y, en el gato, se ha descrito su uso de forma anecdótica a razón de 1 mg/kg i.v. cada 21-28 días. Ya que el pamidronato es potencialmente nefrotóxico, se debe evaluar estrechamente la funcionalidad renal previamente a su administración.
- Radioterapia paliativa: las células tumorales son muy sensibles a la radioterapia, lo que permite mejorar rápidamente la sintomatología asociada a la infiltración de los órganos afectados. Las indicaciones para su administración son la existencia de lesiones óseas dolorosas, la compresión de la MO, la presencia de fracturas patológicas (tras su estabilización) y la presencia de masas de gran tamaño en tejidos blandos.5
Quimioterapia
El tratamiento quimioterápico es efectivo en el control de las células neoplásicas, del dolor óseo y el control de la hiperproteinemia. La tasa de respuesta varía según la bibliografía (50-83 %), así como el tiempo de control de la enfermedad (4 meses en la bibliografía antigua, 8-13 meses en la bibliografía más reciente).1
Los quimioterápicos más empleados son:
1) Melfalán:
- Es el agente alquilante de elección para el manejo del MM en el perro, pero en el caso del gato, al ser más mielosupresor, suele preferirse el tratamiento con ciclofosfamida (ver más adelante).1
- 0,1 mg/kg por vía oral, una vez al día durante 10-14 días, seguida de la misma dosis en días alternos hasta el control de los signos clínicos o el desarrollo de leucopenia.1 El melfalán se combina con prednisolona a razón de 0,5 mg/kg/día11 o a 1,2–2 mg/kg/día. Se recomienda una dosis de mantenimiento semanal con melfalán de 0,1 mg/kg.1,8,11
- Otro protocolo descrito en el manejo del MM felino es la administración de melfalán a razón de 2 mg/m2 cada 24 horas durante 4 días seguidos de forma mantenida.1,8
- Los gatos son más sensibles a la mielosupresión que los perros. En caso de neutropenia marcada, se recomienda retirar el tratamiento hasta obtener recuentos celulares normales. Puede desarrollarse trombocitopenia.1
2) Clorambucilo: agente alquilante empleado en el manejo de MRD en el gato (2 mg/gato/2-5 días).8,15
3) Ciclofosfamida: se han descrito varios protocolos:1,8
- 250 mg/m2 por vía oral o i.v. cada 3 semanas junto con prednisolona (1 mg/kg diario durante 2 semanas y después en días alternos).
- 25 mg/gato 2 veces por semana.
4) Se ha descrito un número limitado de casos tratados con lomustina (CCNU) (50 mg/m2 por vía oral cada 21 días), con una respuesta parcial al tratamiento.8
Respuesta al tratamiento
La respuesta al tratamiento1,8 se basa en la mejoría de los signos clínicos, los parámetros clínico-patológicos y las lesiones radiológicas (en caso de que existan) e infiltración orgánica.
Normalmente, la mejoría clínica se evidencia a las 2-4 semanas de tratamiento, y la mejoría de la hiperproteinemia y las lesiones óseas radiológicas a las 8 semanas.
Se define como remisión total la ausencia de hiperglobulinemia (normalmente requiere al menos 8 semanas de tratamiento) y como remisión parcial la disminución de la hiperproteinemia al 50 %.3
Otras terapias
Se ha descrito el uso de plasmaféresis y otro tipo de transfusiones como tratamiento del síndrome de hiperviscosidad en medicina humana, pero su uso en medicina veterinaria es anecdótico.14
En la actualidad se están investigando en medicina humana otras terapias, como células madre, talidomida o bortezomid, entre otros.1,3
Monitorización del tratamiento
Deben realizarse hemogramas, bioquímicas y urianálisis (con UPC) de control.
Pronóstico
El 50-83 % de los gatos presentan una mejoría transitoria tras el tratamiento con melfalán y prednisolona o protocolos con ciclofosfamida, pero esta respuesta normalmente es parcial y poco duradera (4 meses), aunque publicaciones recientes sugieren un control de la enfermedad durante más tiempo (8-13 meses), como ya se ha comentado con anterioridad.1 Las supervivencias mayores al año se han descrito de forma ocasional.
La Tabla 5 muestra los dos tipos de presentaciones sugeridos:11
- El pronóstico en la presentación agresiva (existencia de fracturas patológicas, anemia, proteinuria de cadena ligera, azotemia, pobre respuesta al tratamiento) es muy pobre, con una supervivencia media de 5-14 días tras el tratamiento con melfalán y prednisona.3
- En la presentación menos agresiva, la supervivencia con protocolos similares es de hasta 387 días,11 aunque otros autores describen supervivencias de 3 a 13 meses.1,3
Por otro lado, en los gatos con MM se ha demostrado una correlación entre la diferenciación histológica de las células tumorales y la supervivencia; así, gatos con tumores bien diferenciados (<15 % células inmaduras) tienen una supervivencia media de 254 días, mientras que gatos con tumores poco diferenciados (≥50 % de células inmaduras) solo alcanzan los 14 días de media de supervivencia.6
En lo referente a la respuesta al tratamiento, los gatos con respuesta completa tras el tratamiento quimioterápico obtienen supervivencias medias de 870 días, mientras que los gatos con respuesta parcial al tratamiento alcanzan los 289 días de supervivencia.8
La mayor supervivencia descrita en un gato tratado únicamente con quimioterapia fue de 16 meses, aunque normalmente los animales son eutanasiados en los primeros 6 meses desde el diagnóstico.5
Conclusión
El mieloma múltiple (MM) es una neoplasia muy rara en gatos (<1 % de todas las neoplasias malignas y menos del 2 % de los tumores hematopoyéticos), con un curso progresivo y sintomatología clínica inespecífica. La presencia de hiperglobulinemia marcada (sin existencia de enfermedad infecciosa asociada) junto con proteinuria (en algunos casos) y, normalmente, organomegalia (especialmente esplenomegalia) en el gato debe orientar al clínico hacia la presencia de una enfermedad sistémica, entre las que se encuentra el MM. El tratamiento se basa en el manejo de los síntomas clínicos, la prevención de las complicaciones y el control de las células neoplásicas mediante la administración de quimioterapia basada en agentes alquilantes. El pronóstico, a diferencia del perro, es reservado.
Fuente de financiación: las autoras no han recibido ningún tipo de financiación para la autoría y/o publicación de este artículo.
Conflicto de intereses: las autoras declaran que no tienen potenciales conflictos de intereses en lo que respecta a este artículo, autoría y/o publicación de este artículo.
Bibliografía
- 1.
Vail DM: Myeloma-related disorders. En Elsevier/Saunders (ed): Withrow & MacEwen’s small animal clinical oncology, 6th ed. St. Louis, Mo., 2019; 740-752.
- 2.
Patel, R., Caceres, A., French, A. and McManus, P: Multiple myeloma in 16 cats: a retrospective study. Vet Clin Pathol. 2005, 34(4):341-352.
[PubMed] - 3.
Sternberg, R., Wypij, J., and Barger, A. M. An overview of multiple myeloma in dogs and cats. Veterinary medicine. 2009. 104(10), 468-476.
- 4.
Appel, S. L., Moens, N. M., Abrams-Ogg, A. C., et al.: Multiple myeloma with central nervous system involvement in a cat. J Am Vet Med Assoc J 2008; 233(5):743-747.
[PubMed] - 5.
Bienzle, D., Silverstein, D. C., and Chaffin, K: Multiple myeloma in cats: variable presentation with different immunoglobulin isotypes in two cats. Vet Pathol. 2000; 37(4):364-369.
[pubMed] - 6.
Mellor, P. J., Haugland, S., Smith, K. C., et al: Histopathologic, immunohistochemical, and cytologic analysis of feline myeloma-related disorders: further evidence for primary extramedullary development in the cat. Vet Pathol. 2008; 45(2):159-173.
[PubMed] - 7.
Mellor, P. J., Haugland, S., Murphy, S. et al: Myeloma-related disorders in cats commonly present as extramedullary neoplasms in contrast to myeloma in human patients: 24 cases with clinical follow-up. J Vet Intern Med 2006; 20(6):1376-1383.
[pubMed] - 8.
Cannon, C., Knudson, C. and Borgatti, A: Clinical Signs, Treatment, and Outcome in Cats with Myeloma-Related Disorder Receiving Systemic Therapy. J Am Anim Hosp Assoc. 2015; 51(4):239-248.
[PubMed] - 9.
Mitcham, S. A., McGillivray, S. R., and Haines, D. M: Plasma cell sarcoma in a cat. Can Vet J. 1985; 26(3):98.
[pubMed] - 10.
McDonald, W. J., Burton, S. A., and Fuentealba, I. C: Plasma cell myeloma producing an immunoglobulin A paraprotein in a cat. Can Vet J. 1994; 35(3):157.
[PubMed] - 11.
Hanna, F: Multiple myeloma in cats. J Feline Med Surg. 2005; 7(5):275-287.
[pubMed] - 12.
Qurollo, B. A., Balakrishnan, N., Cannon, C. Z., Maggi, R. G., and Breitschwerdt, E. B: Co-infection with Anaplasma platys, Bartonella henselae, Bartonella koehlerae and ‘Candidatus Mycoplasma haemominutum’ in a cat diagnosed with splenic plasmacytosis and multiple mieloma. J Feline Med Surg. 2014; 16(8):713-720.
[PubMed] - 13.
Weber, N. A. and Tebeau, C. S: An unusual presentation of multiple myeloma in two cats. J Am Anim Hosp Assoc. 1998; 34(6):477-483.
[pubMed] - 14.
Boyle, T., Holowaychuk, M., Adams, A. and Marks, S: Treatment of Three Cats with Hyperviscosity Syndrome and Congestive Heart Failure Using Plasmapheresis. J Am Anim Hosp Assoc. 2011; 47(1):50-55.
[PubMed] - 15.
Bagwell, J., Herd, H., Breshears, M., Hodges, S. and Rizzi, T: Concurrent multiple myeloma and mast cell neoplasia in a 13-year-old castrated male Maine Coon cat. Vet Clin Pathol 2017; 46(1):151-157.
[pubMed] - 16.
Dunbar, M. D., and Lyles, S: Hemophagocytic syndrome in a cat with multiple myeloma. Vet Clin Pathol. 2013; 42(1):55-60.
[PubMed] - 17.
Radhakrishnan, A., Risbon, R. E., Patel, R. T., Ruiz, B., and Clifford, C. A: Progression of a solitary, malignant cutaneous plasma-cell tumour to multiple myeloma in a cat. Vet Comp Oncol. 2004; 2(1):36-42.
[pubMed]