Enfermedades infecciosas y parasitarias en anfibios en cautividad: estudio retrospectivo de 131 pacientes
Infectious and parasitic diseases in captive amphibians: a retrospective study of 131 patients
C. Juan-Sallés, V. Almagro, L. Carbonell, X. Valls, A. Montesinos, H. Fernández-Bellon
Contacto: noahspath.cjuansalles@gmail.com
Resumen
Este estudio retrospectivo evalúa las principales enfermedades infecciosas y parasitarias en 131 anfibios remitidos para estudio histopatológico (127 casos post mortem y 5 biopsias) procedentes de zoos (106/131; 80,9%) o colecciones privadas (25/131; 19,1%). Las especies más representadas son el sapito balear (Alytes muletensis) (38/131; 29%) y, en conjunto, los dendrobátidos (48/131; 36,6%). Las infecciones eran principalmente bacterianas, particularmente la micobacteriosis (19/131; 14,5%), y fúngicas. Entre estas últimas se contabilizaron únicamente 6 casos de quitridiomicosis (6/131; 4,6%) y 3 por hongos pigmentados (3/131; 2,3%), incluidos 2 de feohifomicosis y 1 de cromomicosis. No se observaron evidencias de infecciones víricas, salvo una dermatitis epizoótica en escuerzos de Cranwell (Ceratophrys cranwelli); sin embargo, no se realizaron técnicas de detección de genoma o antígeno vírico en ningún anfibio. De entre las enfermedades parasitarias destaca la estrongiloidiasis (19/131; 14,5%), que afectó principalmente a sapitos baleares, en los cuales se asoció frecuentemente a proctitis, prolapso rectal/proctocloacal e intususcepciones intestinales.
Palabras clave: Alytes muletensis, dendrobátidos, dermatitis, estrongiloidiasis, feohifomicosis, hepatitis, micobacteriosis, microsporidiosis, nematodiasis, prolapso rectal, quitridiomicosis, Rhabdias, sapito balear.
Clin Vet Peq Anim 2020, 40 (1): 15-27
Summary
This is a retrospective study of the main infectious and parasitic diseases in 131 amphibians submitted for histopathology (127 postmortem cases and 5 biopsies) originated from zoos (106/131; 80.9%) or private collections (25/131; 19.1%). The most represented species are the Mallorcan midwife’s toad (Alytes muletensis) and, as a group, the dendrobatids (48/131; 36.6%). Infections were mainly bacterial, particularly mycobacteriosis (19/131; 14.5%), and fungal, with only 6 cases of chytridiomycosis (6/131; 4.6%) and 3 of pigmented fungi (2.3%), including 2 of phaehyphomycosis and 1 of chromomycosis. No evidence of viral infections was noted, except for a single case of epizootic dermatitis in a Cranwell’s horned frog (Ceratophrys cranwelli); nevertheless, genome or antigen detection techniques were not performed in any amphibian. Among parasitic diseases, strongyloidiasis was the most frequent (19/131; 14.5%) and mainly affected Mallorcan midwife’s toads, in which it was associated with proctitis, rectal/proctocloacal prolapse and intestinal intussusception.
Keywords: Alytes muletensis, dendrobatid frogs, dermatitis, strongyloidiasis, phaehyphomycosis, hepatitis, mycobacteriosis, microsporidiosis, nematodiasis, rectal prolapse, chytridiomycosis, Rhabdias, Mallorcan midwife’s toad.
Clin Vet Peq Anim 2020, 40 (1): 15-27

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
La popularidad creciente de los anfibios y el declive de numerosas especies1 se ha acompañado de la creación de programas de cría en cautividad, conservación in situ y reintroducción para algunas especies, así como de un incremento en la bibliografía médica de este grupo taxonómico. Sin embargo, las enfermedades en anfibios en cautividad y vida libre no están, en general, ampliamente documentadas, con excepción de la quitridiomicosis, la micobacteriosis, las infecciones por ranavirus y las enfermedades parasitarias notorias por su repercusión en poblaciones salvajes, como la trematodiasis causada por Ribeiroia.2,3 Incluso especies populares como los dendrobátidos, mantenidas con frecuencia en cautividad, se encuentran en esta situación.
Este estudio retrospectivo evalúa las principales enfermedades infecciosas y parasitarias observadas en 131 anfibios remitidos para diagnóstico histopatológico. Se incluyen en este estudio 38 sapitos baleares (Alytes muletensis), los cuales aportan una información valiosa en cuanto a las enfermedades más relevantes detectadas en dos colonias de cría en cautividad de dicha especie. El sapito balear, especie endémica de la isla de Mallorca, está sujeto a un programa de conservación in situ y de cría en cautividad desarrollado por diversas instituciones, incluidas administraciones públicas y zoológicos.4 Sin embargo, existen escasas descripciones de las enfermedades que afectan a esta especie.
Materiales y métodos
Se revisaron los archivos médicos y de patología de anfibios de las instituciones y centros privados colaboradores en este estudio para recabar casos documentados de enfermedad y muerte en anfibios desde el 2005 hasta el 2018. De este estudio se eliminaron los anfibios autolíticos sin evidencias consistentes de enfermedades relevantes para su inclusión en el mismo. Posteriormente, se filtraron los archivos para incluir casos de enfermedades infecciosas y parasitarias.
Se revisaron los historiales clínicos, las radiografías, las fotografías macroscópicas y los informes de patología. Los tejidos de biopsia y necropsia habían sido procesados para su evaluación histopatológica (fijados en formol al 10 %, incluidos en parafina y teñidos con hematoxilina y eosina) para diagnóstico rutinario previamente a la realización de este estudio y fueron evaluados por un único patólogo.
En este estudio se incluyen 131 anfibios en un total de 132 remisiones (de uno de ellos se había evaluado una biopsia de branquias previamente a su muerte) que cumplían los criterios de selección de casos. Estas 132 remisiones corresponden a biopsias (5 casos) y tejidos de necropsia (127 casos) de 28 especies diferentes. De los 127 anfibios muertos incluidos, 113 fueron remitidos enteros y procesados en cortes transversales seriados de todo su cuerpo. Se realizaron tinciones especiales, particularmente la tinción de Ziehl-Neelsen, también para diagnóstico rutinario.
La Tabla 1 detalla la distribución por especies. De estos 131 anfibios, 117 pertenecían al orden Anura y 14 al orden Caudata. Tres especies sumaban 69 de los 131 anfibios (52,6 %): el sapito balear (Alytes muletensis; 38/131 procedentes de dos zoos), la rana flecha azul (Dendrobates azureus; 20/131) y la rana flecha amarilla y azul (Dendrobates tinctorius; 11/131). Un total de 48 anfibios pertenecían a la familia Dendrobatidae (36,6 %). Todos ellos eran mantenidos en cautividad. De los 131 anfibios, 106 procedían de zoos, acuarios y centros afines, mientras que los 25 restantes fueron remitidos por clínicas de animales exóticos.
Resultados
Los procesos más frecuentes en esta casuística incluían las enfermedades infecciosas y parasitarias, seguidos a distancia por la enfermedad ósea metabólica y la mineralización de tejidos blandos. En esta primera parte del estudio se revisaron las enfermedades infecciosas y parasitarias, así como las lesiones inflamatorias asociadas a las mismas. La Tabla 2 describe las enfermedades infecciosas y parasitarias diagnosticadas en estos 131 anfibios.
a Están incluidos los anfibios con dermatitis causada por micobacterias.
b En algunos de los anfibios incluidos no se pudo descartar que estas micosis correspondieran a colonización fúngica posterior a la muerte.
Nota: algunos pacientes estaban afectados por dos o más de estos procesos.
En cuanto a las infecciones bacterianas, se diagnosticaron 48 casos en los 131 anfibios (36,6 %), aunque en numerosos pacientes, particularmente animales con lesiones cutáneas, no eran necesariamente primarias ni la causa (o única causa) de la muerte.
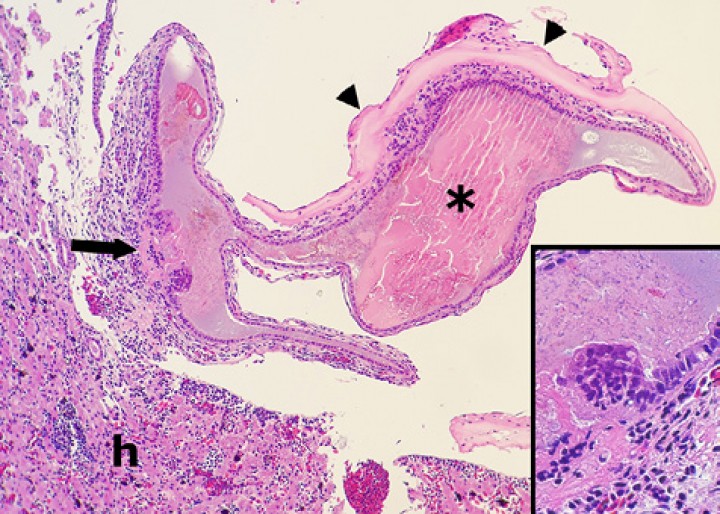
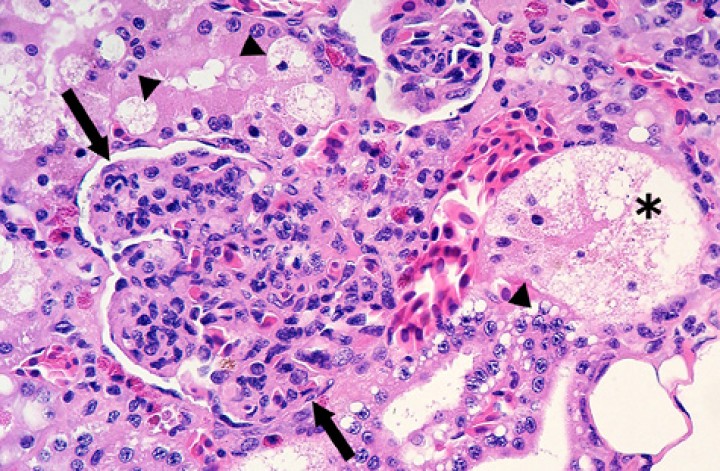
La infección bacteriana más frecuente fue la micobacteriosis con 19 casos en los 131 anfibios (14,5 %), 15 de ellos en dendrobátidos procedentes de dos zoos. El diagnóstico se basó en la presencia de lesiones granulomatosas o histiocíticas con bacilos ácido-alcohol resistentes intralesionales mediante la tinción de Ziehl-Neelsen (Figs. 1 y 2), que en la mayoría de casos no eran abundantes y se caracterizaban por ser alargados (Fig. 2A y 2D). No se dispone de estudios de PCR/cultivo de micobacterias en ninguno de estos anfibios. Esta infección afectó a 2 o más órganos en 18 de los 19 anfibios (94,7 %). Los órganos más frecuentemente afectados fueron hígado, riñón, pulmón, bazo, tejido subcutáneo, hueso/médula ósea, piel, serosa celómica e intestino. En algunos casos, las lesiones eran visibles macroscópicamente como nódulos blanquecinos de hasta 2-3 mm de diámetro, particularmente en hígado (Fig. 1A), serosa celómica visceral y riñón. En el seno linfático subcutáneo, las lesiones se caracterizaban habitualmente por un componente fibrinoso/trombótico prominente (endolinfangitis trombótica), lesión que ocluía parcialmente la luz de dicho vaso linfático (Fig. 2B).
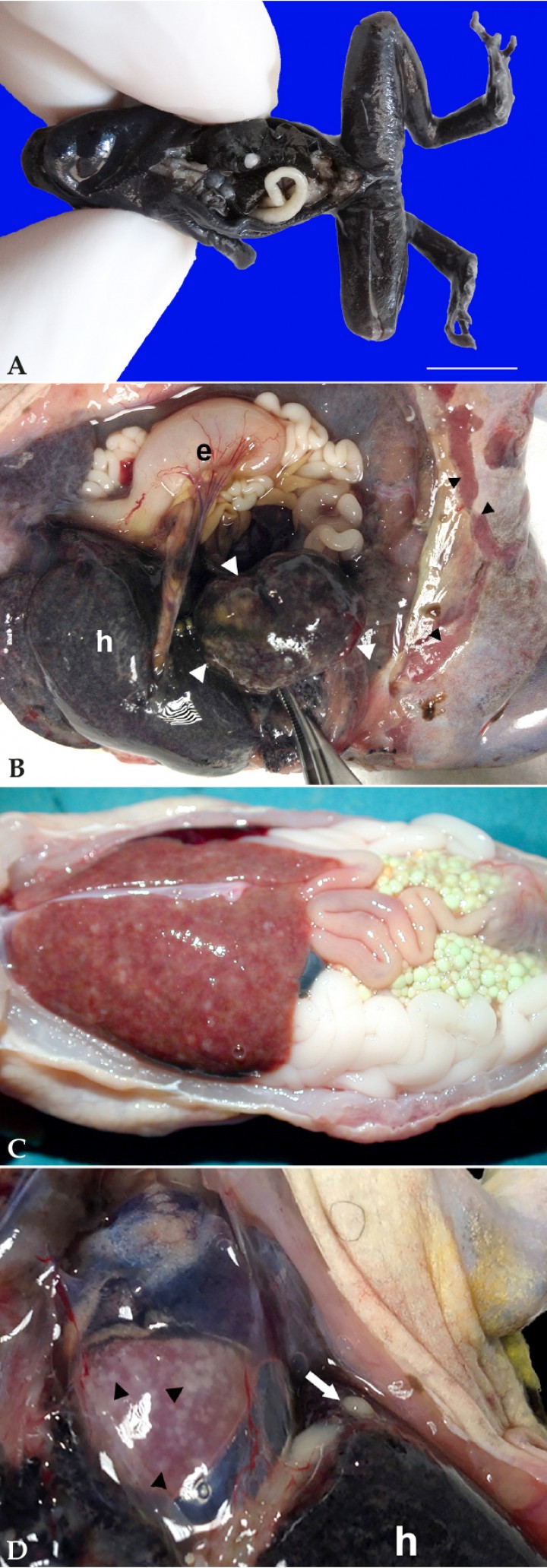
Figura 1
(A) Rana flecha azul (Dendrobates azureus). Sobre la superficie del hígado se aprecia un nódulo (granuloma micobacteriano) blanquecino. Barra: 1 cm. (B) Cavidad celómica; rana toro (Lithobates catesbeianus). El bazo está marcadamente aumentado de tamaño (cabezas de flecha blancas) y contiene focos blanquecinos. La piel en la región inguinal muestra focos alargados de ulceración (cabezas de flecha negras); e: estómago, h: hígado. (C) Cavidad celómica; axolote (Ambystoma mexicanum). El hígado contiene numerosos focos blanquecinos. (D) Cavidad celómica; rana toro (Lithobates catesbeianus). El epicardio muestra numerosos focos blanquecinos (cabezas de flecha) correspondientes a pericarditis por micobacteriosis, y en la serosa celómica visceral se distingue un nódulo blanquecino (flecha blanca) correspondiente a cestodos enquistados; h: hígado.
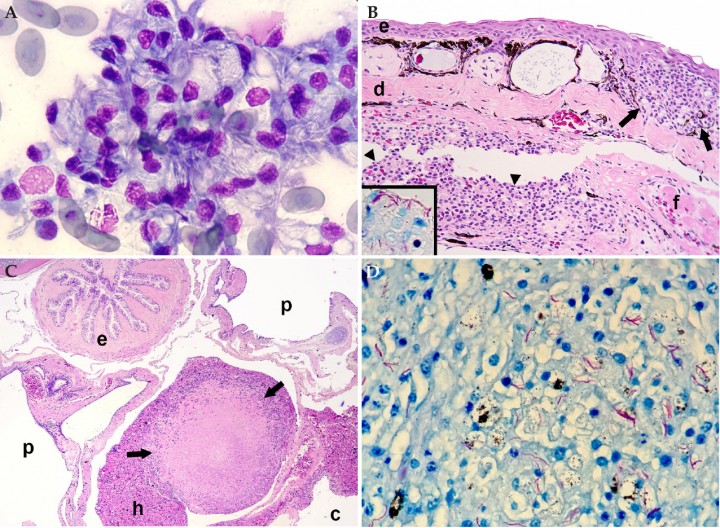
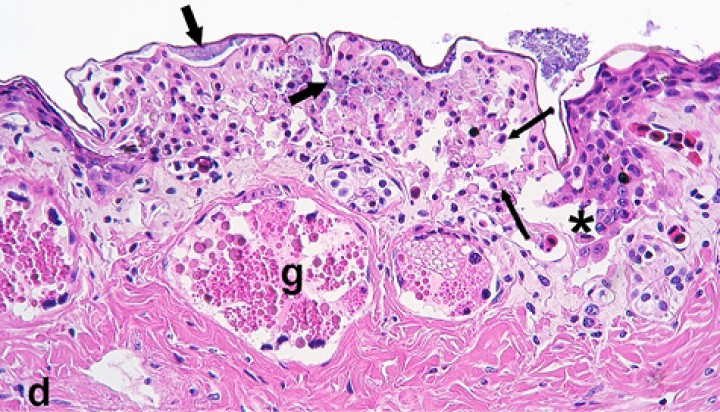
Figura 2
(A) Bazo; rana toro (Lithobates catesbeianus). Se aprecian macrófagos con numerosos bacilos fantasma en su citoplasma. Diff-Quick, x1000. (B) Piel, seno linfático subcutáneo; rana flecha azul (Dendrobates azureus). La dermis (d) contiene un granuloma (flechas). El seno linfático subcutáneo está dilatado y parcialmente obstruido por un trombo de fibrina (f) e inflamación granulomatosa (cabezas de flecha) (endolinfangitis granulomatosa y trombótica); e: epidermis. Hematoxilina-eosina, x200. Recuadro: bacilos ácido-alcohol intralesionales en granuloma endolinfático. Tinción de Ziehl-Neelsen, x400. (C) Cavidad celómica; sapito balear (Alytes muletensis). Se observa un granuloma con gran centro necrótico (flechas) en el hígado (h); c: cavidad celómica, p: pulmón, e: esófago. Hematoxilina-eosina, x48. (D) Bazo; rana toro (Lithobates catesbeianus). Se aprecian numerosos bacilos ácido-alcohol resistentes alargados en una zona de esplenitis granulomatosa. Ziehl-Neelsen, x480.
Se observaron 11 casos de celomitis bacteriana, en los que se contabilizaron 5 anfibios con micobacteriosis y 5 con celomitis supurativas y/o fibrinosas caracterizadas por acumulación de exudado abundante en la cavidad celómica (Fig. 3) como principal proceso de enfermedad o asociadas a otras lesiones inflamatorias, particularmente nefritis. El caso restante consistía en una bacteriemia intensa con celomitis leve y acumulación de líquido proteico en la cavidad celómica de una rana junco arborícola africana (Hyperolius concolor). No se dispone de aislamiento bacteriano de estos casos.
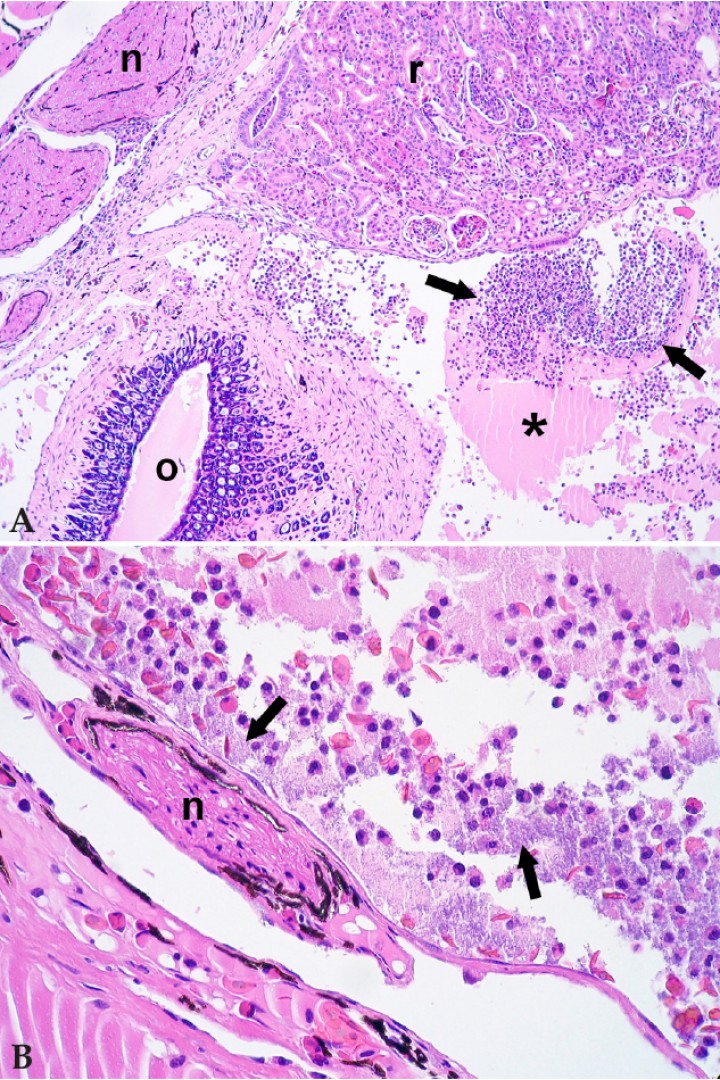
Figura 3
(A) Cavidad celómica; rana dardo verdinegra (Dendrobates auratus). La cavidad celómica contiene exudado con material proteico (asterisco) y células inflamatorias (flechas); n: nervio, r: riñón, o: oviducto. Hematoxilina-eosina, x100. (B) Cavidad celómica; rana dardo verdinegra (Dendrobates auratus). Detalle del exudado de la cavidad celómica, con granulocitos, eritrocitos, material proteináceo y bacterias (flechas); n: nervio. Hematoxilina-eosina, x400.
De un brote de mortalidad de salamandras mandarinas (Tylototriton shanjing) de 5 meses de edad procedentes de una misma puesta, se aisló Pseudomonas de una de las salamandras; histológicamente se observó bacteriemia aguda con edema subcutáneo, celulitis necrotizante y necrosis renal tubular focal aguda sin evidencias de procesos de enfermedad subyacentes a la bacteriemia.
Numerosas lesiones cutáneas de etiología diversa, sin incluir los casos de dermatitis por micobacterias, tenían un componente bacteriano.
Del resto de infecciones bacterianas, es interesante un caso de enteritis fibrinohemorrágica y enfisematosa con gastritis también enfisematosa en una rana toro africana (Pyxicephalus adspersus); intralesionalmente se observaron numerosos bacilos con tinción polar o bipolar compatibles con Clostridium. Destaca también un sapito balear con colecistitis ulcerativa-fibrinosa y bacilos en la bilis (Fig. 4) y otro con colelitiasis grave de la vesícula biliar y obstrucción de vías biliares complicada con colangiohepatitis bacteriana y embolismo de secreciones biliares con bacterias en el seno linfático subcutáneo. Finalmente, un axolote (Ambystoma mexicanum) con signos nerviosos mostraba una meningitis supurativa y piogranulomatosa con coroiditis, así como una otitis hemorrágica; a pesar de observarse aparentes cocos con la tinción rutinaria, las tinciones de Gram y Ziehl-Neelsen no revelaron patógenos intralesionales.
Figura 4
Vesícula biliar; sapito balear (Alytes muletensis). Se observa colecistitis caracterizada por una zona de necrosis, erosión y depósito de fibrina en la mucosa (flecha) con depósito de exudado proteináceo sobre la serosa visceral (cabezas de flecha). La bilis contiene un tapón de material biliar (asterisco). Hematoxilina-eosina, x120. Recuadro: la bilis adyacente al foco de necrosis-erosión contiene numerosas bacterias. Hematoxilina-eosina, x480. h: hígado.
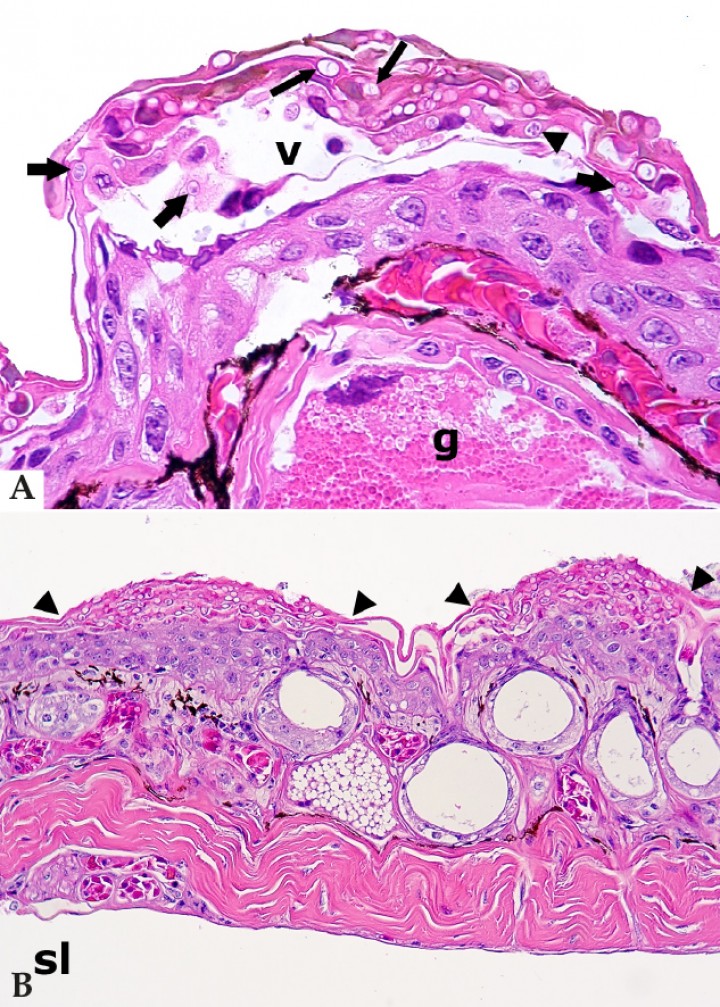
Se observaron 24 casos de micosis (18,3 %), si bien en anfibios autolíticos con escasa respuesta tisular asociada resultaba difícil descartar la colonización fúngica posterior a la muerte. En cuanto a las infecciones fúngicas superficiales, se observó quitridiomicosis únicamente en 6 de 131 anfibios (4,6 %), 5 de ellos procedentes de dos colonias. Estos incluían una salamandra mandarina (Tylototriton shanjing) con dermatitis vesicular caracterizada por la formación de vesículas epidérmicas y acantolisis con hongos quítridos (Fig. 5A) y bacterias intralesionales; 3 dendrobátidos con hiperplasia epidérmica y/o hiperqueratosis de grado bajo o moderado; 1 sapito balear con degeneración vacuolar de queratinocitos, hiperqueratosis y dermatitis leve; y 1 rana tomate (Dyscophus guineti) con inflamación dérmica y glandular, necrosis de queratinocitos y células glandulares, hiperplasia epidérmica, hiperqueratosis y una infección intensa por hongos quítridos acompañados por un componente bacteriano superficial (Fig. 5B).
Figura 5
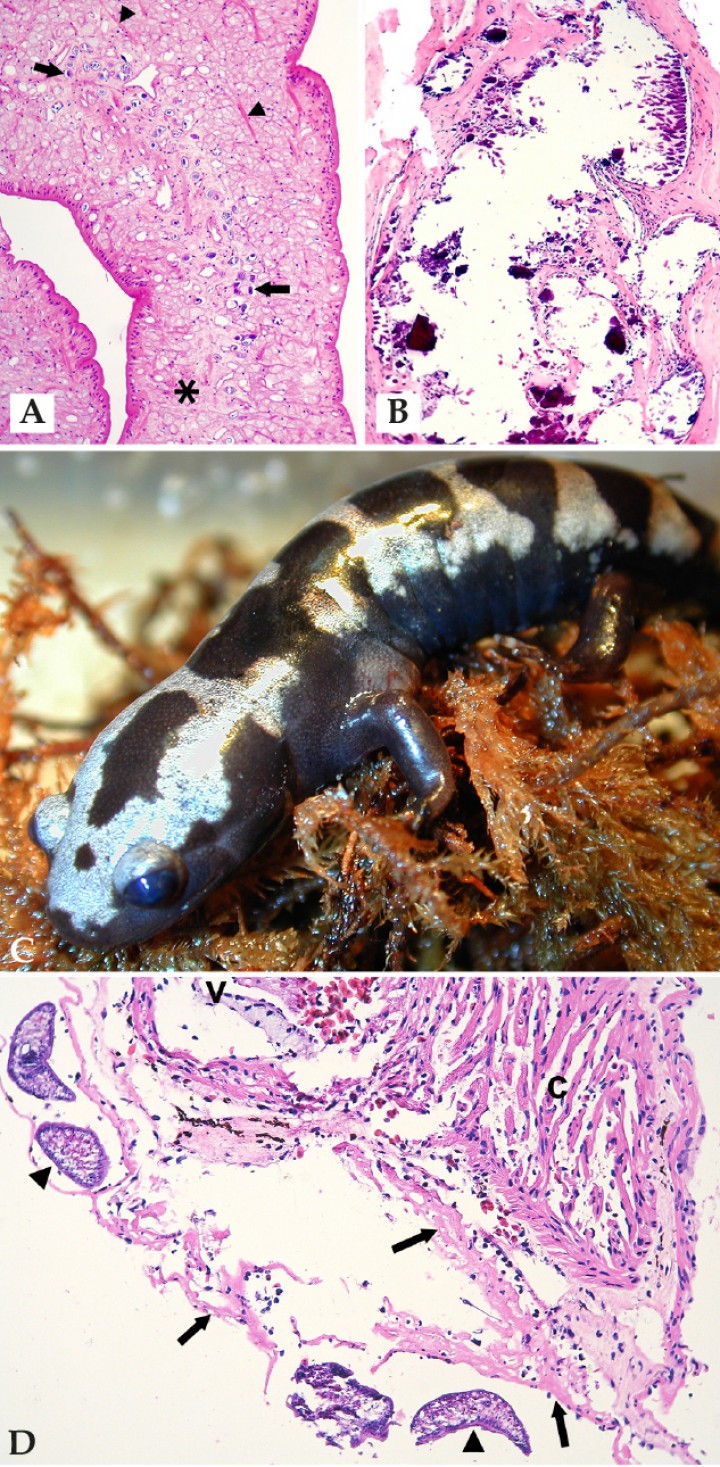
(A) Piel; salamandra mandarina (Tylototriton shanjing). Vesícula subcorneal (v) con queratinocitos acantolíticos en una epidermis levemente hiperplásica, en la que se observan numerosos hongos quítridos intralesionales, principalmente talos vacíos que en ocasiones muestran septos internos (“talos coloniales”) (flechas largas), pero también un zooesporangio con esporas basófilas distintivas (cabeza de flecha) y talos uninucleados (flechas gruesas); g: glándula granular de la dermis. Hematoxilina-eosina, x400. (B) Piel; rana tomate (Dyscophus guineti). La epidermis muestra hiperplasia con focos de hiperqueratosis y colonización de la queratina por numerosos hongos quítridos (focos delimitados con cabezas de flechas); sl: seno linfático subcutáneo. Hematoxilina-eosina, x240.
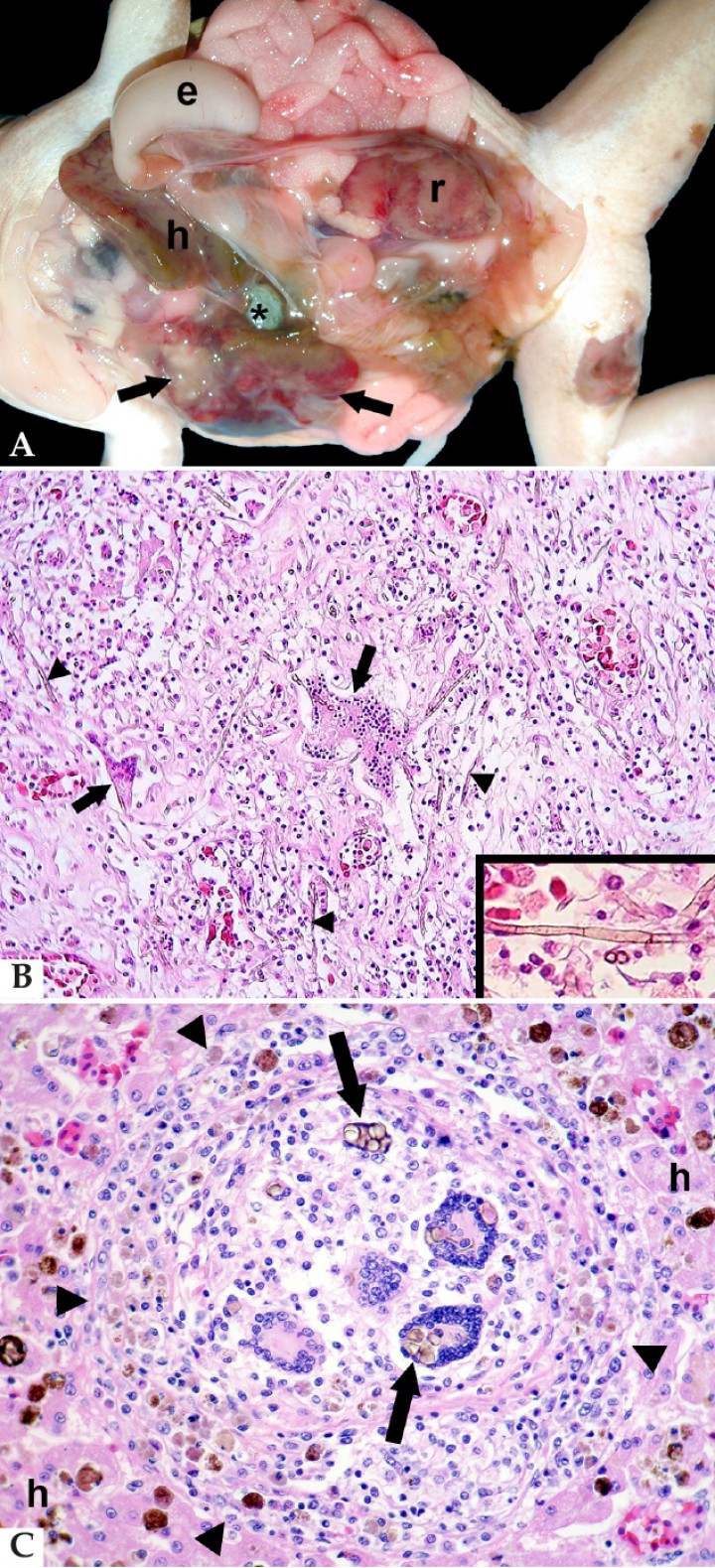
Tres anfibios mostraron infecciones fúngicas profundas (2,3 %), todas ellas causadas por hongos pigmentados (2 de feohifomicosis y 1 de cromomicosis). La feohifomicosis fue diagnosticada como infección sistémica en 2 ranas arborícolas de White (Litoria caerulea) con afectación de hígado, riñón, tejido subcutáneo, pulmón y corazón (Fig. 6A). Las lesiones eran necrotizantes, supurativas o granulomatosas y contenían hifas fúngicas de color marrón, no ramificadas, septadas, de bordes paralelos y hasta unas 2 micras de diámetro (Fig. 6B); estas lesiones se acompañaban de tromboembolismo fúngico y vasculitis fúngica. La feohifomicosis fue la causa de la muerte o principal contribuyente a la misma en estas ranas. En cuanto al caso de cromomicosis, se trataba de un sapo buey (Rhinella schneideri) con un foco portal de hepatitis granulomatosa incidental en cuyo interior se distinguieron cuerpos esféricos septados y de color marrón (cuerpos escleróticos), característicos de dicha enfermedad (Fig. 6C).
Figura 6
(A) Cavidad celómica; rana arborícola de White (Litoria coeruleoalba). Se observan zonas blanquecinas y rojizas en el lóbulo derecho del hígado (flechas) y riñón izquierdo (r), el cual está incrementado de tamaño; e: estómago, h: lóbulo izquierdo del hígado, *: vesícula biliar. (B) Corazón; rana arborícola de White (Litoria coeruleoalba). El miocardio está completamente remplazado por inflamación granulomatosa con células gigantes multinucleadas (flechas) y fibrosis; dispersas en esta lesión se distinguen numerosas hifas fúngicas no ramificadas (cabezas de flecha). Hematoxilina-eosina, x240. Recuadro: A mayor aumento, se puede constatar que las hifas están septadas y son de color marrón. Hematoxilina-eosina, x100. (C) Hígado; sapo buey (Rhinella schneideri). Granuloma hepático (cabezas de flecha) con células gigantes multinucleadas que contienen cuerpos escleróticos de hongos de color marrón fagocitados en su citoplasma (flechas); h: hepatocitos perilesionales. Hematoxilina-eosina, x400.
Esta serie de anfibios incluye un caso de microsporidiosis en un escuerzo de Cranwell (Ceratophrys cranwelli) con un incremento marcado del tamaño de ambos riñones debido a nefritis túbulo-intersticial difusa grave, con numerosas colonias intratubulares de microorganismos ovalados de aproximadamente 2,5-3,5 x 2-3 μm que presentaron una tinción Gram y PAS positiva. Se realizó una PCR para Encephalitozoon, Enterocytozoon, Vairimorpha y Nosema mediante métodos previamente descritos5 sobre riñón parafinado, la cual resultó negativa.
En cuanto a enfermedades protozoarias, solo se diagnosticaron infecciones digestivas por flagelados en 6 anfibios (5/6 intestinales), ocasionalmente asociadas a enteritis. Un caso correspondió a una infección cloacal luminal e invasiva de la mucosa, pero sin reacción tisular. Adicionalmente, 6 anfibios mostraban colonización intestinal (5) o gástrica (1) por protozoos ciliados, también sin lesiones asociadas.
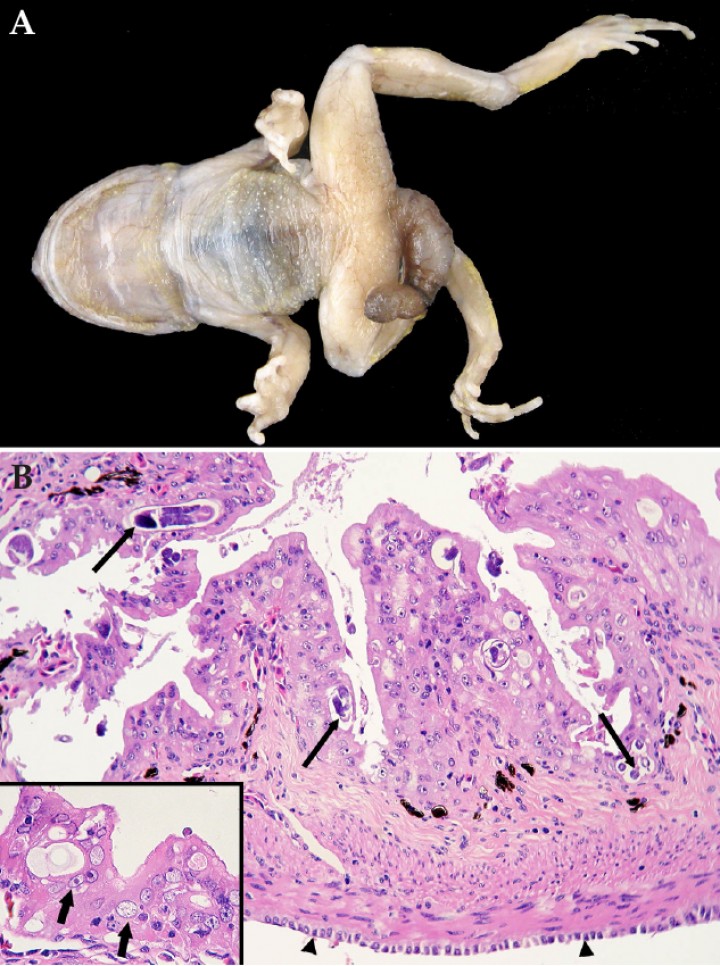
Las enfermedades parasitarias de mayor frecuencia eran, en conjunto, diversas nematodiasis: 43 de 131 anfibios (32,8 %) mostraban nematodos en una o más localizaciones, particularmente el intestino y el tracto respiratorio. En 34 anfibios se observó nematodiasis intestinal. Teniendo en cuenta la morfología, el tamaño, y la capacidad del parásito de invasión del epitelio intestinal, 19 de los 34 casos correspondían a estrongiloidiasis entérica, de los que 14 afectaban a sapitos baleares (Alytes muletensis) y 5 a ranas flecha azul (Dendrobates azureus). Doce de los 14 sapitos baleares procedían de una misma colonia y los restantes 2 del mismo centro que había presentado 5 casos en ranas flecha azul. Cinco sapitos baleares afectados mostraban prolapso cloacal/proctocloacal y uno de estos, además, intususcepción (Fig. 7A). Esta enfermedad parasitaria estaba asociada a grados variables de enteritis, que en 3 sapitos baleares mostraba un componente proliferativo (Fig. 7B). En ocho de los sapitos baleares con estrongiloidiasis se apreció inflamación en la piel y/u órganos internos, particularmente el hígado (excluidos los casos de micobacteriosis concurrente); en ningún caso se pudo constatar la presencia de larvas rabditiformes migrantes intralesionales de Strongyloides con la tinción rutinaria en los planos de corte evaluados.
Figura 7
(A) Sapito balear fijado en formol (Alytes muletensis). Se aprecia un prolapso proctocloacal grave. (B) Recto; sapito balear (Alytes muletensis). Se observa hiperplasia del epitelio de la mucosa, con presencia de numerosos nematodos en su interior (flechas largas). El mesotelio (cabezas de flecha) está hipertrófico. Hematoxilina-eosina, x240. Recuadro: algunos enterocitos muestran atipia caracterizada por pérdida de polaridad nuclear, así como hipertrofia nuclear y nucleolar con aumento de la relación núcleo:citoplasma (flechas cortas). Hematoxilina-eosina, x480.
En cuanto a la nematodiasis de vías respiratorias, 7 anfibios mostraban nematodiasis pulmonar y 2 en la cavidad nasal. Los parásitos pulmonares correspondían a Rhabdias según la morfología característica de los nematodos, con presencia de un intestino cargado de pigmento marrón-amarillo (Fig. 8), útero con larvas rabditiformes en diversos estadios de desarrollo (Fig. 8B) y cuerdas laterales vacuolizadas. Las especies afectadas incluían 4 anuros (2 Scaphiophryne spp., 1 Dyscophus guineti y 1 Dendrobates tinctorius) y 3 tritones (Tylototriton spp.). En uno de estos animales, una rana globo de Madagascar (Scaphiophryne pustulosa), se observó un alto número de parásitos asociados a inflamación supurativa luminal (Fig. 8) relacionada con necrosis de algunos de los nematodos, que estaban colonizados por bacterias (Fig. 8B), así como zonas de infiltración intensa de la mucosa respiratoria por macrófagos alrededor de nematodos. En los 6 pacientes restantes no se apreció respuesta tisular a los nematodos. Dos anfibios, un dendrobátido y una mantella, mostraban nematodiasis en la cavidad nasal sin respuesta tisular salvo erosión y compresión de la mucosa nasal en la zona de contacto con los parásitos (Fig. 9).
Figura 8
(A) Pulmón; rana globo de Madagascar (Scaphiophryne pustulosa). Imagen de bronconeumonía supurativa con exudado (flechas) asociado a la presencia de nematodos en la luz pulmonar (cabezas de flecha) característicos de Rhabdias por el pigmento marrón oscuro en la luz de su intestino y los úteros grávidos con larvas en desarrollo. Hematoxilina-eosina, x40. (B) Mismo caso que Fig. 8A. A mayor aumento, se observa el exudado purulento (cabezas de flecha rojas) alrededor de secciones de nematodos con pigmento marrón oscuro en la luz de su intestino (flechas gruesas) y los úteros grávidos con larvas en desarrollo (cabezas de flecha negras), característicos de Rhabdias. Dos de los nematodos están necróticos (asteriscos) y colonizados por abundantes bacterias (flechas delgadas). Hematoxilina-eosina, x400.
Figura 9
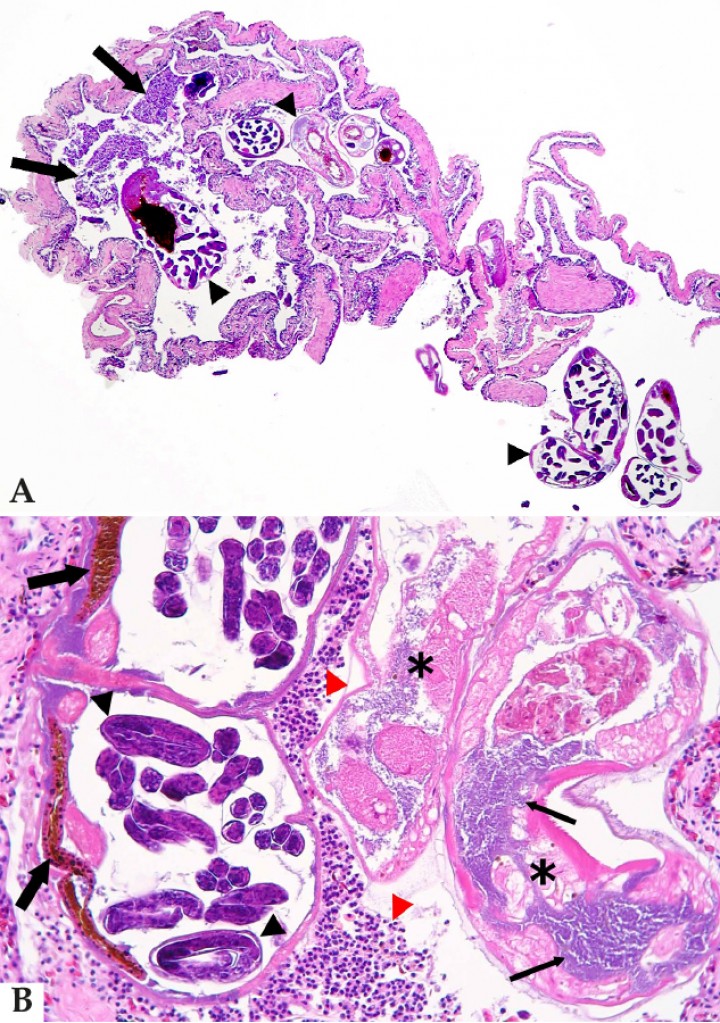
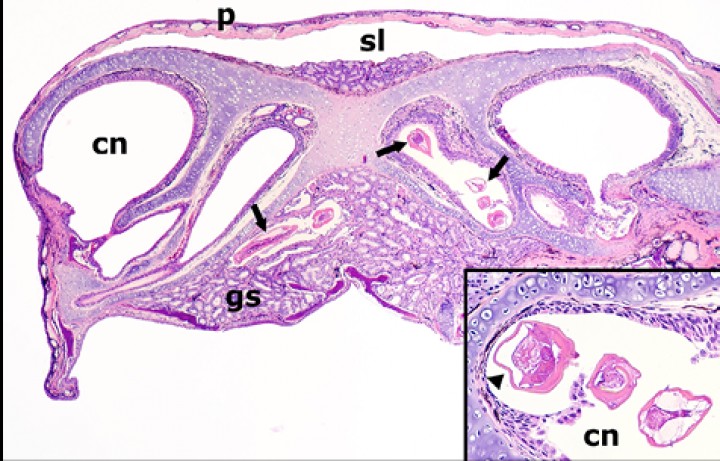
Cabeza; sapito minero (Dendrobates leucomelas). Sección transversal de la cabeza a nivel de la cavidad nasal que demuestra la presencia de nematodos (flechas) en la cavidad nasal (cn) y glándulas salivares (gs); p: piel, sl: seno linfático subcutáneo. Hematoxilina-eosina, x48. Recuadro: nematodos nasales a mayor aumento, en uno de los cuales (derecha) se aprecian proyecciones alares laterales; estos parásitos causan atrofia por compresión de la mucosa nasal (cabeza de flecha). Hematoxilina-eosina, x480.
Del resto de casos de nematodiasis, destacan 4 anfibios con nematodos en la luz del estómago y 1 rana tomate (Dyscophus guineti) con nematodiasis renal tubular luminal leve asociada a nefritis túbulo-intersticial grave con componente bacteriano.
El resto de helmintiasis incluyeron 4 casos de cestodiasis y un único anfibio con trematodiasis. De las cestodiasis, 2 eran subcutáneas, 1 gástrica (en las túnicas musculares del estómago) y 1 involucraba a un tejido no identificable; de las subcutáneas, una se asociaba a un nódulo de calcinosis circunscrita (Figs. 10A y 10B). La trematodiasis afectó a una salamandra jaspeada (Ambystoma opacum) con una masa axilar (Fig. 10C) caracterizada microscópicamente por una celulitis y rabdomiositis necrotizantes con bacterias intralesionales; en el pericardio de este animal se apreció depósito de fibrina, lesión que contenía trematodos y bacterias (Fig. 10D).
Figura 10
(A) Biopsia de nódulo subcutáneo; rana toro (Litoria infrarenata). Parásito en nódulo subcutáneo, sin cavidad corporal ni tubo digestivo, sino un parénquima laxo (asterisco) en el cual están dispersos numerosos corpúsculos calcáreos (flechas) y fibras musculares (cabezas de flecha); dicho parásito está recubierto por un tegumento eosinófilo. Hematoxilina-eosina, x100. (B) Mismo caso que Fig. 9A. Foco de calcinosis circunscripta (depósitos de mineral rodeados por una cápsula fibrosa) asociado al cestodo en el mismo tejido de biopsia de un nódulo subcutáneo. Hematoxilina-eosina, x100. (C) Salamandra jaspeada (Ambystoma opacum). Se observa una masa en la zona axilar. (D) Corazón; salamandra jaspeada (Ambystoma opacum) de la Fig. 9C. El pericardio contiene depósitos de fibrina (flechas) con 4 trematodos intralesionales (cabezas de flecha). C: corazón, v: válvula cardiaca. Hematoxilina-eosina, x200.
En cuanto a las lesiones inflamatorias, destacan las dermatitis (38), hepatitis (35), nefritis (34), neumonías (16), celomitis (15), celulitis (13), glomerulonefritis (10), rabdomiositis (10), linfangitis (8), osteomielitis (7) y pericarditis (5).
Las dermatitis generalmente se observaban en anfibios con bacterias y/u hongos intralesionales; de los 38 casos, en 9 se pudieron demostrar agentes etiológicos específicos (micobacteriosis en 5, quitridiomicosis en 3 y feohifomicosis en 1). En otros 3 casos de quitridiomicosis no se apreció inflamación. En otros casos de infecciones bacterianas y fúngicas, la inflamación cutánea generalmente era leve, pero en algunos anfibios se llegaban a observar lesiones macroscópicas como focos y placas pálidas ligeramente elevadas (Fig. 11A) y úlceras con membranas blanquecinas débilmente adheridas a la piel (Fig. 11B). Destaca un caso de dermatitis y celulitis en una rana flecha amarilla y azul (D. tinctorius) con infección concurrente por bacterias, hongos y protozoos escuticociliados en la región periocular, con inflamación conjuntival y de la glándula de Harder asociada a la colonización de dichos tejidos por estos protozoos. Algunos anfibios con infecciones bacterianas mostraban un componente vesicular en las dermatitis. En un tritón cocodrilo (Tylototriton kweichowensis) se observó una dermatitis caracterizada por zonas de edema intercelular en la epidermis (espongiosis) y formación de vesículas epidérmicas, alguna de las cuales contenía en su interior queratinocitos acantolíticos y necróticos con colonias bacterianas intralesionales (Fig. 12); la piel y los tejidos subyacentes en la cola mostraron necrosis intensa con hongos y bacterias intralesionales. También se observó dermatitis vesicular en un tritón emperador con quitridiomicosis y bacterias en el interior de las vesículas. Por otro lado, en un escuerzo de Cranwell procedente de una colonia con alta mortalidad, se diagnosticó una dermatitis grave con cariomegalia y citomegalia de células epidérmicas y conjuntivales; los estudios de microscopía electrónica en curso han evidenciado partículas víricas. En una rana tomate, la dermatitis estaba asociada a un parásito no identificado. La colonización fúngica y bacteriana de la piel sin dermatitis o con dermatitis de bajo grado histológico era frecuente, particularmente en anfibios autolíticos, en los cuales, y en ausencia de inflamación o necrosis franca, se consideraba un probable hallazgo posterior a la muerte. En cuanto a las lesiones inflamatorias del tejido subcutáneo (14 anfibios), generalmente correspondían a extensiones de dermatitis o, por lo menos, se asociaban a dermatitis; en cuanto a agentes etiológicos específicos, en 5 de estos 14 anfibios la causa era micobacteriosis, en 2 era feohifomicosis y en otros 2, cestodiasis subcutáneas.
Figura 11
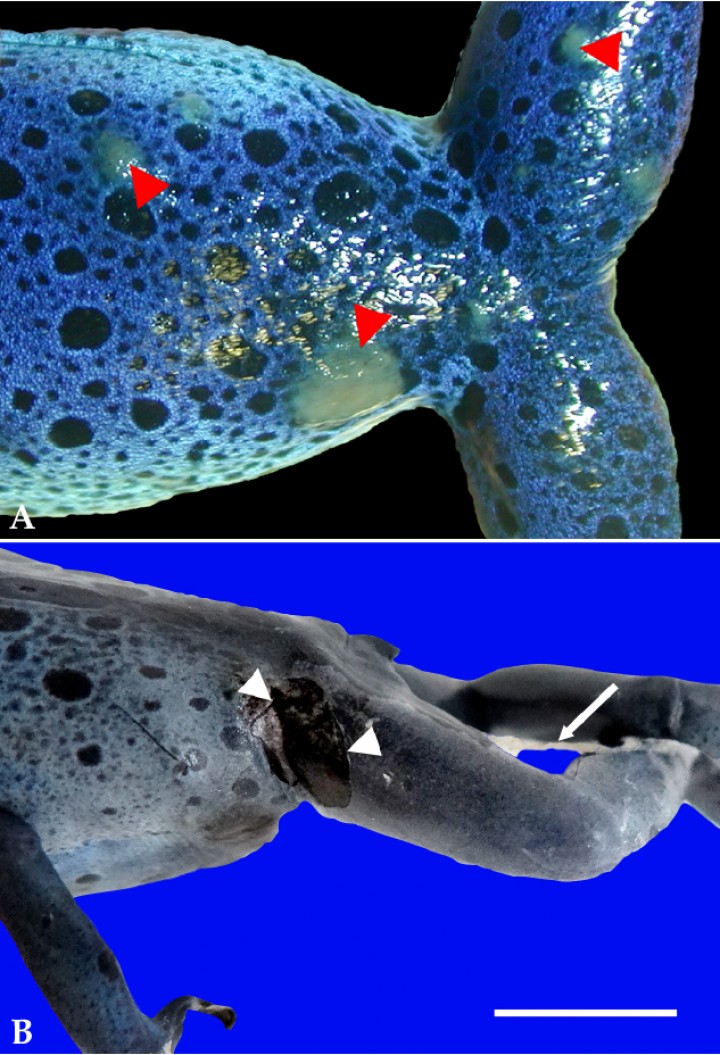
(A) Piel; rana flecha azul (Dendrobates azureus). Se aprecian placas circulares blanquecinas elevadas en la piel (cabezas de flecha). (B) Piel; rana flecha azul (Dendrobates azureus). La zona inguinal caudal y muslo contienen una amplia zona de ulceración (cabezas de flecha); sobre la misma extremidad se distingue una membrana blanquecina adherida multifocalmente a la piel (flecha). Barra: 1 cm.
Figura 12
Piel; tritón cocodrilo de Kweichow (Tylototriton kweichowensis). Imagen de una vesícula epidérmica repleta de queratinocitos acantolíticos (flechas largas) y necróticos, y colonias bacterianas (flechas cortas); *: transición con la epidermis no afectada, d: dermis, g: glándula granular. Hematoxilina-eosina, x200.
De la misma forma, 19 de los 35 casos de hepatitis se debieron a infecciones bacterianas; en total, en 17 anfibios correspondían a granulomas o lesiones histiocíticas con micobacterias intralesionales. Tres casos se debían a infecciones por hongos pigmentados (2 anfibios con feohifomicosis y 1 con cromomicosis [Fig. 6C], descritos previamente).
Las causas principales de nefritis fueron infecciones bacterianas (17/34 casos); en 13 de estos 17 anfibios correspondían a micobacteriosis. En un caso de nefritis túbulo-intersticial bacteriana se observaron también nematodos en la luz de escasos túbulos renales. De los 17 casos restantes, destacan 2 ranas arborícolas de White (Litoria caerulea) con feohifomicosis y 1 caso de un agente compatible morfológica e histoquímicamente con microsporidios (descrito previamente) en un escuerzo de Cranwell (Ceratophrys cranwelli).
La casuística de neumonía (16 pacientes) incluye 8 anfibios con micobacteriosis (neumonía granulomatosa), 2 con feohifomicosis (1 con neumonía granulomatosa y 1 con neumonía supurativa), 1 con nematodiasis pulmonar por Rhabdias (descrito previamente [Fig. 8]) y 5 de causa desconocida; en uno de estos casos, un sapito balear, se asociaba a colecistitis bacteriana.
Entre los 15 anfibios con celomitis, 11 presentaban bacterias intralesionales, incluidos 5 casos de micobacteriosis (celomitis granulomatosa) y 6 por otras bacterias (celomitis supurativas/fibrinosupurativas en 5 de ellas; Fig. 3).
En cuanto a las glomerulonefritis, eran predominantemente membranoproliferativas o mesangioproliferativas (Fig. 13). De los 10 anfibios afectados, 7 mostraban enfermedades bacterianas sistémicas (6 de los cuales correspondían a micobacteriosis) y 7 nematodiasis concurrentes.
Figura 13
Riñón; sapito balear (Alytes muletensis). Se observa hipercelularidad intensa con engrosamiento leve del mesangio de un glomérulo (flechas) e infiltración y marginación de células inflamatorias en capilares (glomerulonefritis mesangioproliferativa); arriba en el centro se distingue un glomérulo no afectado para comparación. Una lesión adicional consiste en vacuolización citoplasmática del epitelio tubular o degeneración vacuolar franca (cabezas de flecha) y necrosis (asterisco). Hematoxilina-eosina, x480.
En 10 anfibios se observó rabdomiositis que, en general, se debía a extensión de inflamación en tejidos adyacentes (principalmente osteomielitis vertebral y dermatitis/celulitis) o a infecciones sistémicas (3 micobacteriosis, 1 bacteriemia aguda, 1 feohifomicosis) que, en alguno de los casos, se acompañaban de necrosis con fragmentación de miocitos.
Las linfangitis, diagnosticadas en 8 anfibios, involucraron al seno linfático subcutáneo de animales con dermatitis y/o celulitis, siendo bacteriana o de componente bacteriano en 6 de ellos. La causa específica más frecuente fue, nuevamente, micobacteriosis (4/8 casos); las endolinfangitis causadas por micobacterias se caracterizaban habitualmente por lesiones trombóticas y/o granulomatosas que obstruían parcialmente la luz del seno linfático subcutáneo (Fig. 2B).
Siete anfibios mostraban osteomielitis, que generalmente afectaba a la columna vertebral, incluidos cuatro dendrobátidos con micobacteriosis. En los 3 anfibios restantes, la osteomielitis vertebral estaba caracterizada por necrosis, depósito de fibrina, lisis del hueso vertebral e infiltración de macrófagos, linfocitos y granulocitos con extensión variable a los tejidos blandos perivertebrales e incluso a las meninges, las raíces de los nervios espinales y la médula espinal. Las tinciones especiales realizadas en dos de ellos (Gram, Ziehl-Neelsen y Stamp) no identificaron patógenos intralesionales.
En cuanto al corazón, 5 anfibios mostraban pericarditis (3 bacterianas, incluido 1 paciente con micobacteriosis [Fig. 1B] y otro con trematodiasis concurrente [Fig. 12]; 1 feohifomicosis; 1 de causa desconocida); 3 presentaban endocarditis trombótica, trombótica-supurativa o granulomatosa (2 micobacteriosis, 1 feohifomicosis); y en 2 se observó miocarditis (1 micobacteriosis, 1 feohifomicosis).
Discusión
Este estudio retrospectivo detalla las causas principales de enfermedades y muerte en 131 anfibios, entre los que destacan 38 sapitos baleares y 48 dendrobátidos como especies más representadas; la totalidad de estos sapitos baleares y 38 de los 48 dendrobátidos procedían únicamente de dos centros, por lo que sus respectivas condiciones de manejo y representatividad en el total de los 131 anfibios pueden haber influido considerablemente en la frecuencia de las diversas enfermedades en estas especies y en el conjunto de los 131 anfibios. En cuanto a los sapitos baleares, este estudio aporta datos relevantes sobre las principales enfermedades de dos colonias de cría en cautividad de esta especie, particularmente la estrongiloidiasis.
Las principales causas de enfermedad y muerte en los anfibios incluidos en este estudio retrospectivo consistían en infecciones, sobre todo bacterianas y fúngicas, y enfermedades parasitarias, habitualmente nematodiasis del tracto digestivo.
La micobacteriosis fue la enfermedad de mayor frecuencia en esta casuística, que afectó principalmente a dendrobátidos (78,9 % de los casos) de dos colonias de zoo, en las cuales se observó únicamente un caso de micobacteriosis en sapitos baleares (de los 37 procedentes de estas mismas instituciones) y otro en un axolote. Estos hallazgos sugieren una mayor susceptibilidad de los dendrobátidos que otros anfibios a la micobacteriosis, la existencia de unas condiciones epizootiológicas y de manejo que favorecieron la transmisión en individuos de esta familia y/o una mayor representación de estas especies dentro de los anfibios en las respectivas instituciones zoológicas. A pesar de las numerosas descripciones de micobacteriosis en anfibios existentes en la bibliografía,6-15 los dendrobátidos no están representados de forma amplia en ellas. Esta casuística incluye también dos casos en axolotes; en esta y otras especies de anfibios del orden Caudata, la micobacteriosis está muy raramente descrita, con un único estudio reciente en tritones de Hong Kong (Paramesotriton hongkongensis).13 La micobacteriosis se comportó habitualmente como una enfermedad sistémica cuyos órganos diana principales eran hígado, riñón, pulmón, bazo, médula ósea/hueso, tejido subcutáneo, intestino y piel; esta observación concuerda con lo descrito para la enfermedad en anfibios, si bien existe una descripción reciente de una presentación localizada como artritis-sinovitis en 20 ranas jaspeadas (Hyperolius marmoratus).6 Aunque la inflamación es habitualmente granulomatosa,6-12,15 se han descrito también lesiones necrotizantes en tritones de Hong Kong.13 A pesar del carácter sistémico de la infección y de la cronicidad de la inflamación, los anfibios afectados en este estudio habitualmente mostraban una buena condición corporal. Las micobacterias que causan enfermedad en anfibios pertenecen habitualmente al medio acuático; M. liflandii, M. marinum, M. chelonae, M. xenopi o M. szulgai son las especies más frecuentemente descritas.6-13,15 Las micobacterias involucradas en esta casuística no fueron tipificadas.
Del resto de infecciones bacterianas, destacan los casos de celomitis fibrinosas/fibrinosupurativas agudas y casos esporádicos de bacteriemia con lesiones necrotizantes incipientes en diversos órganos, aunque solo se dispone de cultivo bacteriano (Pseudomonas) en uno de estos anfibios. Bacterias como Aeromonas hydrophila, Chryseobacterium (Flavobacterium) o Pseudomonas son aislamientos frecuentes en anfibios con bacteriemia/septicemia y lesiones como edema subcutáneo, hiperemia cutánea (“red leg”), hidroceloma, celomitis, meningitis, otitis e inflamación y/o necrosis sistémica.16-19
En cuanto a las infecciones fúngicas, es notoria la observación de solo 6 casos de quitridiomicosis en estos 131 anfibios a pesar de la diseminación geográfica global de los hongos quítridos causantes, Batrachochytrium dendrobatidis y B. salamandrivorans, involucrados en el declive de numerosas especies de anfibios a nivel mundial1,20-22 y objeto de numerosos estudios científicos en los últimos años; este hallazgo indica que la quitridiomicosis era de baja frecuencia en esta casuística. Dado que la casi totalidad de los anfibios se procesaron en cortes transversales seriados de todo el cuerpo, se evaluó una superficie de piel considerable de cada anfibio y de todas las localizaciones corporales, lo que hace difícil que la histopatología haya pasado por alto la detección de casos de quitridiomicosis con lesiones cutáneas compatibles y/o grado de infección relevante, con excepción de raros casos de anfibios que hubieran podido expulsar las capas queratinizadas de la epidermis infectadas de forma completa y, por otro lado, de animales infectados subclínicamente con escasos hongos quitridios.1 Sin embargo, no se realizaron estudios moleculares (PCR) ni de inmunohistoquímica para descartarlos completamente.
Las infecciones fúngicas cutáneas fueron consideradas habitualmente secundarias y, en algunos pacientes, resultó difícil distinguirlas de proliferación post mortem debido a la escasa o nula respuesta tisular. Con excepción de las infecciones fúngicas cutáneas, el resto de micosis fueron de muy baja frecuencia y solo destacan dos casos sistémicos letales de feohifomicosis (el caso de cromomicosis fue incidental). La feohifomicosis y cromomicosis constituyen infecciones por hongos pigmentados que han sido descritas previamente en anfibios, particularmente la cromomicosis.23-27
Entre las enfermedades parasitarias, destaca la estrongiloidiasis por su frecuencia y por su asociación a proctitis, prolapso rectal/proctocloacal e intususcepciones intestinales en sapitos baleares, por lo que en esta especie o en las dos poblaciones de cría en cautividad representadas en este estudio parece un problema de enfermedad mayor. En este sentido, en una de ellas también se diagnosticó estrongiloidiasis en 5 ranas flecha azul que murieron de micobacteriosis sistémica, pero sin la misma intensidad de infestación ni presentación de prolapso proctocloacal, por lo que es posible que estos dendrobátidos fueran menos vulnerables a esta enfermedad. La estrongiloidiasis ha sido raramente descrita como causa de enfermedad y muerte en anfibios.28 Se requieren estudios adicionales para la caracterización del parásito y del origen de la infestación, así como para tratar de comprender la dinámica de relación parásito-hospedador y determinar una posible mayor susceptibilidad de los sapitos baleares a esta enfermedad. Se diagnosticaron otras enfermedades parasitarias, principalmente otras nematodiasis gastrointestinales e infestación pulmonar por Rhabdias spp., que se consideraron probablemente incidentales teniendo en cuenta la carga parasitaria detectada histológicamente, la ausencia de respuesta tisular y/o la buena condición corporal de los anfibios afectados. Sin embargo, una rana globo de Madagascar sufrió una neumonía supurativa contribuyente a la muerte y debida a infestación por Rhabdias, que se complicó con infección bacteriana y necrosis de los nematodos pulmonares; esta infección y necrosis de los parásitos probablemente contribuyó a la neumonía. La infestación por Rhabdias ha sido considerada una causa de mortalidad relevante en algunas especies de anfibios en cautividad.28,29
Destaca también el caso de trematodiasis en una salamandra jaspeada (Ambystoma opacum) con una masa axilar (celulitis y rabdomiositis necrotizantes con bacterias intralesionales) y pericarditis con trematodos y bacterias intralesionales; es posible que la infección bacteriana hubiera sido consecuencia de la migración cutánea de los trematodos. En este sentido, existe una descripción de trematodiasis causante de lesiones nodulares subcutáneas y tractos de migración con extensión a músculos esqueléticos en salamandras tigre (Ambystoma tigrinum) por metacercarias de Clinostomum sp.30 Otro caso relevante es la nefritis túbulo-intersticial mortal de un escuerzo de Cranwell causada por un agente compatible con un microsporidio microscópica e histoquímicamente; las microsporidiosis han sido raramente descritas en anfibios.31
Finalmente, es notoria la ausencia casi completa de evidencias de infecciones víricas en esta casuística, con excepción de un caso de dermatitis vírica epizoótica en escuerzos de Cranwell. Cabe recordar, sin embargo, que no se realizaron rutinariamente en estos 131 anfibios técnicas de detección directa de genoma (por ejemplo, PCR o hibridación in situ), antígeno (inmunohistoquímica) o partículas víricas (microscopía electrónica), por lo que algunas infecciones podrían haber pasado desapercibidas, particularmente en casos de lesiones inflamatorias o necrotizantes sin agentes etiológicos identificados. A pesar de la importancia de la infección por ranavirus como causa de altas mortalidades en anfibios, principalmente en poblaciones salvajes,32 no se observaron evidencias de esta enfermedad en este estudio que, por otro lado solo incluía anfibios mantenidos en cautividad.
En conclusión, las especies más representadas en este estudio retrospectivo fueron los sapitos baleares y, en conjunto, los dendrobátidos. Las enfermedades infecciosas más frecuentes fueron las infecciones bacterianas, particularmente la micobacteriosis, y las infecciones fúngicas; solo se observaron evidencias histopatológicas de infección vírica en un escuerzo de Cranwell. La micobacteriosis, que afectó principalmente a dendrobátidos, fue la enfermedad más frecuente y se caracterizó por una presentación habitualmente sistémica. De las enfermedades parasitarias, destacó la estrongiloidiasis, que afectó particularmente a sapitos baleares con proctitis, prolapso rectal/proctocloacal e intususcepción intestinal.
Agradecimientos
La/os autora/es agradecen a los siguientes profesionales e Instituciones por la contribución de casos a este estudio: Animales Exóticos 24h – Pablo Casar (Madrid), Biodomo Granada – Laura Marcos Vicente (Granada), Bioparc Valencia (Valencia), Centro Veterinario La Marina Exóticos – Mireia Máinez (Elche), Centro Veterinario Los Sauces (Madrid), Clínica Exòtics (Barcelona), Clínica Veterinaria Gecko – Esther Carpintero (Vigo), Clínica Veterinaria Madagascar – Carlos Ouro (Madrid), Clínica Veterinaria Selvätica – José Villora (Valencia), Hospital Vets Avinguda – Xavier Riera (Sabadell), Palmitos Park – Ayose Melián (Gran Canaria) y Parc Zoològic de Barcelona (Barcelona). Igualmente, nuestro agradecimiento a Arturo Guimerà por su colaboración en la búsqueda bibliográfica, a Elizabeth S. Didier y Lisa C. Bowers (School of Public Health and Tropical Medicine, Tulane University, New Orleans, Louisiana, EE. UU.) por la PCR de microsporidios realizada en un escuerzo de Cranwell, a Synlab (Esplugues de Llobregat) por la excelente asistencia con la histotecnología y a Blanca Pérez de la UD Histologia i Anatomia Patològica (Facultat de Veterinària, Universitat Autònoma de Barcelona, Bellaterra) por la realización de tinciones especiales (Gram, Stamp, PAS).
Fuente de financiación: esta investigación no se realizó con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran que no existe conflicto de intereses en los datos publicados.
Bibliografía
- 1.
Pessier A. Chytridiomycosis. En: Mader DR, Divers SJ (ed): Current therapy in reptile medicine and surgery. St Louis: Saunders; 2014; 254-270.
- 2.
Johnson PT, Sutherland DR, Kinsella JM, Lunde KB. Review of the trematode genus Ribeiroia (Psilostomidae): ecology, life history and pathogenesis with special emphasis on the amphibian malformation problem. Adv Parasitol 2004; 57:191-253.
[pubMed] - 3.
Romansic JM, Johnson PT, Searle CL, et al. Individual and combined effects of multiple pathogens on Pacific tree frogs. Oecologia 2011; 166(4):1029-1041.
[PubMed] - 4.
Govern de les Illes Balears. II Pla de Recuperació del Ferreret. https://www.caib.es/sites/proteccioespecies/f/178191.
- 5.
Rosell J, Máinez M, Didier ES, et al. Encephalitozoon hellem infection in aviary passerine and psittacine birds in Spain. Vet Parasitol 2016; 219:57-60.
[pubMed] - 6.
Barrows M, Koeppel K, Michel A, Mitchell E. Mycobacterial arthritis and synovitis in painted reed frogs (Hyperolius marmoratus). J Comp Pathol 2017; 156(2-3):275-280.
[PubMed] - 7.
Chai N, Deforges L, Sougakoff W, et al.. Mycobacterium szulgai infection in a captive population of African clawed frogs (Xenopus tropicalis). J Zoo Wildl Med 2006; 37(1):55-58.
[pubMed] - 8.
Chai N. Mycobacteriosis in amphibians. En Miller RE, Fowler ME (ed): Fowler’s Zoo and Wild Animal Medicine. Current therapy, vol. 7. St. Louis: Elsevier Saunders; 2012; 224-230.
- 9.
Ferreira R, Fonseca Lde S, Afonso AM, et al. A report of mycobacteriosis caused by Mycobacterium marinum in bullfrogs (Rana catesbeiana). Vet J 2006; 171(1):177-180.
[PubMed] - 10.
Fremont-Rahl JJ, Ek C, Williamson HR, et al. Mycobacterium liflandii outbreak in a research colony of Xenopus (Silurana) tropicalis frogs. Vet Pathol 2011; 48(4):856-867.
[pubMed] - 11.
Green SL, Lifland BD, Bouley DM, et al. Disease attributed to Mycobacterium chelonae in South African clawed frogs (Xenopus laevis). Comp Med 2000; 50(6):675-679.
[PubMed] - 12.
Haridy M, Tachikawa Y, Yoshida S, et al. Mycobacterium marinum infection in Japanese forest green tree frogs (Rhacophorus arboreus). J Comp Pathol 2014; 151(2-3):277-289.
[pubMed] - 13.
Li WT, Chang HW, Pang VF, et al. Mycolactone-producing Mycobacterium marinum infection in captive Hong Kong warty newts and pathological evidence of impaired host immune function. Dis Aquat Organ 2017; 123:239-249.
[PubMed] - 14.
Sánchez-Morgado JM, Gallagher A, Johnson LK. Mycobacterium gordonae infection in a colony of African clawed frogs (Xenopus tropicalis). Lab Anim 2009; 43(3):300-303.
[pubMed] - 15.
Suykerbuyk P, Vleminckx K, Pasmans F, et al. Mycobacterium liflandii infection in European colony of Silurana tropicalis. Emerg Infect Dis 2007; 13(5):743-746.
[PubMed] - 16.
Green SL, Bouley DM, Tolwani RJ, et al. Identification and management of an outbreak of Flavobacterium meningosepticum infection in a colony of South African clawed frogs (Xenopus laevis). J Am Vet Med Assoc 1999; 214(12):1833-1838, 1792-1793.
[pubMed] - 17.
Mauel MJ, Miller DL, Frazier KS, Hines ME 2nd. Bacterial pathogens isolated from cultured bullfrogs (Rana castesbeiana). J Vet Diagn Invest 2002; 14(5):431-433.
[PubMed] - 18.
Olson ME, Gard S, Brown M, Hampton R, Morck DW. Flavobacterium indologenes infection in leopard frogs. J Am Vet Med Assoc 1992; 201(11):1766-1770.
[pubMed] - 19.
Taylor FR, Simmonds RC, Loeffler DG. Isolation of Flavobacterium meningosepticum in a colony of leopard frogs (Rana pipiens). Lab Anim Sci 1993; 43(1):105.
[PubMed] - 20.
Seeley KE, D’Angelo M, Gowins C, Greathouse J. Prevalence of Batrachochytrium dendrobatidis in Eastern hellbender (Cryptobranchus alleganiensis) populations in West Virginia, USA. J Wildl Dis 2016; 52(2):391-394.
[pubMed] - 21.
Stegen G, Pasmans F, Schmidt BR, et al. Drivers of salamander extirpation mediated by Batrachochytrium salamandrivorans. Nature 2017; 544(7650):353-356.
- 22.
Yap TA, Nguyen NT, Serr M, Shepack A, Vredenburg VT. Batrachochytrium salamandrivorans and the risk of a second amphibian pandemic. Ecohealth 2017; 14(4):851-864.
[PubMed] - 23.
Bube A, Burkhardt E, Weiß R. Spontaneous chromomycosis in the marine toad (Bufo marinus). J Comp Pathol 1992; 106(1):73-77.
[pubMed] - 24.
de Brito-Gitirana L, Silva-Soares. Chromomycosis in Rhinella icterica. Open Zool J 2012; 5:38-41.
- 25.
Hosoya T, Hanafusa Y, Kudo T, Tamukai K, Une Y. First report of Veronaea botryosa as a causal agent of chromomycosis in frogs. Med Mycol 2015; 53(4):369-377. Erratum in: Medical Mycology, 53(5):528.
[PubMed] - 26.
Miller EA, Montali RJ, Ramsay EC, Rideout BA. Disseminated chromoblastomycosis in a colony of ornate-horned frogs (Ceratophrys ornata). J Zoo Wildl Med 1992; 23(4):433-438.
- 27.
Pessier AP. Edematous frogs, urinary tract disease, and disorders of fluid balance in amphibians. J Exot Pet Med 2009; 18(1):4-13.
- 28.
Pessier A. Infectious diseases of amphibians: it isn’t just redleg anymore. En: Mader DR, Divers SJ (ed): Current therapy in reptile medicine and surgery. St Louis: Saunders; 2014; 247-254.
- 29.
Lee S, Zippel K, Ramos L, Searle J. Captive breeding programme for the Kihansi spray toad Nectophrynoides asperginis at the Wildlife Conservation Society, Bronx, New York. Int Zoo Yearbook 2006; 40(1):241-253.
- 30.
Perpiñán D, Garner MM, Trupkiewicz JG, et al. Scoliosis in a tiger salamander (Ambystoma tigrinum) associated with encysted digenetic trematodes of the genus Clinostomum. J Wildl Dis 2010; 46(2):579-584.
[pubMed] - 31.
Gamble KC, Garner MM, West G, et al. Kyphosis associated with microsporidial myositis in San Marcos salamanders, Eurycea nana. J Herpetol Med Surg 2005; 15(1):14-18.
- 32.
Miller DL. Ranavirus. En: Mader DR, Divers SJ (ed): Current therapy in reptile medicine and surgery. St Louis: Saunders; 2014; 277-280.