Preselección del sexo mediante citometría de flujo en la especie canina: situación actual
Sex pre-selection using flow cytometry in dogs: current situation
C. Ródenas, I. Parrilla, X. Lucas
Contacto: xiolucas@um.es
Resumen
La preselección del sexo de la descendencia basada en la separación de espermatozoides X e Y mediante citometría de flujo es una biotecnología emergente en la especie canina. El desarrollo y la optimización de su eficiencia contribuirían a la mejora de los programas de cría, en combinación con otras técnicas utilizadas ya actualmente de forma rutinaria en esta especie, como son la conservación de semen y la inseminación artificial. A continuación, se revisan diversos aspectos en los que se basa esta biotecnología, así como su situación actual y limitaciones en la especie canina.
Palabras clave: canino, espermatozoide, sexaje, criopreservación, inseminación.
Clin Vet Peq Anim 2020, 40 (2): 83-88
Summary
Sex pre-selection of offspring based on the separation of X and Y sperm cells by flow cytometry is an emerging biotechnology in the canine species. The development and optimization of this biotechnology efficiency, combined with other biotechnologies already used in this species, such as seminal cryopreservation and artificial insemination, would contribute to the improvement of breeding programs. We review various aspects on which this biotechnology is based, as well as the current situation and limitations in the canine species.
Keywords: dog, spermatozoa, sex-sorting, cryopreservation, insemination.
Clin Vet Peq Anim 2020, 40 (2): 83-88

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
En los últimos años se ha producido un notable incremento del interés por la reproducción en la especie canina. Actualmente, determinadas tecnologías reproductivas, como la inseminación artificial (IA) intrauterina mediante endoscopía rígida y procedimientos de refrigeración y criopreservación espermática, tienen una gran aplicación práctica en la clínica de pequeños animales. Estas técnicas son muy demandadas fundamentalmente por criadores de razas puras y asociaciones caninas, pero también y cada vez más por propietarios particulares.1 La aplicación de estas técnicas es interesante tanto desde un punto de vista de selección y lucrativo en la cría de razas puras, como en los programas de cría de perros destinados a la guía de invidentes, trabajo o salvamento en instituciones como la Policía y Bomberos.2 Por otro lado, estas biotecnologías están contribuyendo de forma muy importante a la expansión del mercado internacional de semen canino, debido principalmente a las ventajas que supone eliminar el transporte de animales vivos, lo que minimiza costes, problemas sanitarios y facilita la aplicación de la IA. Además, la criopreservación espermática y la creación de bancos de semen resultan fundamentales para preservar recursos genéticos de machos de gran valor o cánidos en peligro de extinción durante un periodo muy prolongado de tiempo.
El desarrollo de la biotecnología de preselección del sexo de la descendencia en la especie canina, en combinación con las técnicas rutinarias anteriormente nombradas, contribuiría a mejorar aún más los programas de cría.3-5 En primer lugar, se podrían obtener grandes logros en cuanto a una mayor rentabilidad en la cría de ejemplares de razas puras, dado que nos permitiría obtener mascotas del sexo deseado, ya sean machos o hembras, lo que es de gran interés económico para los criadores. Por otro lado, es muy interesante en el campo de la cría de perros guía, policía, militares o entrenados para el rescate, guarda y defensa, ya que se ha establecido una relación entre el sexo y el temperamento, influyendo de forma importante en la selección de estos animales.4,6 Finalmente, el desarrollo y posible aplicación de esta biotecnología también nos permitiría contribuir de forma importante en los programas de recuperación de cánidos en peligro de extinción como, por ejemplo, el perro salvaje africano7 (Lycaon pictus) o muchas subespecies de lobos.1
El objetivo del presente trabajo es revisar la técnica de preselección de sexo en la especie canina.
¿En qué se basa la biotecnología de preselección del sexo de la descendencia?
La preselección del sexo de la descendencia mediante citometría de flujo es actualmente la única técnica eficiente para dicho fin utilizada en diversas especies. Dicho procedimiento, que se desarrolló por primera vez en el conejo hace más de 30 años,8 se basa en la mayor cantidad de ADN que porta el espermatozoide con un cromosoma X en relación con el que porta un cromosoma Y.8 Esta diferencia de ADN entre ambas poblaciones espermáticas X e Y está muy bien determinada y es característica de cada especie animal. En el caso de la especie canina existe una diferencia de un 3,9 %.9
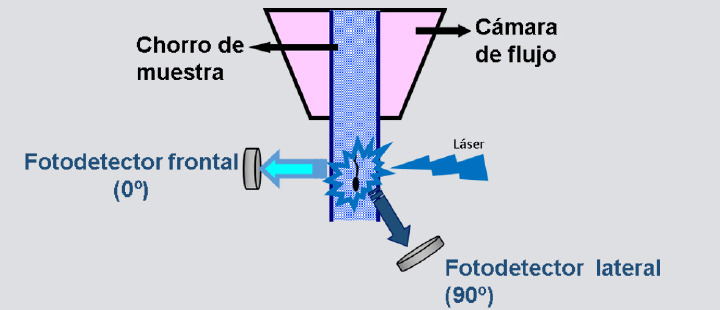
Este diferente contenido de ADN permite la separación de los espermatozoides mediante la utilización de un citómetro de flujo adaptado para dicho fin equipado con un láser ultravioleta (Fig. 1). Resumidamente, las células espermáticas se tiñen con un fluorocromo denominado Hoechst 33342 (H-42) que se une al ADN de forma específica pero no intercalante, con el fin de diferenciar entre ambas poblaciones. Debido a que el espermatozoide X en los mamíferos porta mayor cantidad de ADN, emite mayor fluorescencia que el espermatozoide Y. Es muy importante tener en cuenta la característica morfología aplanada o en “pala de remo” de las células espermáticas de los mamíferos. Con el fin de que las células espermáticas sean identificadas correctamente como X o Y en base a la diferente fluorescencia emitida, es necesario que pasen a través del citómetro de flujo correctamente orientadas con la cara plana en eje con el láser y la cara longitudinal alineada 90º con el fotodetector. Para ello, los citómetros de flujo destinados a este fin constan de un sistema o cámara de flujo que logra esa orientación (Fig. 2).10 Esta técnica de separación de los espermatozoides X e Y tiene una precisión del 85-90 %.
Figura 1
Citómetro de flujo adaptado para el sexaje de espermatozoides. (A) Baño de agua a 36 ºC en oscuridad para incubación de espermatozoides con el fluorocromo Hoechst 33342. (B) Citómetro de flujo MoFlo SX. (C) Muestra espermática teñida con Hoechst 33342 y food dye (flecha). (D) Impacto del láser ultravioleta (flecha blanca) sobre la muestra de espermatozoides (flecha verde). (E) Placas cargadas eléctricamente para la separación y recolección de la población de espermatozoides con cromosoma X, en este caso.
Figura 2
Representación esquemática del paso a través de la cámara de flujo del citómetro y la orientación de las células espermáticas con respecto al láser ultravioleta y al fotodetector.
Situación actual de la biotecnología de preselección del sexo en la especie canina
La tecnología de separación de espermatozoides X e Y mediante citometría de flujo solamente se aplica a nivel comercial en el ganado vacuno, donde ha alcanzado un gran interés.10 Sin embargo, ya ha sido aplicada con éxito para obtener crías del sexo deseado en varias especies domésticas como el porcino, ovino y equino.11 Recientemente, se han llevado a cabo múltiples estudios con el fin de extender su aplicación a otras especies domésticas como el gato,12,13 así como a ciertas especies en peligro de extinción y/o salvajes, como son los primates,9 delfines,14 alpacas,15 elefantes,16 búfalos17 y rinocerontes.18 Aunque se espera poder aplicar esta biotecnología de forma importante en la mayoría de las especies domésticas y en peligro de extinción, en la actualidad solo ha alcanzado un interés comercial importante en el ganado vacuno.18
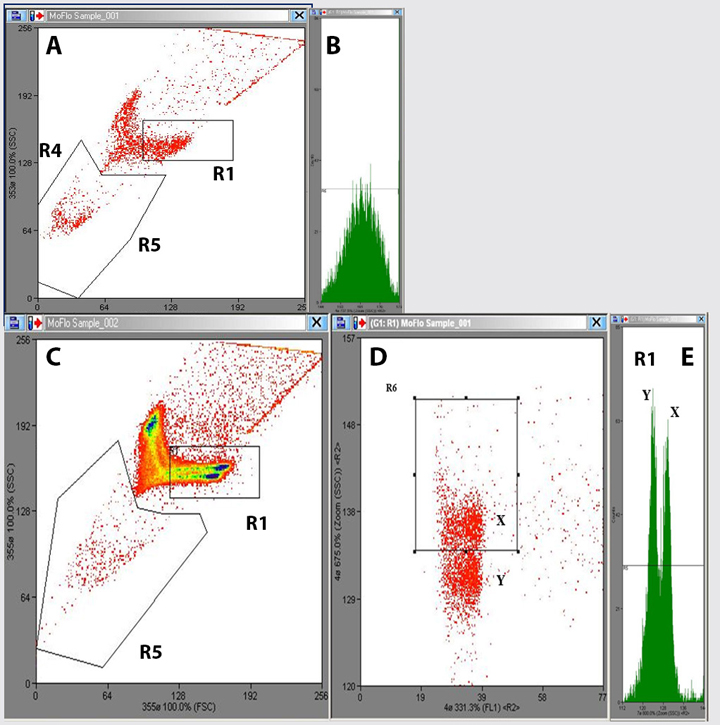
En el caso de la especie canina, a pesar del interés que implicaría poder aplicar esta biotecnología a nivel práctico, la información sobre la separación de espermatozoides X e Y mediante citometría de flujo es aún muy escasa. El primer estudio publicado en la especie canina fue en el año 20083 y se logró el nacimiento de cachorros de Golden Retriever utilizando, mediante inseminación intrauterina, semen fresco separado mediante citometría de flujo con una eficiencia del 60 % en relación con el porcentaje de hembras esperado. A pesar de dicho éxito, los autores no describen con detalle un protocolo estandarizado y optimizado que pudiera ser utilizado de forma rutinaria en esta especie. En el año 201419 se publicó por primera vez un estudio donde se determinaron varios aspectos esenciales como la optimización de las concentraciones necesarias de fluorocromo H-42 para la tinción, identificación y posterior separación de ambas poblaciones de espermatozoides X e Y y el establecimiento de un protocolo para el adecuado manejo de los espermatozoides antes, durante y tras el procedimiento de separación. Tras la tinción con H-42, los espermatozoides fueron teñidos con 1 µl de colorante alimentario o food dye con el fin de apagar la fluorescencia del H-42 en los espermatozoides muertos y así poder identificarlos y excluirlos del procedimiento. Posteriormente, los espermatozoides caninos fueron identificados como X o Y, y finalmente separados mediante la utilización de un citómetro de flujo adaptado para este fin y equipado con un láser ultravioleta (Moflo SX, Dako Cytomation Inc. Fort Collins, CO, EE.UU.). Las poblaciones espermáticas generadas por el citómetro se muestran en la Fig. 3. Para recoger la población espermática X o Y seleccionada, los espermatozoides son sometidos a la aplicación de una carga eléctrica y atraídos por un ánodo o cátodo, respectivamente, en función de la carga aplicada (Fig. 3E). Los resultados de motilidad espermática obtenidos tras el procedimiento descrito fueron del 62-70 %,19 similares a los obtenidos habitualmente en semen criopreservado y posteriormente descongelado en la especie canina.5,20-22
Figura 3
(A, B) Gráficas en forma de dotplot e histograma generados por el citómetro de flujo tras analizar una muestra espermática teñida con 5 µl de H-42. Se puede observar que no es posible la identificación de ambas poblaciones espermáticas X e Y. (C, D, E) Gráficas en forma de dotplot e histograma que muestran las señales de fluorescencia generadas tras el análisis de una muestra espermática teñida con 10 µl de H-42. Las poblaciones X e Y se diferencian claramente. La región R1 representa la población que pasa correctamente orientada con respecto al láser del citómetro de flujo. La región R5 representa los espermatozoides que incorporan el colorante food-dye y que no son viables y, por ende, son desechados.
Por otra parte, en dicho estudio19 se observó que, de la misma forma que ocurre en otras especies animales, la eficiencia del procedimiento de separación de espermatozoides X e Y está altamente influida por el macho donante de semen, variabilidad que ya había sido anteriormente descrita en verracos,23 caballos24 y toros.25 Así, al igual que existen variaciones individuales en los procesos de refrigeración y criopreservación espermática que condicionan el uso de los machos donantes, habría que considerar también esta variación individual a la hora de incluir determinados machos en programas de sexado de espermatozoides. Este hecho hace que se cuestione, al igual que en el toro,11 que pueda existir variabilidad en la eficiencia del proceso en función de la raza. Teniendo en cuenta la gran variedad de razas caninas existentes, deberían plantearse futuros estudios al respecto.
Limitaciones actuales de la técnica en la especie canina
Hoy en día podemos destacar dos limitaciones importantes. Por un lado, la baja eficiencia del proceso y, por otro, el número de espermatozoides requeridos para realizar una IA con éxito tras la separación de estos espermatozoides.
En relación con la baja eficiencia, el procedimiento solo permite alcanzar de momento una producción promedio de 14-16 millones de espermatozoides separados X o Y en una hora. Este hecho se atribuye al bajo porcentaje de orientación conseguido en esta biotecnología para los espermatozoides caninos, siendo del 22-45 % en función de la muestra, mientras que llega hasta el 60-80 % en otras especies donde la tecnología se usa de forma comercial.26 Este porcentaje de orientación es similar al descrito en otras especies domésticas como el gato12,13 y está atribuido a la morfología de las cabezas espermáticas de esta especie que, al igual que ocurre en la especie canina, son más redondeadas, pequeñas y anguladas en el borde, a diferencia de otras especies como el toro o el verraco donde son más grandes y aplanadas y dicha tecnología es más eficiente.11 A pesar de la baja eficiencia de la técnica obtenida para la especie canina, esta es similar a la obtenida en el caballo24 e incluso mejor que la descrita en otras especies domésticas como el gato13 y algunas especies salvajes como el rinoceronte18 y el elefante.16
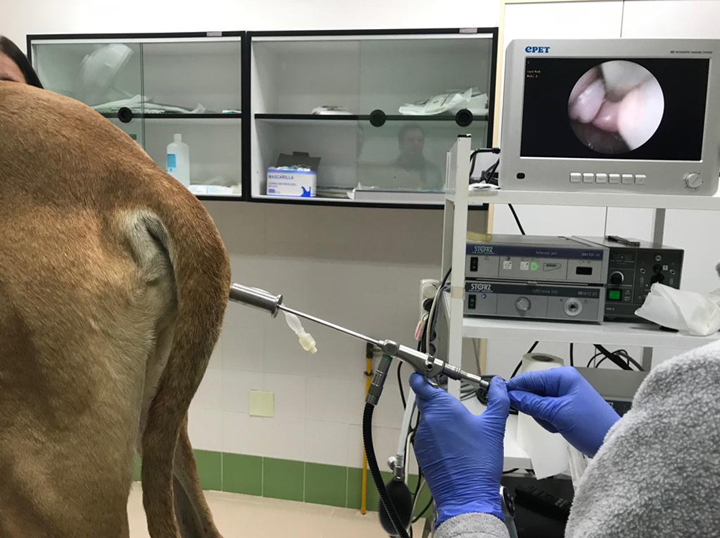
Con respecto al número de espermatozoides requeridos para realizar una IA, está descrito que son necesarios al menos 150-200 millones de espermatozoides móviles por inseminación vaginal e intrauterina en el perro.27 Por tanto, esta biotecnología sería incompatible en la actualidad con esta dosis de inseminación debido a la baja eficiencia de la técnica. Se debería optar, en todo caso, por la realización de inseminaciones transcervicales, principalmente mediante endoscopia (Fig. 4) o laparotomía, que son las técnicas más usadas a nivel práctico. Dichas técnicas nos permitirían depositar los espermatozoides sexados directamente en el interior del útero, lo que permitiría reducir el número de millones empleados.
Figura 4
Inseminación intrauterina mediante el uso de un fibroendoscopio rígido especialmente diseñado para tal fin. Una vez introducido hasta la porción más craneal de la vagina, se observa en la pantalla la introducción de la sonda estéril en el interior del cérvix de la perra.
Uno de los últimos avances importantes en la técnica va orientado a intentar optimizar una de las mayores limitaciones del uso de semen sexado en el perro que es el tiempo necesario que se requiere para obtener un número adecuado de espermatozoides X o Y separados. En el año 2015, Merlo et al28 intentaron desarrollar un protocolo de conservación de los espermatozoides sexados mediante su criopreservación. El objetivo de dicho estudio fue doble. Por una parte, conservar los espermatozoides tras el proceso de selección con el fin de obtener una dosis suficiente para lograr una IA intrauterina más eficiente. Por otra, su conservación a largo plazo facilitando su transporte y/o comercio internacional.28 Los resultados de dicho estudio no fueron óptimos, ya que aunque fue posible realizar este procedimiento de criopreservación, la calidad de los espermatozoides sexados tras la descongelación disminuía significativamente. Se obtuvo un porcentaje de solo el 2,4 % de espermatozoides mótiles totales, siendo muy bajo en comparación al 52,9 % obtenido en el semen sexado sin criopreservar. Igualmente, la calidad de movimiento del semen sexado tras la descongelación fue solamente del 0,6 en una escala de 0 a 5.
En el año 2017 se publicó un nuevo estudio con resultados muy esperanzadores,29 lográndose el nacimiento de cachorros viables del sexo deseado mediante una sola IA con tan solo 4 x 106 espermatozoides sexados, criopreservados y descongelados mediante el método Uppsala.30 Hasta este momento, el número más bajo de espermatozoides descrito en el perro para una inseminación era de, al menos, 50 millones.31 Para lograr estos resultados los espermatozoides sexados tras la descongelación fueron depositados a nivel intraoviductal mediante laparotomía en 60 hembras de diferentes razas (Pastor Alemán, Pastor de Malinois y Perro Lobo de Kunming). Todas las hembras fueron sometidas a un control riguroso del ciclo estral mediante citología y determinaciones de progesteronas séricas seriadas, estableciéndose tres grupos: grupo control (20 hembras inseminadas con 100 millones de espermatozoides criopreservados no sexados), grupo X (20 hembras inseminadas con 4 millones de espermatozoides X criopreservados) y grupo Y (20 hembras inseminadas con 4 millones de espermatozoides Y criopreservados). El porcentaje de hembras gestantes fue del 30 % en el grupo X y de 25 % en el grupo Y, frente al 65 % en el grupo control. La eficacia del proceso, es decir, la obtención de cachorros del sexo deseado fue del 85 %. Estos resultados hacen que dicha tecnología se convierta en potencialmente aplicable en un futuro en los programas de cría canina.
Conclusión
A pesar de que la separación del sexo mediante citometría de flujo en la especie canina es factible a nivel experimental, aún se necesitan estudios futuros que permitan incrementar la eficacia global del proceso, así como el desarrollo de protocolos de conservación de dichos espermatozoides separados para que pueda ser utilizada a nivel práctico.
Fuente de financiación: este trabajo no se realizó con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Thomassen R, Farstad W: Artificial insemination in canids: A useful tool in breeding and conservation. Theriogenology 2009; 71: 190-199.
[PubMed] - 2.
Futino DO, Mendes MCB, Matos WNL, Mondadori RG, Lucci CM: Glycerol, methyl-formamide and dimethyl-formamide in canine semen cryopreservation. Reprod Dom Anim 2010; 45: 214-220.
- 3.
Meyers MA, Burns G, Am D, Schenk JL: 266 Birth of canine offspring following insemination of a bitch with flow-sorted spermatozoa. Reprod Fertil Dev 2008; 20: 213.
- 4.
Oi M, Yamada K, Hayakawa H, Suzuki H: Sexing of dog sperm by fluorescence in situ hybridization. Reprod Dev 2013; 59: 92-96.
[PubMed] - 5.
Rodenas C, Parrilla I, Roca J, Martinez EA, Lucas X: Effects of rapid cooling prior to freezing on the quality of canine cryopreserved spermatozoa. J Reprod Dev 2014; 60(5): 355-361.
[PubMed] - 6.
Garner DL, Seidel Jr GE: Past, present and future perspectives on sexing sperm. Can J Anim Sci 2003; 83: 375-384.
- 7.
Johnston SD, Wats D, Lemon J et al.: Studies of male reproduction captive African Wild dogs (Lycaon pictus). Anim Reprod Sci 2007; 100: 338-355.
[PubMed] - 8.
Johston LA, Flook JP, Hawk HW: Sex preselection in rabbits: live births from X-and Y- separated by DNA and cell sorting. Biol Reprod 1989; 41:194-203.
- 9.
O´Brien JK, Stojanow T, Heffernan SJ et al.: Flow cytometric sorting of non-human primate sperm nuclei. Theriogenology 2005; 65: 246-259.
[PubMed] - 10.
Garner DL, Evans KM, Seidel GE: Sex-sorting sperm using flow cytometry/cell sorting. Methods in Molecular Biology 2013; 927: 279-295.
[PubMed] - 11.
Garner DL: Flow Cytometric sexing of mammalian sperm. Theriogenology 2006; 65: 943-957.
[PubMed] - 12.
Spinaci M, Merlo B, Zannoni A et al.: In vitro production of cat blastocysts of predetermined sex using flow cytometrically sorted semen. Theriogenology 2007; 67: 872-877.
[PubMed] - 13.
Pope CE, Crichton EG, Gómez MC, Dumas C, Dresser BL: Birth of domestic cat kittens of predetermined sex after transfer of embryos produced by in vitro fertilization of oocytes with flow-sorted sperm. Theriogenology 2009; 71: 864-871.
[PubMed] - 14.
O´Brien JK and Robeck TR: Development of sperm sexing and associated assisted reproductive technology for sex pre-selection of captive bottlenose dolphins (Tursiops truncates). Reprod Fertil Dev 2006; 18: 319-339.
[PubMed] - 15.
Morton KM, Rückholdt M, Evans G, Maxwell WMC: Quantification of the DNA difference, and separation of X- and Y-bearing sperm in alpacas (Vicugna pacos). Reprod Dom Anim 2008; 43: 638-642.
[PubMed] - 16.
Hermes R, Behr B, Hildebrandt TB et al.: Sperm sex-sorting in the Asian elephant (Elephas maximus). Anim Reprod Sci 2009; 112: 390-396.
[PubMed] - 17.
Lu Y, Zhang M, Lu S et al.: Sex-preselected buffalo (Bubalus bubalis) calves derived from artificial insemination with sexed sperm. Anim Reprod Sci 2010; 119: 169-171.
[PubMed] - 18.
Behr B, Rath D, Mueller P et al.: Feasibility of sex-sorting sperm from the white and the black rhinoceros (Ceratotherium simum, Diceros Bicornis). Theriogenology 2009; 72: 353-364.
- 19.
Ródenas C, Lucas X, Tarantini T et al.: The effeccts of Hoechst 33342 staining and the male simple donor on the sorting efficiency of canine spermatozoa. Reprod Dom Anim 2014; 49: 115-121.
[PubMed] - 20.
Rota A, Milani C, Cabianca G, Martinin M: Comparison between glycerol and ethylene glycol for dog semen cryopreservation. Theriogenology 2006; 65:1848-1858.
[PubMed] - 21.
Martins-Bessa A, Rocha A, Mayenco-Aguirre A: Comparing ethylene glycol with glycerol for cyopreservation of canine semen in egg-yolk TRIS extender. Theriogenology 2006; 66:2047-2055.
- 22.
Santana M, Batista M, Alamo D et al.: Influence of cool storage before freezing on the quality of frozen-thawed semen samples in dogs. Reprod Dom Anim 2013; 48:165-170.
[PubMed] - 23.
Parrilla I, Vázquez JM, Roca J, Martínez EA: Significance of Animal Variability during Flow cytometrical Porcine Sperm Sorting. Reprod Dom Anim 2005; 40:42.
- 24.
Clulow JR, Evans G, Morris LHA, Maxwell WMC: Factors influencing the “sortability” of stallion spermatozoa into X-and Y-chromosome bearing populations. Anim Reprod Sci 2009; 113: 220-228.
[PubMed] - 25.
Garner DL, Gledhill BL, Pinkel D, et al.: Quantification of the X-and Y-chromosome bearing spermatozoa of domestic animals by flow cytometry. Biol Reprod 1983; 28: 312-321.
[PubMed] - 26.
Sharpe JC and Evans KM: Advances in flow cytometriy for sperm sexing. Theriogenology 2009; 71: 4-10.
[PubMed] - 27.
Rota A, Milani C, Romagnoli S, Zucchini P, Mollos A: Pregnancy and conception rate after two intravaginal inseminations with dog semen frozen either with 5% glicerol or 5% ethylene glicol. Anim Reprod Sci 2010; 118: 94-97.
[PubMed] - 28.
Merlo B, Zambelli D, Cunto M, Iacono E: Sex-sorted canine sperm cryopreservation: Limits and procedural considerations. Theriogenology 2015 83; 1121-1127.
[PubMed] - 29.
Yun-Fang W, Fang-Liang C, Shu-Sheng T et al.: Birth of puppies of predetermined sex after artificial insemination with a low number of sex-sorted, frozen– thawed spermatozoa in field conditions. J Anim Sci, 2017; 88: 1232-1238.
[PubMed] - 30.
Peña A, Linde-Forsberg C: Effects of Equex, one- or two step dilution, and two freezing and thawing rates on post-thaw survival of dog spermatozoa. Theriogenology, 2000; 54:859-875.
[PubMed] - 31.
Payan-Carreira R, Miranda S, Nizanski W: Artificial insemination in dogs. En: Manafi M, editor. Artificial insemination in farm animals, 2011; p 51-58.