Enfermedades metabólicas, de depósito, nutricionales, de manejo, neoplásicas y del desarrollo de anfibios en cautividad: estudio retrospectivo de 131 pacientes
Metabolic, deposition, nutritional, management-related, neoplastic and developmental diseases of captive amphibians: a retrospective study of 131 patients
C. Juan-Sallés, V. Almagro, L. Carbonell, X. Valls, A. Montesinos, H. Fernández-Bellon
Contacto: noahspath.cjuansalles@gmail.com
Resumen
En esta segunda parte del estudio retrospectivo que evalúa las causas de morbilidad y mortalidad en 131 anfibios remitidos para estudio histopatológico, se incluyen las enfermedades metabólicas, de depósito, nutricionales, de manejo, neoplásicas y del desarrollo. Destacan la mineralización de tejidos blandos (19/131; 14,5%), incluidos 2 casos de calcinosis circunscrita y 17 de mineralización asociada a enfermedades subyacentes; enfermedad ósea metabólica (17/131; 13%); prolapso cloacal y/o rectal (11/131; 8,4%); neoplasias diversas en 6 anfibios (6/131; 4,6%), 2 de los cuales estaban afectados por 2 neoplasias diferentes cada uno; y la colelitiasis (4/131; 3,1%). Nueve de los 11 anfibios con prolapso cloacal y/o rectal, así como los 4 casos de colelitiasis procedían de una misma colonia de sapillos baleares (Alytes muletensis). Fue notoria la ausencia casi completa de malformaciones (solo un caso de amelia de extremidades anteriores) y la presentación de enfermedades raras no descritas previamente como el prolapso gástrico a través de la cavidad oral. En cuanto a enfermedades de potencial causa nutricional y/o tóxica, cabe mencionar adicionalmente dos casos de bocio y uno de metaplasia escamosa por probable deficiencia de vitamina A en ranas flecha azul (Dendrobates azureus) alimentadas con grillos no suplementados.
Palabras clave: Alytes muletensis, Anura, Caudata, colelitiasis, Dendrobatidae, enfermedad ósea metabólica, mineralización de tejidos blandos, prolapso gástrico, prolapso proctocloacal.
Clin Vet Peq Anim 2021, 41 (3): 163-174
Summary
Included in this second part of the study evaluating the causes of morbidity and mortality in 131 amphibians submitted for histopathologic diagnosis are metabolic, deposition, nutritional, management-related, and neoplastic diseases, as well as malformations. Salient disease processes include soft tissue mineralization (19/131; 14.5%) with 2 cases corresponding to calcinosis circumscripta and 17 to mineralization associated with underlying conditions; metabolic bone disease (17/131; 13%); cloacal and/or rectal prolapse (11/131; 8.4%); diverse neoplasms (6/131; 4.6%), with 2 different neoplasms in 2 amphibians; and cholelithiasis (4/131; 3.1%). Nine of 11 amphibians with cloacal and/or rectal prolapse and the 4 cases of cholelithiasis involved Mallorcan midwife toads (Alytes muletensis) from the same facility. The almost complete absence of malformations (only one case of forelimb amelia) and presentation of rare diseases previously non-reported such as gastric prolapse through the oral cavity were notorious. Among diseases of potential nutritional and/or toxic cause, two cases of goiter and one of squamous metaplasia probably due to vitamin A deficiency in blue poison arrow frogs (Dendrobates azureus) fed unsupplemented crickets are noteworthy.
Keywords: Alytes muletensis, Anura, Caudata, cholelithiasis, Dendrobatidae, metabolic bone disease, soft tissue mineralization, gastric prolapse, proctocloacal prolapse.
Clin Vet Peq Anim 2021, 41 (3): 163-174

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
Tras la descripción de las principales enfermedades infecciosas y parasitarias en 131 anfibios remitidos para diagnóstico histopatológico,1 en esta segunda parte de este estudio retrospectivo se evalúan las principales causas de morbilidad y mortalidad por enfermedades metabólicas, de depósito, nutricionales, de manejo, neoplásicas y del desarrollo.
Materiales y métodos
En la sección previa de este estudio retrospectivo1 se describen los materiales y métodos utilizados, incluida la lista de especies, órdenes de anfibios y número de individuos por especie (117 pacientes pertenecían al Orden Anura y 14 al Orden Caudata). Para esta segunda parte de este estudio, se filtraron los archivos para casos de enfermedades metabólicas, de depósito, nutricionales, de manejo, neoplásicas y del desarrollo. Los anfibios remitidos enteros en formol (113 de los 127 pacientes remitidos para su evaluación post mortem) fueron descalcificados sumergiéndolos en soluciones comerciales (Surgipath Decalcifier II, Leica Biosystems, EE.UU.; Descalcificador Rápido Casa Álvarez, Casa Álvarez, España). Previamente, se aplicaba fuerza sobre la diáfisis de los huesos largos de las extremidades posteriores hasta fracturarlos, con el fin de determinar la existencia de evidencias macroscópicas de enfermedad ósea metabólica (disminución en la dureza de los huesos). Se finalizaba la inmersión en el descalcificador en el momento en el cual el cuerpo podía ser cortado sin crepitación de las cuchillas de tallado. En pacientes escasamente calcificados, se realizaban primero los cortes seriados del cuerpo y luego los casetes de tejidos se sumergían en el descalcificador por lo general de 30 minutos a 1 hora. No se consideró necesario realizar tinciones especiales para ninguna de las enfermedades incluidas en esta sección.
Resultados
En la Tabla 1 se detallan los principales procesos de enfermedad metabólica, de depósito, nutricional, de manejo, neoplásica y del desarrollo diagnosticados en estos 131 anfibios. Todos estos afectaron únicamente a anfibios del Orden Anura, con excepción de 2 pacientes pertenecientes al Orden Caudata: un axolote (Ambystoma mexicanum) con mineralización renal tubular y un tritón de vientre de fuego japonés (Cynops pyrrhogaster) con melanosis hepática excesiva. Las enfermedades más frecuentes fueron la mineralización de tejidos blandos, enfermedad ósea metabólica y prolapso proctocloacal.
Nota: algunos pacientes estaban afectados por dos o más de estos procesos
En 19 de los 131 anfibios (14,5%) se observó mineralización de tejidos blandos, que afectó generalmente al epitelio renal tubular, a los túbulos seminíferos del testículo (Fig. 1), a la piel y/o a los pulmones. Ocasionalmente, los depósitos de mineral en tejidos blandos estaban rodeados por células gigantes multinucleadas. Diecisiete de estos 19 anfibios padecían enfermedad renal, inflamación granulomatosa frecuentemente sistémica, cuadros catabólicos y/o procesos de enfermedad que pudieron causar deshidratación (como la enteritis por estrongiloidiasis) o mineralización por otros mecanismos (como producción de sustancias con actividad parathormona en el caso de linfoma). En 2 de los 19 anfibios, la mineralización correspondía a calcinosis circunscrita subcutánea asociada a cestodos enquistados (ver Fig. 10A del artículo “Enfermedades infecciosas y parasitarias en anfibios en cautividad: estudio retrospectivo de 131 pacientes”1). Uno de los anfibios, una rana toro (Pyxicephalus adspersus) que murió por una gastroenteritis fibrinonecrotizante-enfisematosa y hemorrágica bacteriana aguda, fue remitido con historial de lesiones de depósito mineral alrededor de las vértebras (Fig. 2); sin embargo, este hallazgo correspondía a depósitos de calcio en los sacos endolinfáticos en anfibios, considerados normales por lo menos hasta un cierto grado no establecido de forma específica.2 La ausencia de mineralización metastática de tejidos blandos en esta rana sugiere que toleró este grado de almacenaje de calcio sin consecuencias clínicas obvias.
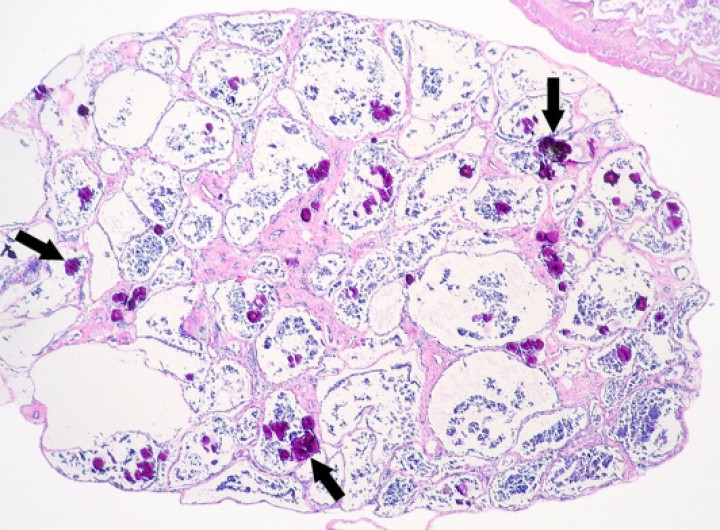
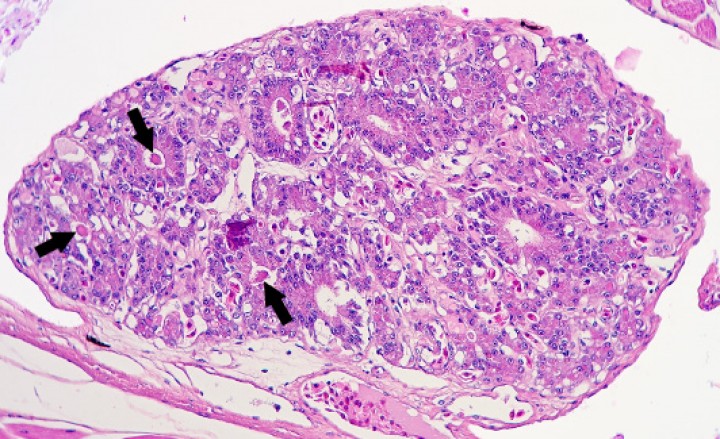
Figura 1
Testículo; rana tomate (Dyscophus guineti). Numerosos túbulos seminíferos contienen depósitos de mineral (flechas). Hematoxilina-eosina, x44.
Figura 2
Columna vertebral; rana toro africana (Pyxicephalus adspersus). Presencia de depósitos blanquecinos de calcio normales (flechas) en los senos endolinfáticos paravertebrales. Espécimen fijado en formol.
Diecisiete de los 131 (13%) anfibios, incluidos 9 sapillos baleares (Alytes muletensis), mostraron evidencias radiológicas (Fig. 3), macroscópicas y/o histológicas (Fig. 4) de enfermedad ósea metabólica (EOM), incluida una disminución del grado de mineralización de los huesos con aumento de su flexibilidad, así como presencia de deformaciones óseas, focos de metaplasia condroide generalmente a nivel perióstico y en las corticales de huesos largos con extensión ocasional a las trabéculas del hueso esponjoso, retención del cartílago metafisario, y/o fracturas patológicas. De estos 17 pacientes con EOM, 5 (incluidos 4 sapillos baleares [Alytes muletensis]) se presentaron con prolapso cloacal/rectal concurrente sin evidencias de estrongiloidiasis entérica. Algunos de los sapillos baleares (Alytes muletensis) con EOM fueron evaluados radiológicamente y mostraban deformación de huesos largos, particularmente de las extremidades posteriores, con irregularidad del contorno de las corticales y proliferación de tejido moderadamente radiodenso a nivel perióstico e intraóseo medular (Fig. 3).
Figura 3
Radiografía dorsoventral; sapillo balear (Alytes muletensis). Se observa enfermedad ósea metabólica avanzada, con arqueamiento de huesos largos, que muestran unas corticales primarias irregulares, proliferación de tejido radiodenso y radiolúcido a nivel perióstico y en la cavidad medular de los huesos afectados; estas alteraciones radiológicas son particularmente obvias en las extremidades posteriores.
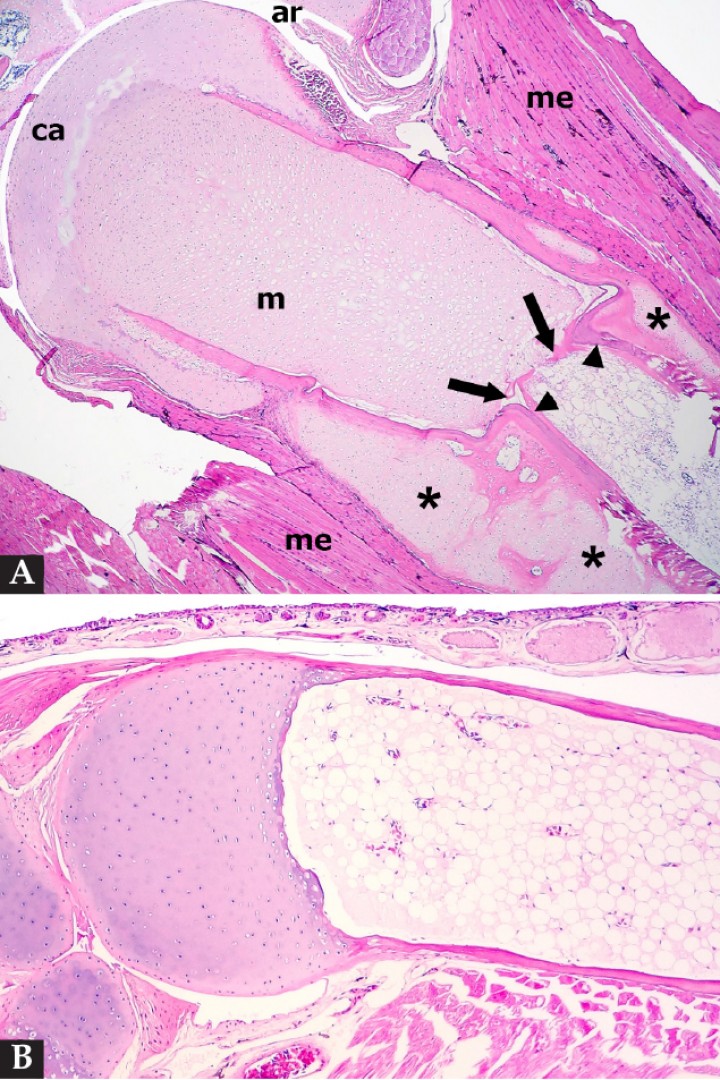
Figura 4
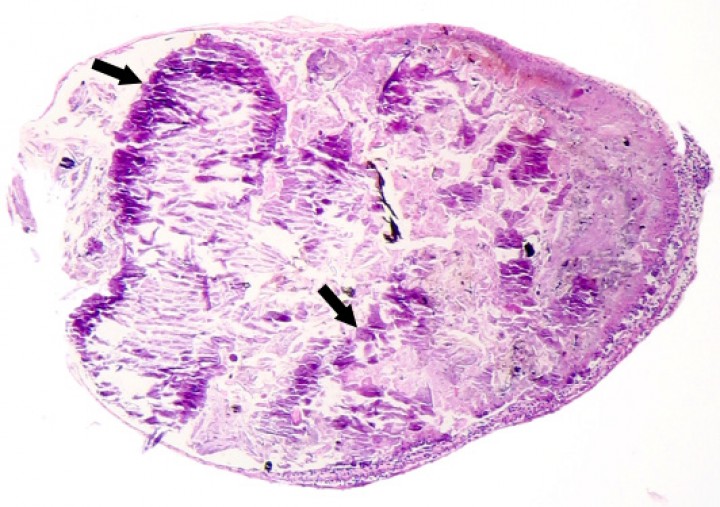
(A) Hueso largo; sapito minero (Dendrobates leucomelas). Se observa retención del cartílago metafisario (m) que se extiende excesivamente hacia la diáfisis del hueso con formación de amplios focos de metaplasia condroide de la corteza primaria (asteriscos), la cual muestra una zona de estrangulamiento (cabezas de flecha) justo caudal al cartílago retenido de la metáfisis con formación de una espícula transversal delgada de hueso a ese nivel (flechas). ca: cartílago articular (epífisis proximal); ar: articulación; m: metáfisis; me: músculo esquelético. Hematoxilina-eosina, x40. (B) Hueso largo; sapillo balear (Alytes muletensis). Hueso normal para comparación. Hematoxilina-eosina, x120.
En total, 11 de los 131 (8,4%) anfibios sufrieron prolapso cloacal/rectal, incluidos 9 sapillos baleares (Alytes muletensis) de la misma colonia, 5 de los cuales mostraban estrongiloidiasis (ver Fig. 7A del artículo “Enfermedades infecciosas y parasitarias en anfibios en cautividad: estudio retrospectivo de 131 pacientes”1). Cuatro de los 11 anfibios con prolapso padecían enfermedad ósea metabólica sin evidencias de estrongiloidiasis. En 9 de los 11 casos de prolapso, incluidos 8 de los 9 sapillos baleares (Alytes muletensis), se apreció inflamación en la mucosa rectal o cloacal con erosión, necrosis y/o hemorragia de la mucosa del segmento prolapsado. En 2 anfibios pudo constatarse la existencia de intususcepción intestinal concurrente, que se asociaba a estrongiloidiasis en uno de los pacientes.
Otros procesos relevantes de enfermedad digestiva que causaron la muerte o contribuyeron a la misma en los anfibios afectados incluyen la ingestión de cuerpos extraños (corteza de coco usado como sustrato) en el estómago de dos ranas tomate (Dyscophus guineti) del mismo centro que desarrollaron un cuadro catabólico; dicho material se consideró causante de un cuadro de impactación gástrica en una de ellas. Se diagnosticó también un caso de impactación intestinal por arena en un renacuajo de sapillo de vientre de fuego oriental (Bombina orientalis) (Figs. 5 y 6). Finalmente, una rana de punta de flecha roja (Oophaga pumilio) mostró una masa oral que protruía a través de la cavidad oral (Fig. 7) y que histológicamente correspondía al estómago, el cual había sufrido dilatación y prolapso; su mucosa mostraba necrosis y hemorragia con bacterias intralesionales.
Figura 5
Sapillo de vientre de fuego oriental (Bombina orientalis). Se observa dilatación prominente de la cavidad celómica (debida a impactación intestinal por arena). Barra: 1 cm.
Figura 6
Sapillo de vientre de fuego oriental (Bombina orientalis). Sección de intestino marcadamente dilatado por la presencia de abundantes concreciones minerales (flechas) interpretadas como arena. Hematoxilina-eosina, x44.
Figura 7
Rana de punta de flecha roja (Oophaga pumilio). (A) Vista dorsal. (B) Vista lateral. Se observa prolapso del estómago dilatado a través de la cavidad oral. Barra: 1 cm.
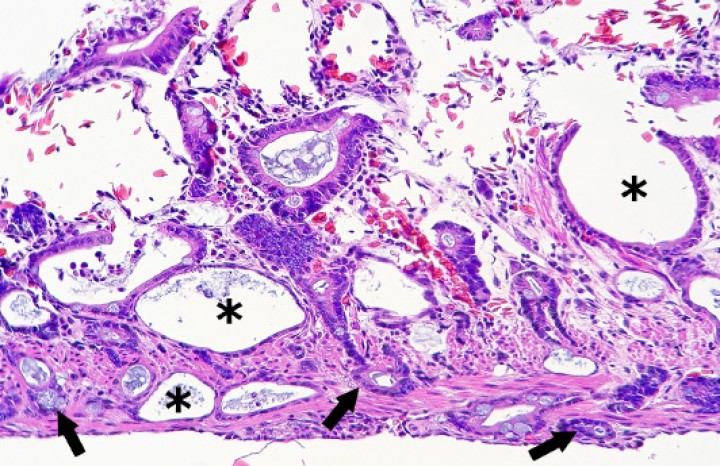
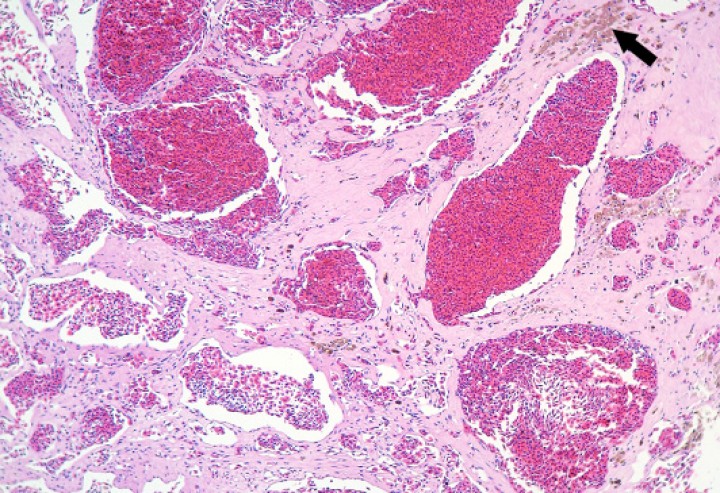
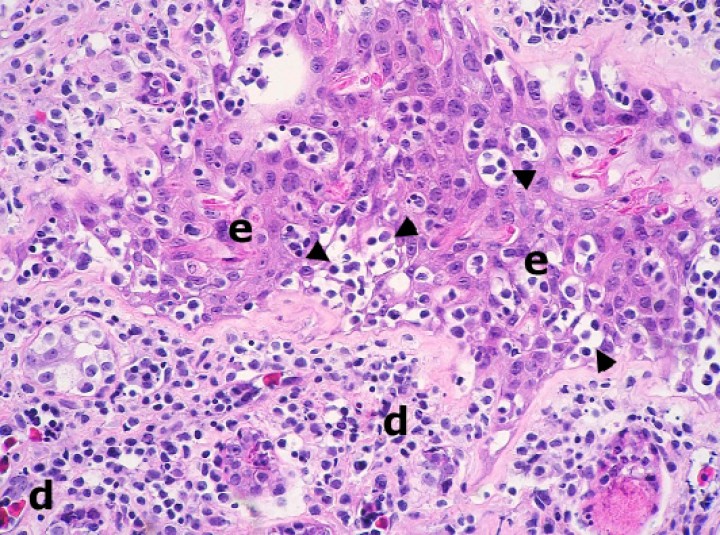
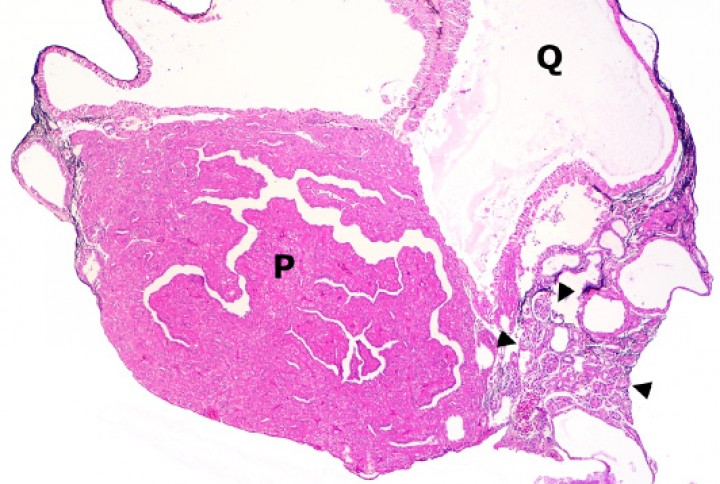
Se observaron 8 neoplasias, diagnosticadas en 6 de los 131 (4,6%) anfibios. Dos correspondían a adenocarcinomas sin evidencias de metástasis: uno intestinal en una rana dardo verdinegra (Dendrobates auratus) (Fig. 8), y otro en un tejido no identificable en un sapo buey (Rhinella schneideri); este último mostraba, además, hemangiomas en el pulmón (Fig. 9). El adenocarcinoma intestinal de la rana dardo verdinegra (Dendrobates auratus) consistía en una proliferación mal delimitada y no encapsulada de enterocitos que formaban criptas y glándulas variablemente dilatadas o, raramente, nidos diminutos compactos que invadían de forma amplia todas las capas del segmento intestinal afectado (Fig. 8) y mostraban anisocitosis, anisocariosis, pleomorfismo y anaplasia bajos a moderados, sin actividad mitótica aparente. Otros 3 anfibios padecieron neoplasias hematopoyéticas: un linfoma multicéntrico con componente epiteliotrópico en una rana tomate (Fig. 10) y dos neoplasias de células redondas no identificables de forma clara mediante la tinción rutinaria en un sapillo balear (Alytes muletensis) y un axolote (Ambystoma mexicanum). Otro sapillo balear (Alytes muletensis) mostraba una proliferación multicéntrica benigna de epitelio renal tubular (Fig. 11) organizado en estructuras tubulares, papilares y quísticas (Fig. 12), compatible con adenomatosis renal (adenomas múltiples); se observó atipia celular en escasas células neoplásicas y en células epiteliales de túbulos no neoplásicos. Adicionalmente, en este sapillo balear (Alytes muletensis) se apreció un foco hepático bien delimitado y no encapsulado de proliferación de hepatocitos compatible con hiperplasia nodular o un hepatoma; la ausencia de tríadas portales dentro de esta neoplasia es compatible con un hepatoma (Fig. 13).
Figura 8
Intestino delgado; rana dardo verdinegra (Dendrobates auratus). Proliferación neoplásica de epitelio entérico, que invade todas las capas (flechas) y forma estructuras glandulares variablemente dilatadas (asteriscos). Hematoxilina-eosina, x240.
Figura 9
Pulmón; sapo buey (Rhinella schneideri). Se aprecia una proliferación neoplásica de cavernas vasculares revestidas por endotelio bien diferenciado (hemangioma) con focos de hemosiderosis (flecha) en el estroma de soporte de la neoplasia. Hematoxilina-eosina, x110.
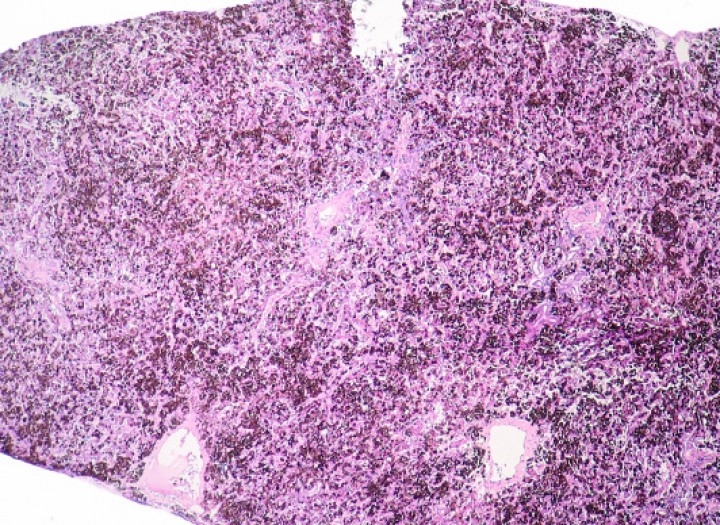
Figura 10
Piel; rana tomate (Dyscophus guineti). Con patrón difuso, la dermis (d) está densamente infiltrada por linfocitos pequeños neoplásicos acompañados por detritos nucleares; estos infiltrados forman además numerosos focos de epiteliotropismo caracterizados por la presencia de múltiples linfocitos dispuestos en pequeños nidos intraepidérmicos (cabezas de flecha). e: epidermis. Hematoxilina-eosina, x220.
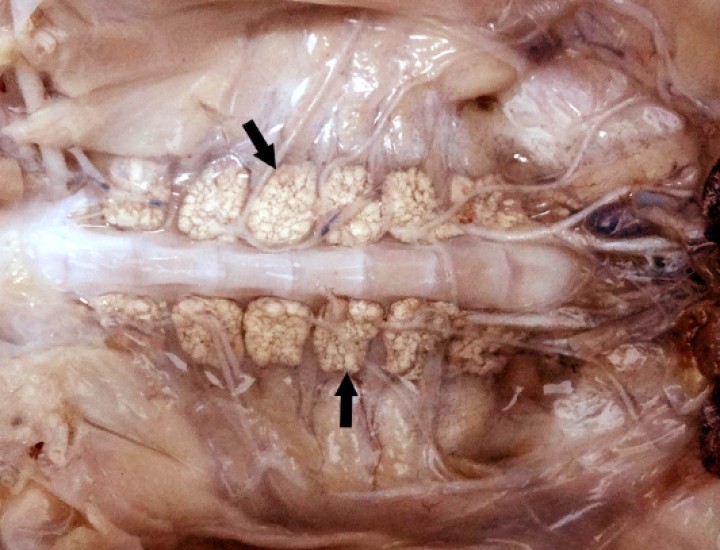
Figura 11
Sapillo balear (Alytes muletensis). Los riñones contienen masas amarillentas-blanquecinas correspondientes a adenomatosis renal (flechas). Paciente fijado en formol. Barra: 1 cm.
Figura 12
Riñón; sapillo balear (Alytes muletensis). La sección de riñón del sapillo en la Figura 11 está casi completamente reemplazada por un adenoma con zonas papilares densas (P) y zonas quísticas (Q), que comprime el tejido renal no neoplásico restante (cabezas de flecha). Hematoxilina-eosina, x48.
Figura 13
Hígado; sapillo balear (Alytes muletensis). Imagen histológica de un hepatoma, en la que se observa proliferación neoplásica uniforme de hepatocitos bien diferenciados y ausencia de áreas porta. Hematoxilina-eosina, x120.
Cuatro anfibios (4/131; 3,1%) mostraron edema subcutáneo, que fue generalizado (anasarca) en 3 de ellos. En una rana toro (Lithobates catesbeianus), dicho edema se asociaba a micobacteriosis sistémica y cestodiasis subcutánea (Fig. 14), mientras que en un sapillo balear (Alytes muletensis) estaba asociado a estrongiloidiasis intestinal, y en un escuerzo de Cranwell (Ceratophrys cranwelli), a una dermatitis vírica. En el anfibio restante no se apreciaron evidencias de la causa o procesos potencialmente relacionados.
Figura 14
Rana toro (Lithobates cathesbeianus). Se aprecia anasarca (edema subcutáneo generalizado) intensa y zonas lineares de ulceración cutánea grave (cabezas de flecha) en la región inguinal.
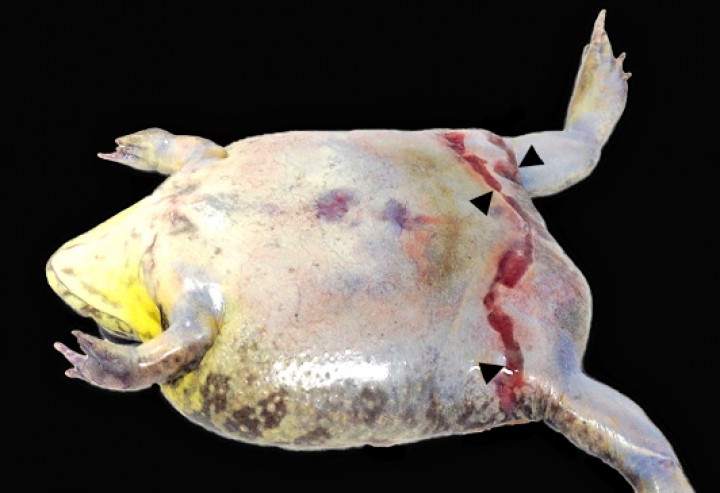
Se diagnosticó colelitiasis en la vesícula biliar de 4 sapillos baleares (Alytes muletensis) (4/131; 3,1%), con cálculos de hasta unos 6 mm de diámetro y sin evidencias de enfermedad obstructiva de vías biliares con excepción de un paciente. En este, la colelitiasis se acompañó de distensión prominente de la cavidad celómica (Fig. 15) debida a dilatación marcada de la vesícula biliar (Fig. 16) y de los conductos biliares intrahepáticos, con ruptura de la vesícula biliar y embolismo de bilis en el seno linfático subcutáneo, así como colangiohepatitis bacteriana ascendente de vías biliares secundaria a la presumible enfermedad biliar obstructiva. La bilis embolizada en el seno linfático, que contenía abundantes bacterias, causó engrosamiento de los tejidos blandos de la extremidad posterior izquierda (Fig. 15), donde se acompañó de necrosis muscular y cutánea (Fig. 17).
Figura 15
Sapillo balear (Alytes muletensis). Muestra dilatación prominente de la cavidad celómica y engrosamiento de los tejidos blandos de las extremidades posteriores, particularmente la izquierda; a nivel tibial diafisario se distingue una zona elevada oscura (correspondiente histológicamente a necrosis muscular y cutánea asociada a embolismo de bilis en el seno subcutáneo) (cabeza de flecha). Barra: 1 cm.
Figura 16
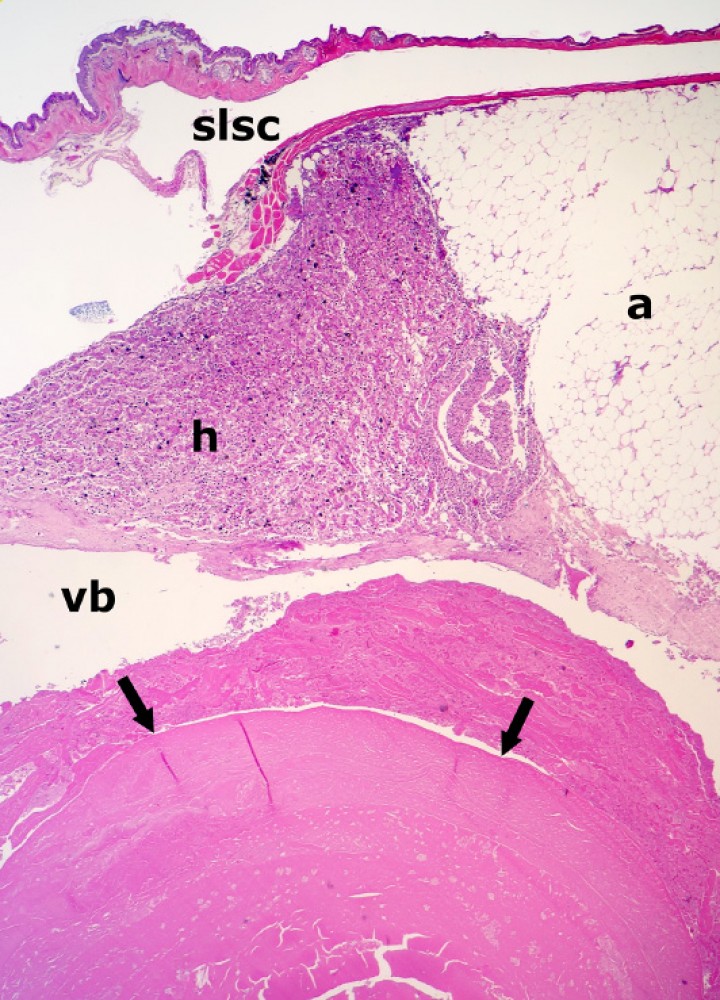
Sapillo balear (Alytes muletensis). Se observa un colelito (cabezas de flecha) rodeado por secreción biliar condensada en la luz de la vesícula biliar (vb), la cual está distendida. El tejido adiposo (a) es marcadamente excesivo. slsc: seno linfático subcutáneo, h: hígado. Hematoxilina-eosina, x48.
Figura 17
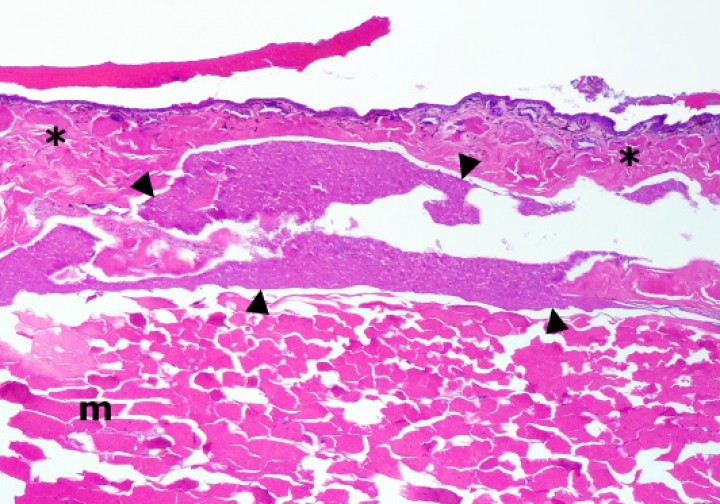
Extremidad posterior; sapillo balear (Alytes muletensis). El seno linfático subcutáneo (delimitado con cabezas de flecha) está dilatado por abundante secreción biliar (con bacterias), lo cual se acompaña de necrosis de la dermis (asteriscos) y del músculo subyacente (m); con frecuencia, las fibras musculares necróticas están fragmentadas. Hematoxilina-eosina, x48.
En cuanto a la condición corporal de los anfibios incluidos en este estudio, 15 de ellos (11,5%) padecían cuadros catabólicos de forma evidente, ya que mostraban atrofia del tejido adiposo (Fig. 18); en 4 de estos se apreció también atrofia hepatocelular. En contraposición, el tejido adiposo era excesivo en 5 anfibios (Fig. 19) y en 3 de ellos se observó infiltración de diversos órganos, particularmente el esófago, orofaringe y tejido subcutáneo, por grandes agregados de adipocitos hipertróficos (Fig. 20); 2 de estos pacientes eran la rana de punta de flecha roja (Oophaga pumilio) con dilatación y prolapso gástricos, y el sapillo balear (Alytes muletensis) con colelitiasis obstructiva y ruptura de la vesícula biliar.
Figura 17
Extremidad posterior; sapillo balear (Alytes muletensis). El seno linfático subcutáneo (delimitado con cabezas de flecha) está dilatado por abundante secreción biliar (con bacterias), lo cual se acompaña de necrosis de la dermis (asteriscos) y del músculo subyacente (m); con frecuencia, las fibras musculares necróticas están fragmentadas. Hematoxilina-eosina, x48.
Figura 18
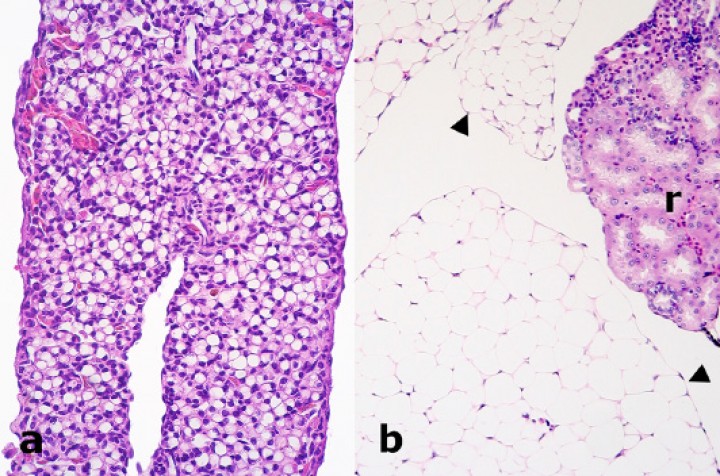
Tejido adiposo; (a) rana dardo verdinegra (Dendrobates auratus), (b) sapillo de vientre de fuego oriental (Bombina orientalis). Se observa atrofia prominente de los adipocitos (a) en comparación con un tejido adiposo no atrófico (cabezas de flecha) (b). r: riñón. Hematoxilina-eosina, x220.
Figura 19
Ranas flecha azul (Dendrobates azureus). El paciente de la izquierda muestra obesidad (particularmente visible en la región submandibular) en comparación con la rana de la derecha. Barra: 1 cm.
Figura 20
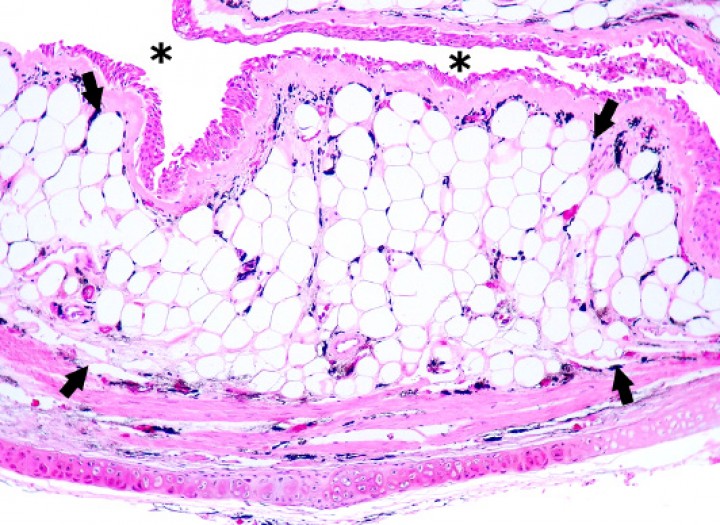
Rana flecha azul (Dendrobates azureus), paciente de la izquierda de la Figura 19. La mucosa del esófago está engrosada debido a la presencia de abundantes adipocitos bien diferenciados e hipertróficos (flechas), que causa una reducción en el diámetro de la luz (asteriscos). Hematoxilina-eosina, x120.
Otros procesos de enfermedad relevantes incluían bocio en 2 anfibios, el cual era hiperplásico difuso en una rana tomate (Fig. 21) y coloidal en un sapillo balear (Alytes muletensis) (Fig. 22) de un mismo centro. Una rana flecha azul (Dendrobates azureus), procedente de un brote de mortalidad con dermatitis fúngica, mostró metaplasia escamosa intensa del epitelio esofágico y también orofaríngeo (Fig. 23); estas ranas habían sido alimentadas exclusivamente con grillos juveniles sin ningún tipo de suplemento vitamínico ni mineral. Igualmente, se diagnosticó microlitiasis de glándulas linguales en 2 ranas tomate.
Figura 21
Tiroides; rana tomate (Dyscophus guineti). Con patrón difuso, los folículos carecen casi completamente de coloide (las flechas indican el coloide escaso restante) y están revestidos por epitelio cilíndrico alto (bocio hiperplásico). Hematoxilina-eosina, x240.
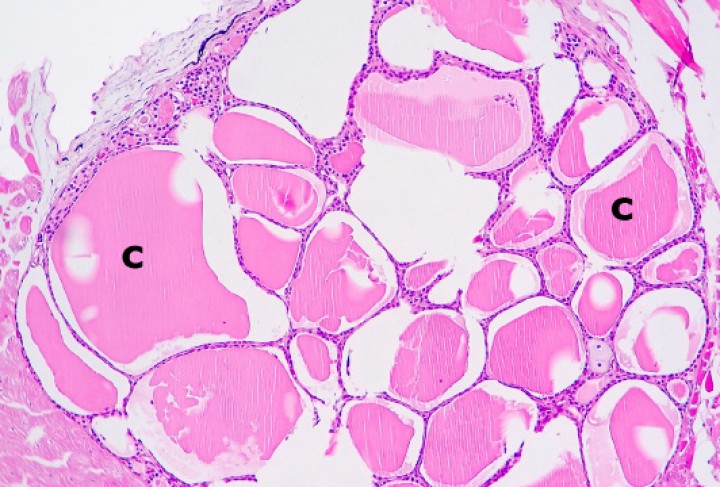
Figura 22
Tiroides; sapillo balear (Alytes muletensis). Los folículos tiroideos están dilatados por excesivo coloide (c) y revestidos por un epitelio simple plano (bocio coloidal). Hematoxilina-eosina, x120.
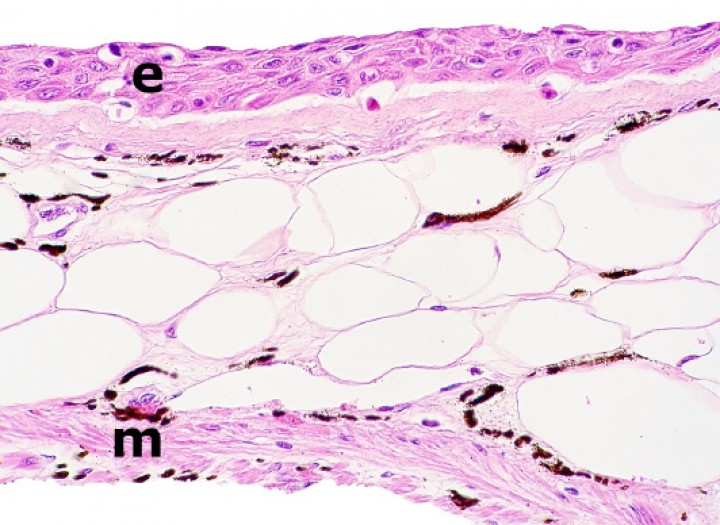
Figura 23
Rana flecha azul (Dendrobates azureus). El epitelio (e) que reviste la mucosa del esófago es estratificado escamoso (es decir, ha sufrido metaplasia escamosa, ya que de forma normal es un epitelio simple ciliado). m: capas musculares. Hematoxilina-eosina, x480.
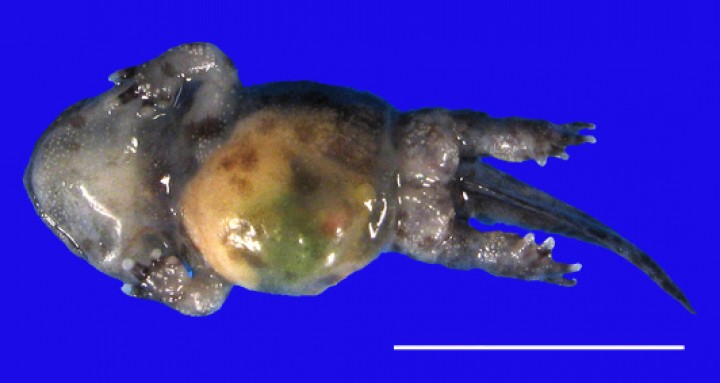
Es notoria la escasez de casos de malformaciones. Sólo se observó amelia de extremidades anteriores en un sapillo balear (Alytes muletensis) (Fig. 24).
Figura 24
Sapillo balear (Alytes muletensis). Se aprecia ausencia de ambas extremidades anteriores (amelia). Barra: 1 cm.
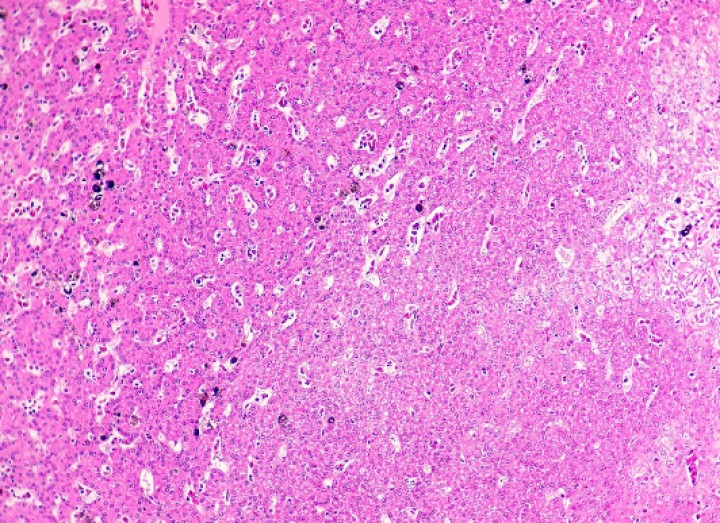
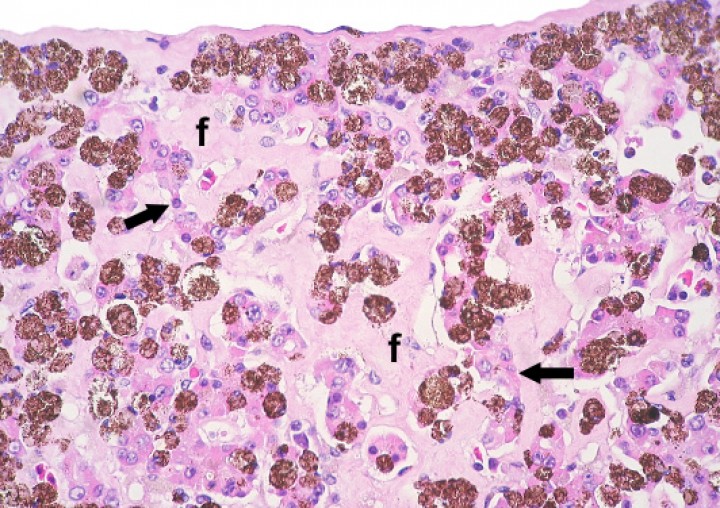
La mayoría de anfibios mostraban grados variables de melanización de diversos órganos, particularmente el hígado (Fig. 25). La cantidad y el tamaño de centros melanomacrofágicos en el hígado se consideraron excesivos en algunos pacientes y llegaron a remplazar casi completamente el parénquima hepático en casos esporádicos (Fig. 26). En uno de estos, una rana tomate, este proceso se acompañó de fibrosis portal leve (Fig. 27) e hiperplasia biliar.
Figura 25
Hígado y ovario; rana toro africana (Pyxicephalus adspersus). Tanto el hígado (izquierda) como el ovario (derecha) muestran melanización intensa. Algunos folículos ováricos son blancos (no melanizados). Barra: 1 cm.
Figura 26
Hígado; rana tomate (Dyscophus guineti). Se aprecia melanosis difusa intensa (correspondiente al pigmento oscuro depositado de forma uniforme y en cantidad alta en todo el parénquima). Hematoxilina-eosina, x44.
Figura 27
Hígado; rana tomate (Dyscophus guineti). El tejido hepatocelular está parcialmente reemplazado por melanomacrófagos y fibrosis (f); los cordones de hepatocitos con frecuencia están atróficos (flechas) y también contienen melanina. Hematoxilina-eosina, x440.
Discusión
Entre las enfermedades metabólicas, de depósito, nutricionales, de manejo, neoplásicas y del desarrollo, objeto de esta segunda parte de este estudio retrospectivo, destacaron la mineralización de tejidos blandos y la enfermedad ósea nutricional/metabólica. Fue notoria la baja incidencia de neoplasias y la presencia de un único caso de malformación (amelia en un sapillo balear (Alytes muletensis)), así como la ausencia de casos de xantomatosis, enfermedad de depósito de cristales de colesterol de probable origen o influencia nutricional que en anfibios afecta principalmente a la córnea (“queratopatía lipídica”, “lipidosis corneal”) y que es considerada frecuente en anfibios anuros en cautividad en Norteamérica;2 es posible que existieran diferencias en la dieta y manejo de los anuros incluidos en este estudio que hayan influido en la ausencia de casos de xantomatosis.
En cuanto a la mineralización de tejidos blandos, se observó habitualmente en anfibios con enfermedades renales o sistémicas, inflamación granulomatosa y/o cuadros catabólicos que pudieron causar alteraciones en la relación calcio:fósforo; la excepción fueron dos casos de mineralización nodular localizada (calcinosis circunscrita) asociada a cestodiasis subcutánea. Existe una descripción de esta forma de mineralización nodular en renacuajos de rana toro (Lithobates catesbeianus) que vivían cerca de una planta de tratamiento de aguas residuales y que mostraban niveles altos de colecalciferol, posiblemente debidos a exposición a disruptores endocrinos o plantas calcinógenas.3 Sin embargo, no se han encontrado referencias de calcinosis circunscrita asociada a parásitos en anfibios.
Por lo que respecta a la enfermedad ósea metabólica, en algunos de los anfibios se diagnosticó en base a la disminución del grado de mineralización y excesiva flexibilidad detectadas durante el procesado de los órganos, pero en el resto el diagnóstico se basó en la histopatología y, en algunos sapillos baleares (Alytes muletensis), también en el estudio radiológico. Una característica distintiva de la enfermedad ósea metabólica en anfibios consiste en la respuesta tisular en los huesos, que se caracteriza por metaplasia condroide en el periostio y en las corticales como lesión más notoria; en este sentido, la osteodistrofia fibrosa no se observa en anfibios con enfermedad ósea metabólica, a diferencia de mamíferos, aves y reptiles (excepto tortugas).
Otra enfermedad notoria por su frecuencia en este estudio, y particularmente por su presentación repetida en una colonia de sapillos baleares (Alytes muletensis), fue el prolapso cloacal/rectal. La estrongiloidiasis intestinal en 5 de los sapillos afectados se consideró la causa probable o contribuyente a su desarrollo. En otros 4 sapillos no se observó estrongiloidiasis, pero sí enfermedad ósea metabólica; si esta se debió a hipocalcemia, es posible que se acompañara de disfunción neuromuscular y se llegara a complicar con prolapso cloacal/rectal. También es posible que alguno de estos 4 sapillos padeciera estrongiloidiasis y que los nematodos no hubieran quedado representados en los planos de corte evaluados del intestino. El prolapso cloacal se ha descrito en ranas de vida libre en Australia, aunque no pudieron determinarse las causas.4
Por lo que respecta a las enfermedades neoplásicas, destaca su baja frecuencia en este estudio, con solo 6 de 131 anfibios afectados. De las neoplasias diagnosticadas, el linfoma es el más frecuentemente descrito en anfibios.5 En cuanto a los adenocarcinomas intestinales, se han documentado raramente en anfibios en la bibliografía,5,6 aunque existe un estudio reciente de la presentación de múltiples casos en una colonia de ranas lecheras amazónicas (Trachycephalus resinifictrix).7 En el presente estudio se observó un caso de adenomatosis renal y hepatoma en un sapillo balear (Alytes muletensis); los adenomas y adenomatosis renales no están descritos en la bibliografía de anfibios, a diferencia de los adenocarcinomas renales.5
La anasarca/edema subcutáneo, linfangiectasia subcutánea y/o hidroceloma, observada en 4 anfibios en este estudio, constituye una presentación clínica relevante en anfibios.8-10 Existen numerosas causas posibles de anasarca en anfibios, incluidas insuficiencia renal/nefropatías, enfermedades cardiovasculares (entre otras: cardiomiopatías, linfangitis subcutánea, insuficiencia de los corazones linfáticos, por ejemplo, por hipocalcemia o infección), enfermedades gastrointestinales, infecciones (incluidas septicemia, micobacteriosis e infección por iridovirus), hiposmolaridad del agua (uso de agua destilada o desionizada no reconstituida) y enfermedades cutáneas que interfieran con el equilibrio osmótico.2 En este caso, 3 de los 4 anfibios con anasarca padecían enfermedades (micobacteriosis, estrongiloidiasis, dermatitis) que pudieron contribuir a su desarrollo.
Un hallazgo relevante de este estudio para los programas de cría en cautividad del sapillo balear (Alytes muletensis) consiste en la presentación de 4 casos de colelitiasis; es posible que el pequeño tamaño de estos pacientes haya dificultado la detección de más casos, ya que las secciones seriadas de todo el cuerpo realizadas en los cadáveres pudieron dejar fuera del plano de corte colelitos pequeños o incluso a la misma vesícula biliar, en la cual se localizaron los colelitos en los sapillos baleares (Alytes muletensis) afectados. En uno de estos sapillos baleares (Alytes muletensis), esta enfermedad fue considerada la causa de la muerte, ya que cursó con evidencias de obstrucción y ruptura de vías biliares complicadas con colangiohepatitis bacteriana y embolismo de bilis hacia el seno linfático subcutáneo, que causó necrosis muscular y cutánea en la zona afectada. La etiopatogenia de la colelitiasis en estos sapillos baleares (Alytes muletensis) se desconoce, pero este último mostraba excesivo tejido adiposo y será necesaria una evaluación de la dieta ingerida por estos anfibios en colonias afectadas por tratarse de una fuente potencial de factores de riesgo de colelitiasis. Por ejemplo, la obesidad (o índices de masa corporal aumentados) e hipercolesterolemia/hipertrigliceridemia constituyen factores de riesgo de colelitiasis en pacientes humanos y en otras especies como la canina,11-14 aunque la edad,14 los factores genéticos (sobre todo genes codificadores de transportadores intestinal y hepático de colesterol),15 ciertos fármacos como la ceftriaxona16 y enfermedades subyacentes (como diabetes, hepatopatías o anemia hemolítica)11,14,16 pueden estar involucrados también.
En este estudio se diagnosticaron 2 casos de bocio (uno hiperplásico y otro coloidal), si bien se desconoce si existieron alteraciones en la función tiroidea de los anfibios afectados. Debido al pequeño tamaño de la mayoría de los pacientes incluidos en este estudio y a pesar de ser procesados habitualmente en cortes seriados, es posible que esta enfermedad tuviera una mayor incidencia, ya que en numerosos anfibios no apareció la tiroides en los cortes. El bocio adquirido, de incidencia muy superior al bocio hereditario en animales, puede deberse a déficit o exceso de yodo de origen dietario y/o a presencia de sustancias bociógenas en la dieta o agua; en anfibios, sustancias como nitratos, nitritos o amonio, entre otros, podrían ser bociógenos relevantes.
En dos anfibios se observaron impactaciones gástricas por material del sustrato del terrario, lo cual recalca la importancia del manejo para la prevención de ciertas enfermedades, como la ingestión de cuerpos extraños procedentes del sustrato. En cuanto al prolapso gástrico diagnosticado en una rana de punta de flecha roja (Oophaga pumilio), se ha descrito previamente en anfibios durante procedimientos anestésicos con aceite de clavo en ranas leopardo, con resolución espontánea,17 y en ranas flecha azul anestesiadas con alfaxalona/midazolam/dexmedetomidina o ketamina/midazolam/dexmedetomidina, en las cuales fue reducido sin complicaciones.18 En la rana afectada incluida en este estudio, sin embargo, el prolapso gástrico completo causó la muerte al complicarse con dilatación gástrica y necrosis de la mucosa gástrica e infección bacteriana secundaria. Dicho prolapso fue repentino y no precedido de anestesia u otras manipulaciones.
En un brote de mortalidad en una rana flecha azul (Dendrobates azureus) se diagnosticó metaplasia escamosa del epitelio orofaríngeo y esofágico (en condiciones normales, su epitelio es columnar ciliado y mucoso). Una de las causas principales de esta lesión consiste en deficiencia de vitamina A. A pesar de que los niveles de vitamina A (retinol hepático) no fueron determinados, su dieta estaba basada exclusivamente en grillos juveniles sin suplementación de vitaminas ni minerales, lo cual apoya un diagnóstico etiológico presuntivo de deficiencia de vitamina A. Si no son suplementados, los grillos y otros insectos comúnmente utilizados en la dieta de reptiles y anfibios pueden causar deficiencia de vitamina A.19-21 Se ha descrito metaplasia escamosa atribuida a hipovitaminosis A en diversas especies de anfibios con metaplasia escamosa del epitelio de las glándulas linguales y “short tongue syndrome”, particularmente el sapo de Wyoming (Anaxyrus [Bufo] baxteri), así como engrosamiento conjuntival y periocular con respuesta a suplementación con vitamina A en dendrobátidos, ránidos y una salamandra.22 Otros epitelios pueden afectarse, incluido el de glándulas cutáneas, esofágico, cloacal o urinario.2
Las malformaciones constituyen una causa de enfermedad importante en algunas poblaciones de anuros salvajes y con frecuencia reflejan exposición a sustancias teratógenas en el ambiente.23-25 En los 131 anfibios de este estudio retrospectivo solo se diagnosticó un caso de malformación (amelia de extremidades anteriores), lo cual sugiere que el manejo en cautividad previno la exposición a tóxicos teratógenos y a deficiencias o excesos nutricionales involucrados en la aparición de malformaciones en anfibios. La causa de este caso de amelia se desconoce. Se han descrito malformaciones de extremidades con frecuencia en ciertas poblaciones de anfibios salvajes, o reproducidas experimentalmente con agua procedente de lugares con existencia de malformaciones de extremidades en anfibios.23-25 En este sentido, algunos estudios26sugieren que los retinoides ambientales, como los producidos por sobrecrecimiento de cianofíceas,27 o tóxicos como herbicidas, que pueden interferir con la acción del ácido retinoico,28 juegan un papel en el desarrollo de malformaciones de extremidades en anfibios. Por otro lado, en un estudio se ha implicado a la vitamina A como causa de malformaciones en anfibios.29
Por lo que respecta a la melanosis, depósito de alta frecuencia en anfibios, pudo ser excesivo en algunos pacientes; el número y el tamaño de centros melanomacrofágicos aumentan en asociación con el envejecimiento o procesos que potencian la detoxificación de radicales libres. En algunos anfibios, la melanosis pudo llegar a causar disfunción hepática, ya que la casi totalidad del parénquima estaba reemplazado por centros melanomacrofágicos, pero no se dispone de estudios de patología clínica que apoyen esta posibilidad.
En conclusión, las enfermedades metabólicas, de depósito, nutricionales, de manejo, neoplásicas y del desarrollo observadas con mayor frecuencia en los 131 anfibios incluidos en este estudio retrospectivo fueron la mineralización de tejidos blandos, la enfermedad ósea nutricional/metabólica y el prolapso cloacal/rectal, mientras que se observaron escasas neoplasias y un único caso de malformación. Destaca también, por su presentación repetida en sapillos baleares (Alytes muletensis), la colelitiasis.
Agradecimientos
Los autores agradecen a las/los siguientes profesionales e instituciones por la contribución de casos a este estudio: Animales Exóticos 24h – Pablo Casar (Madrid), Biodomo Granada (Granada) – Laura Marcos Vicente (Granada), Bioparc Valencia (Valencia), Centro Veterinario La Marina Exóticos – Mireia Máinez (Elche), Centro Veterinario Los Sauces (Madrid), Clínica Exòtics (Barcelona), Clínica Veterinaria Gecko – Esther Carpintero (Vigo), Clínica Veterinaria Madagascar – Carlos Ouro (Madrid), Clínica Veterinaria Selvätica – José Villora (Valencia), Hospital Vets Avinguda – Xavier Riera (Sabadell), Palmitos Park – Ayose Melián (Gran Canaria) y Parc Zoològic de Barcelona (Barcelona). Igualmente, se agradece a Arturo Guimerà su colaboración en la búsqueda bibliográfica, a Synlab Pathology (Esplugues de Llobregat, Barcelona) la excelente asistencia con la histotecnología, y a Blanca Pérez de la UD Histologia i Anatomia Patològica (Facultat de Veterinària, Universistat Autònoma de Barcelona, Bellaterra) por la realización de tinciones especiales (Gram, Stamp, PAS).
Fuente de financiación: esta investigación no se realizó con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran que no existe conflicto de intereses en los datos publicados.
Bibliografía
- 1.
Juan-Sallés C, Almagro V, Carbonell L, Valls X, Montesinos A, Fernández Bellon H: Enfermedades infecciosas y parasitarias en anfibios en cautividad: estudio retrospectivo de 131 pacientes. Clín Vet Peq Anim 2020; 20(1):15-27.
[Clin Vet Peq Anim] - 2.
Pessier AP. Amphibia. En: Terio KA, McAloose D, St. Leger J, ed. Pathology of wildlife and zoo animals. London: Academic Press; 2018; 915-944.
- 3.
Keel MK, Ruiz AM, Fisk AT, et al. Soft-tissue mineralization of bullfrog larvae (Rana catesbeiana) at a wastewater treatment facility. J Vet Diagn Invest 2010; 22(4):655-660.
[PubMed] - 4.
Phillott AD, Young S. Occurrence of cloacal prolapse in wild hylids in the Wet Tropics, Australia. Dis Aquat Organ 2009; 86(1):77-80.
[PubMed] - 5.
Stacy BA, Parker JM. Amphibian oncology. Vet Clin Exot Anim 2004; 7(3):673-695.
[PubMed] - 6.
Vaughan RJ, Vitali SD, Payne KL, Eden PA. A splendid tree frog with edema syndrome and intestinal adenocarcinoma. Vet Clin North Am Exot Anim Pract 2006; 9(3):583-587.
[PubMed] - 7.
López J, Barbón AR, Smithyman J, et al. High prevalence of intestinal adenocarcinoma in a captive population of amazon milk frog (Trachycephalus resinifictrix). J Zoo Wildl Med 2016; 47(4):1061-1068.
[PubMed] - 8.
Clancy MM, Clayton LA, Hadfield CA. Hydrocoelom and lymphedema in dendrobatid frogs at National Aquarium, Baltimore: 2003-2011. J Zoo Wildl Med 2015; 46(1):18-26.
[PubMed] - 9.
Pessier AP. Edematous frogs, urinary tract disease, and disorders of fluid balance in amphibians. J Exot Pet Med 2009; 18(1):4-13.
- 10.
Vannevel JY. Glomerulonephritis and anasarca in a colony of frogs. Vet Clin North Am Exot Anim Pract 2006; 9(3):609-616.
[PubMed] - 11.
Ali S, Ahamad ST, Talpur AS, Parajuli S, Farooq J. Prevalence of non-insulin-dependent diabetes mellitus among patients with cholelithiasis: a single-centered, cross-sectional study. Cureus 2018; 10(4):e2444.
[PubMed] - 12.
Frybova B, Drabek J, Lochmannova J, et al. Cholelithiasis and choledocholithiasis in children; risk factors for development. PLoS One 2018; 13(5):e0196475.
[PubMed] - 13.
Lee S, Kweon OK, Kim WH. Associations between serum leptin levels, hyperlipidemia, and cholelithiasis in dogs. PLoS One 2017; 12(10):e0187315.
[PubMed] - 14.
Kim SB, Kim KH, Kim TN, et al. Sex differences in prevalence and risk factors of asymptomatic cholelithiasis in Korean health screening examinee: A retrospective analysis of a multicenter study. Medicine (Baltimore) 2017; 96(13):e6477.
[PubMed] - 15.
Rebholz C, Krawczyk M, Lammert F. Genetics of gallstone disease. Eur J Clin Invest 2018; 48(7):e12935.
[PubMed] - 16.
Tuna Kirsaclioglu C, Çuhacı Çakır B, Bayram G, et al. Risk factors, complications and outcome of cholelithiasis in children: A retrospective, single-centre review. J Paediatr Child Health 2016; 52(10):944-949.
[PubMed] - 17.
Mitchell MA. Anesthetic considerations for amphibians. J Exot Pet Med 2009; 18(1):40-49.
- 18.
Yaw TJ, Mans C, Martinelli L, Sladky KK. Comparison of subcutaneous administration of alfaxalone-midazolam-dexmedetomidine with ketamine-midazolam-dexmedetomidine for chemical restraint in juvenile blue poison dart frogs (Dendrobates tinctorius azureus). J Zoo Wildl Med 2020; 50(4):868-873.
[PubMed] - 19.
Barker D, Fitzpatrick MP, Dierenfeld ES. Nutrient composition of selected whole invertebrates. Zoo Biol 1998; 17:123-134.
- 20.
Finke MD. Complete nutrient composition of commercially raised invertebrates used as food for insectivores. Zoo Biol 2002; 21:269-285.
- 21.
Finke MD. Complete nutrient content of four species of commercially available feeder insects fed enhanced diets during growth. Zoo Biol 2015; 34(6):554-564.
[PubMed] - 22.
Pessier A. Short tongue syndrome and hypovitaminosis A. En: Mader DR, Divers SJ, ed. Current therapy in reptile medicine and surgery. St Louis: Saunders; 2014; 271-276.
- 23.
Bacon JP, Fort CE, Todhunter B, Mathis M, Fort DJ. Effects of multiple chemical, physical, and biological stressors on the incidence and types of abnormalities observed in Bermuda's cane toads (Rhinella marina). J Exp Zool B Mol Dev Evol 2013; 320(4):218-237.
[PubMed] - 24.
Burkhart JG, Helgen JC, Fort DJ, et al. Induction of mortality and malformation in Xenopus laevis embryos by water sources associated with field frog deformities. Environ Health Perspect 1998; 106(12):841-848.
[PubMed] - 25.
Ouellet M, Bonin J, Rodrigue J, DesGranges JL, Lair S. Hindlimb deformities (ectromelia, ectrodactyly) in free-living anurans from agricultural habitats. J Wildl Dis 1997; 33(1):95-104.
[PubMed] - 26.
Gardiner DM, Hoppe DM. Environmentally induced limb malformations in mink frogs (Rana septentrionalis). J Exp Zool 1999; 284(2):207-216.
[PubMed] - 27.
Wu X, Jiang J, Wan Y, Giesy JP, Hu J. Cyanobacteria blooms produce teratogenic retinoic acids. Proc Natl Acad Sci USA 2012; 109(24):9477-9482.
[PubMed] - 28.
Paganelli A, Gnazzo V, Acosta H, López SL, Carrasco AE. Glyphosate-based herbicides produce teratogenic effects on vertebrates by impairing retinoic acid signaling. Chem Res Toxicol 2010; 23(10):1586-1595.
[PubMed] - 29.
Das P, Mohanty-Hejmadi P. Vitamin A mediated limb deformities in the common Indian toad, Bufo melanostictus (Schneider). Indian J Exp Biol 2000; 38(3):258-264.
[PubMed]