Resolución de bloqueo de tercer grado en un Yorkshire Terrier mediante implantación de marcapasos VVIR
VVIR pacemaker implantation in a Yorkshire Terrier for third-degree atrioventricular block resolution
A. Santana, D. L. Casas, I. Montenegro, S. Medina, M. Maynar
Contacto: cardiologia@albeaveterinarios.com
Resumen
Paciente macho, raza Yorkshire Terrier y de 13 años de edad es atendido por historia de signos de debilidad y taquipnea, asociado a episodios de síncope y pérdida de consciencia. Los resultados de las pruebas obtenidos tras su exploración se caracterizaron por la presencia de bloqueo auriculoventricular de tercer grado, sin respuesta a la administración de atropina y sin patología cardiaca de base. Se procedió a la implantación de un marcapasos VVIR para la corrección de la bradiarritmia. Los controles intraoperatorios y postoperatorios posteriores mostraron mejoría de los signos clínicos, valores ecocardiográficos y una correcta función del generador y electrodo de estimulación ventricular.
Palabras clave: Bradiarritmia, Edema, Marcapasos, Yorkshire Terrier.
Summary
A 13-year-old male Yorkshire Terrier was evaluated because of signs of weakness and tachypnea associated with acute episodes of lack of consciousness. The results of the examination were consistent with a third-degree atrioventricular block with no response to atropine administration and without any cardiovascular pathology. VVIR pacemaker was implanted to correct the bradyarrythmia. The posterior follow-ups revealed an improvement of the clinical signs, echocardiographic values and a correct function of both the generator and the ventricular stimulation electrodes.
Keywords: Bradyarrythmia, Oedema, Pacemaker, Yorkshire Terrier.
Introducción
Los bloqueos auriculoventriculares son una de las arritmias de frecuente presentación en la clínica diaria. En su forma más grave, el bloqueo de tercer grado, se produce una disociación completa en la conducción eléctrica entre aurículas y ventrículos. En ocasiones, el foco de despolarización ventricular viene de zonas cercanas al nódulo auriculoventricular y, en otras, de zonas eminentemente ventriculares, las cuales producirán una frecuencia ventricular más baja y con ello mayor sintomatología. Estos síntomas son síncope, intolerancia al ejercicio, debilidad e insuficiencia cardiaca congestiva y se producen como consecuencia de la imposibilidad de mantener el gasto cardiaco. Así, la terapia recomendada para los pacientes con este tipo de arritmia es la implantación de un marcapasos.1
Presentamos el caso de un paciente con bloqueo auriculoventricular de tercer grado en el cual se implanta un marcapasos VVIR de forma endovascular.
Caso clínico
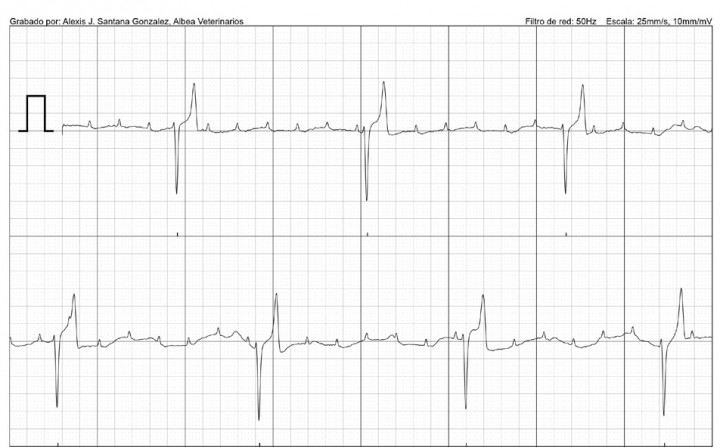
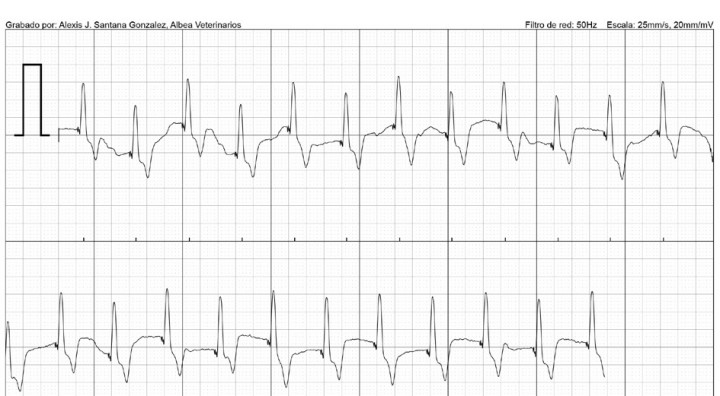
Paciente macho entero, de raza Yorkshire Terrier, de 13 años de edad, con signos de debilidad y taquipnea asociados a presentación aguda de episodios de pérdida de conciencia. Se comprueba la existencia de bloqueo auriculoventricular de tercer grado, registrando mediante electrocardiograma una onda P no conducida, con frecuencia atrial de 214 latidos por minuto (lpm) y complejos ventriculares anchos 0,12 milisegundos (mseg), con una frecuencia ventricular de 28 latidos por minuto (Fig. 1). Los QRS presentan conformación ancha, esto confiere una posición del marcapasos subsidiario en una porción más distal al haz de His (infrahisiniano).1
Figura 1
Presencia de ondas P no conducidas, con intervalo P-R no constante y frecuencia ventricular de 28 lpm. Bloqueo auriculoventricular de 3º grado.
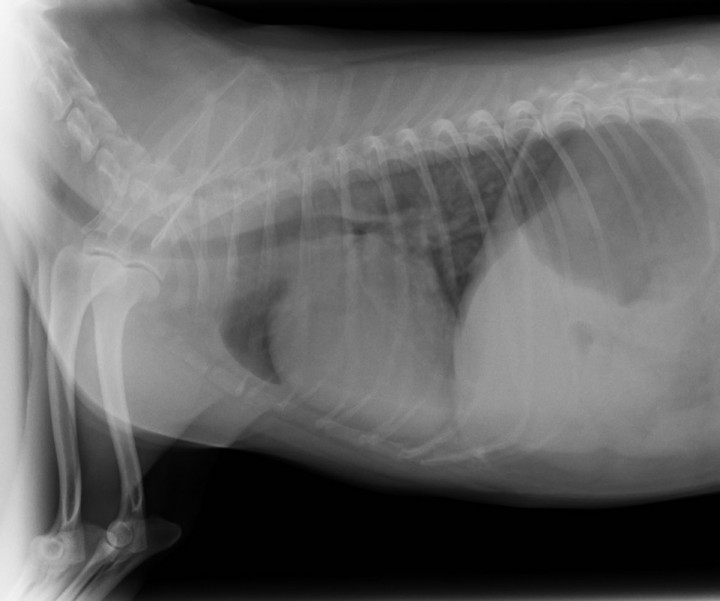
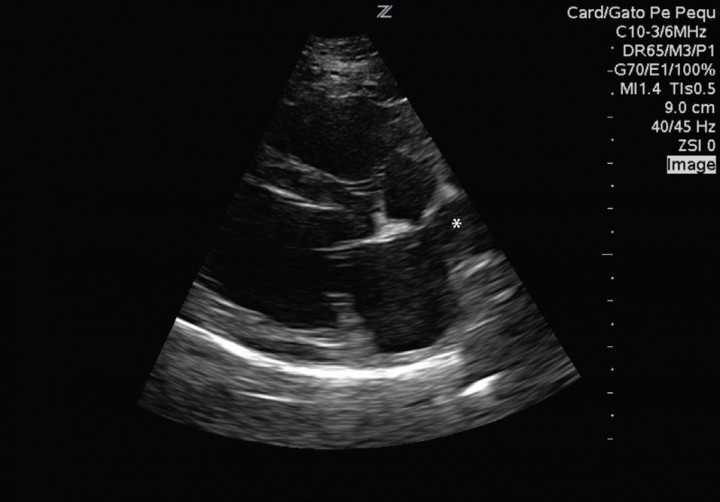
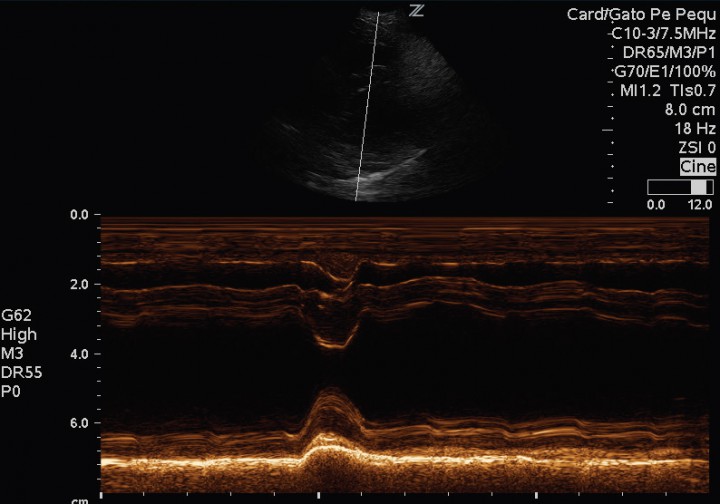
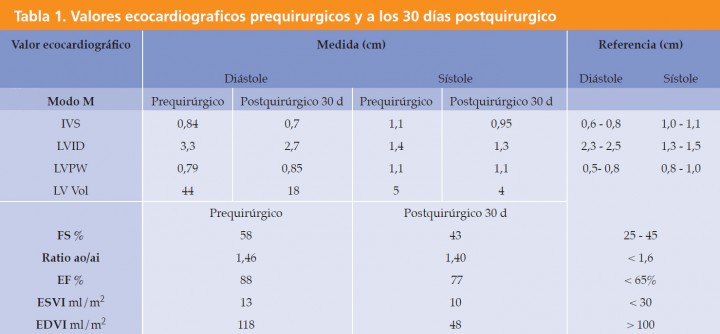
El paciente muestra disnea de tipo mixto y taquipnea (52 respiraciones por minuto). El estudio radiográfico del tórax revela la existencia de un patrón alveolar en zona perihiliar hacia lóbulos caudales compatible con edema pulmonar de tipo cardiogénico y un tamaño en el eje corte de 12 cuerpos vertebrales2 (rango normal 9,7 +/- 0,3) (Fig. 2). Asimismo, el estudio ecocardiográfico muestra una sobrecarga de volumen ventricular izquierda, sin aumento del tamaño atrial, pero con dilatación de las venas pulmonares (Fig. 3). Las medidas ecocardiográficas muestran un aumento de la fracción de acortamiento (Fig. 4) y de eyección (VE), un ratio aorta aurícula izquierda correcto (Ratio ao/ai) y aumento del índice volumétrico telediastólico final (EDVI) (Tabla 1). No se observan alteraciones estructurales congénitas ni adquiridas.
Figura 2
Presencia de patrón alveolar en región perihiliar, compatible con edema pulmonar cardiogénico.
Figura 3
Corte paraesternal derecho eje largo, donde se observa una dilatación de la vena pulmonar (*) sin detectarse aumento del atrio izquierdo.
Figura 4
Modo M sobre músculos papilares en paraesternal derecho eje corto. Se observa una fracción de acortamiento mantenida, con espesores de septo interventricular y pared libre ventricular izquierda correctos.
IVS: Septo interventrícular en sístole. LVID: Diámetro ventricular izquierdo. LVPW: Pared libre ventricular izquierda. LV Vol: Volumen ventricular izquierdo. FS %: Fracción de acortamiento. Ratio ao/ai: Ratio aorta aurícula izquierda. EF %: Fracción de eyección. ESVI: Indice volumetrico telesistólico final. EDVI Indice volumétrico telediastólico final.
El resto de pruebas diagnósticas incluyeron hemograma, bioquímica sérica y urianálisis, comprobándose la ausencia de anormalidades en sus resultados.
El diagnóstico presuntivo es el de bloqueo auriculoventricular de tercer grado idiopático, debido a la ausencia de patologías cardiacas, así como de alteraciones electrolíticas, metabólicas o neoplásicas y descartado historial de intoxicación. Se procede a realizar el test de respuesta a la atropina, con resultado negativo al no conseguir un incremento de la frecuencia ventricular ni mejora de los signos clínicos. Debido a la ausencia de respuesta a la atropina y descartándose patologías subyacentes, se considera al paciente como candidato para la implantación de un marcapasos ventricular (VVIR).
Se procede a su hospitalización para su estabilización previa a la intervención, administrándose tratamiento diurético a base de furosemida a 2 mg/Kg/IV cada 8 horas (Seguril, Sanofi, Barcelona) y espironolactona a 1 mg/Kg/VO cada 12 horas (Prilactone, Ceva Santé Animale, Libourne), pimobendan a 0,25 mg/Kg/VO cada 12 horas (Vetmedin, Boehringer Ingelheim, Barcelona) y antibioterapia de cobertura a base de amoxiciclina / clavulánico a 15 mg/Kg/IM cada 24 horas (Synulox, Zoetis, Madrid) y enrofloxacino a 5 mg/Kg/SC cada 24 horas (Baytril 10%, Bayer, Kiel). También se establece una pauta con heparina sódica a 150 UI/Kg/IV cada 12 horas (Heparina Sódica, Rovi, Madrid), previa a la realización de intervención endovascular del paciente, la cual se realiza a las 36 horas después de su ingreso.
El paciente es clasificado como ASA-V según la clasificación de la American Society of Anesthesiologists (ASA) ó Clase IIIB según la clasificación de la International Small Animal Cardiac Health Council (ISACHC).3 El protocolo anestésico incluyó su premedicación a base de butorfanol a 0,3 mg/Kg/IM (Torphasol, Laboratorios Dr. Esteve, Barcelona) como agente sedante y analgésico al tener mínimos efectos sobre el sistema cardiovascular, combinado con atropina a 0,04 mg/Kg/IM (Atropina, BBraun Medical, Barcelona). Tras la preoxigenación del paciente con oxígeno al 100%, se procedió a su inducción anestésica mediante la administración lenta de alfaxalona (Alfaxan, Dechra, Barcelona) a dosis-efecto (dosis total 2,5 mg/Kg/IV). El paciente se mantuvo con anestesia inhalatoria a base de sevofluorano (Sevoflo, Laboratorios Dr. Esteve, Barcelona) al 3,5-4% con mezcla de gases (30% aire medicinal – 70% oxígeno). Se mantuvo en ventilación espontánea y no fue necesaria en ningún momento la ventilación mecánica. Como analgesia intraoperatoria se emplearon bolos de fentanilo a 5 mcg/kg/IV (Fentanest, Kern Pharma, Barcelona). En todo momento se llevó a cabo la monitorización multiparamétrica de las constantes del paciente (ECG, SpO2, agentes inhalatorios, capnografía, PANI y temperatura).
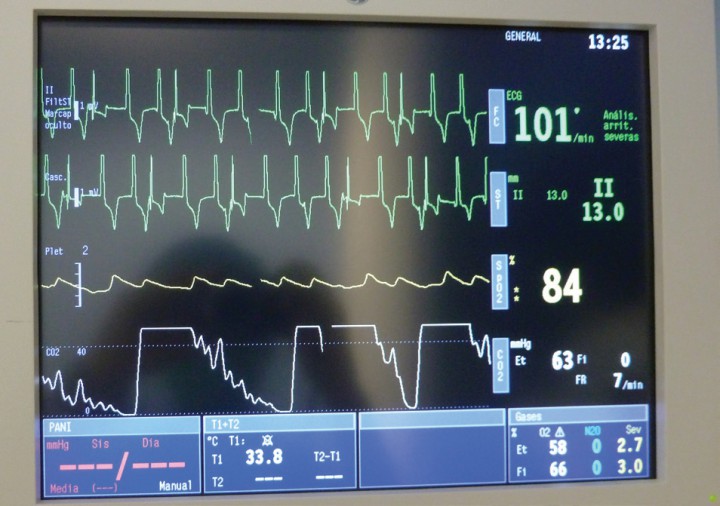
La implantación se llevó a cabo mediante abordaje percutáneo de la vena yugular derecha, para la colocación de introductor de 7F. Posteriormente y bajo control fluoroscópico con sistema BV PulseraTM (Philips Medical Systems, Holanda), se procedió a la implantación en el ventrículo derecho, del electrodo estimulado unipolar con lóbulos desplegables ATTAIN STARFIX 4195 (Medtronic, Inc., Dublin), con diámetro del electrodo distal de 5,3F. Se comprueba su correcta colocación mediante guiado por fluoroscopio y electrocardiograma de superficie (Fig. 5). Finalmente se lleva a cabo la tunelización subcutánea del cable para su conexión a sistema marcapasos Vitatron C60DR (Medtronic, Inc., Dublin) en bolsillo subcutáneo en posición interescapular.
Figura 5
Al momento de la implantación del cable ventricular y conexión del electrodo al marcapasos, se observa un ritmo ventricular con morfología del lado derecho a la velocidad establecida en el marcapasos, esto indica la correcta colocación del electrodo ventricular.
El sistema de marcapasos se programó con una configuración en modo VVI, a una frecuencia ventricular de 100 lpm y un voltaje de 5 Voltios (V) (Tabla 2), observando un voltaje de onda R en electrocardiograma de superficie de 16 milivoltios (mV) y una impedancia de 500 Ω.
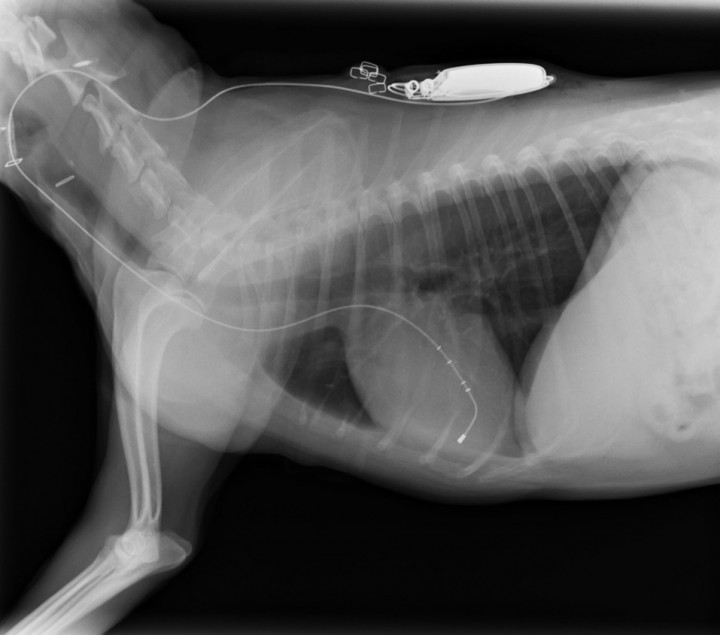
Durante el postquirúrgico el paciente es controlado mediante estudio radiográfico del tórax, electrocardiograma y ecocardiografía. El estudio radiográfico del tórax a las 24 horas postintervención revela la resolución del edema pulmonar, así como una disminución del índice vertebral a 11 cuerpos vertebrales (Fig. 6). Por su parte, el control electrocardiográfico muestra una frecuencia ventricular de 100 lpm (Fig. 7).
Figura 6
Se observa una disminución en el tamaño de la silueta cardiaca (medición de índice de Buchanan), con una correcta colocación del electrodo ventricular derecho.
Figura 7
Electrocardiograma postimplantación con una frecuencia cardiaca de 100 lpm.
A los 30 días postintervención el paciente no presenta síntomas, evidenciándose un patrón pulmonar radiográfico sin alteraciones y correcta colocación del electrodo endocavitario en ventrículo derecho, no se observan macrodesuniones del cable y la posición del electrodo, en comparación con las radiografías obtenidas en el postquirúrgico, es similar, lo cual descarta desplazamiento del electrodo. Las mediciones de ecocardiografía muestran una reducción del volumen ventricular izquierdo en diástole, con un EDVI y ESVI dentro de rango (Tabla 1). El voltaje de la onda R en electrocardiograma de superficie es de 13 mV; se activa en este momento la función de frecuencia variable del generador y se establece una pauta de revisión bianual.
Discusión
Sintomatológicamente los bloqueos auriculoventriculares de 2º y 3º grado, pueden producir síncopes cardiacos bradiarrítmicos, siendo los más graves shock, paro cardiaco y muerte súbita. En muchas ocasiones acompañan a un cuadro de insuficiencia cardiaca crónica.4 La presencia de esta insuficiencia cardiaca se basa en una disminución de la frecuencia cardiaca que no puede ser compensada por los mecanismos de aumento del volumen de eyección, como se ha comprobado en este caso. Las razas predispuestas al desarrollo de bloqueos auriculoventriculares de 2º y 3º grado son el Labrador, el Pastor Alemán, Cocker Spaniel, Pitbull, Beagle, Chow-Chow y West Highland White Terrier.5
En los pacientes con bloqueo completo, se deben descartar causas subyacentes como cardiomiopatías, enfermedades cardiacas congénitas o adquiridas, hiperpotasemia o intoxicación por digitálicos. Descartadas estas patologías, la causa principal es la fibrosis idiopática del nódulo auriculoventricular;6 los pacientes en los cuales se confirma este diagnóstico, son candidatos excelentes a la aplicación del marcapasos VVI, debido a que no existe una patología estructural que condicione su aplicación. La presencia de un QRS ancho como en el caso mostrado, indica una posición del marcapasos subsidiario infrahisiano;1 este tipo de marcapasos funciona a velocidades inferiores a los suprahisianos o intranodales, y son de peor pronóstico en medicina humana.7,8 No responden a la atropina ni estimulación simpática, pero sí responden a estímulos vagales; por lo que, aunque en estos pacientes de riesgo se recomienda la utilización de un marcapasos temporal bien tranesofágico9 transversos o transtorácicos previamente a la implantación del marcapasos definitivo,10 a falta de este instrumental se utilizó atropina en la premeditación para evitar que un aumento de estímulo vagal disminuyera aun más la frecuencia ventricular.
Debido al mayor coste,11 mayor tiempo quirúrgico12 y mayor tasa de complicaciones13 en la implantación de marcapasos bicamerales DDD, frente al alto grado de satisfacción de los propietarios con perros con marcapasos VVI14, hace que en pacientes que presentan este tipo de patología se prefiera la implantación de marcapasos VVI frente a los bicamerales DDD.15,16 El electrodo ventricular utilizado en nuestro caso presenta una cubierta de contacto con el ventrículo derecho que dispone una cápsula de liberación prolongada de beclometasona, la cual reduce la inflamación y fibrosis en la zona de contacto con el electrodo. Esto aminora el riesgo de fibrosis en el endocardio adyacente y disminuyen las posibilidades de pérdida de control; es decir, la incapacidad para producir una despolarización ventricular. Esta es una de las causas demostradas de fallo de contacto en medicina veterinaria.17 Se escoge el electrodo unipolar frente a un electrodo bipolar debido a la mejor sensibilidad de captación de estos y su menor tamaño. Así mismo, se opta por un sistema de lóbulos desplegables frente a la opción de un sistema enroscable, debido a que el tamaño del ventrículo derecho del paciente confiere mayor riesgo de perforación.17
Si bien en veterinaria se han utilizado marcapasos con electrodos tanto endocárdicos como epicárdicos, en nuestro paciente se desecha esta última opción debido a la necesidad de una toracoscopia,18 mayor tiempo de intervención y posibilidades de complicación. Al seleccionar un electrodo endocavitario y ser implantado mediante acceso endovenoso, se aconseja el uso de heparina sódica durante la intervención, siendo también recomendable el uso de terapia antitrombótica pre y postintervención para evitar la formación de fenómenos tromboembólicos. La colocación del generador se ha descrito tanto en región dorsolateral del cuello como interescapular (o región de la cruz). En nuestro caso optamos por la colocación interescapular para evitar la migración de dicho generador, dado el pequeño tamaño del paciente. El tamaño del cable ventricular es también un hándicap a la hora de implantar un dispositivo de estas características, realizando en nuestro caso un bucle alrededor del generador intentando evitar zonas de flexión en el cable, lo cual predispondría a posibles macrodesuniones o roturas.18
En los procedimientos mínimamente invasivos cuyo nivel de dolor va de leve a moderado, el butorfanol se emplea en la premedicación debido a su mínimo efecto sobre la función cardiopulmonar.19 Teniendo en cuenta que se trata de un procedimiento mínimamente invasivo y de un paciente con un bloqueo auriculo-ventricular de tercer grado, con una bradicardia de 40 latidos por minuto,20 el butorfanol es un fármaco de elección en este caso. A pesar de que el uso combinado de opioides agonistas como el fentanilo, con opioides agonistas-antagonistas como el butorfanol, produce una interacción disminuyendo el efecto analgésico,19 existen estudios en los cuales tras la administración de butorfanol, se ha empleado el fentanilo como analgésico de rescate, obteniendo buenos resultados al incrementar la dosis del fentanilo.21 En otros estudios donde se emplean opioides agonistas como la morfina como analgésico de rescate tras la administración de butorfanol, también se obtiene una analgesia efectiva.22
La ecocardiografía posterior mostró una disminución del VE, disminución del volumen ventricular y normalización del EDVI.
A los 30 días se comprueba el correcto funcionamiento del marcapasos mediante radiografías (en las que se observa un correcta posición del electrodo, sin migración del mismo) y electrocardiograma de superficie, en el que se observa un voltaje de onda R de 13 mV y morfología de bloqueo de rama izquierda, característica de la posición correcta del electrodo en el ápice del ventrículo derecho,17 siendo las frecuencias de estimulación y captación correctas; en este momento se activa la función VVIR de frecuencia variable en el paciente.
Agradecimientos
Queremos agradecer a los miembros de la Cátedra de Tecnologías Médicas de la ULPGC, dentro del plan de innovación tecnológica MOTIVA, por su asesoramiento técnico y médico en la resolución del presente caso; así como a Medtronic Inc. por la cesión del cable ventricular y del sistema de marcapasos.
Fuente de financiación: Este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: Los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Santilli RA: Disturbi della conduzione. En Santilli RA, Perego M (ed): Elettrocardiografia del cine e del gatto, Genesi e interpretazione del ritmo cardiaco. Italy, Elsevier, 2012; 173-179.
- 2.
Buchanan JW, Bucheler J: Vertebral scale system to measure canine heart size in radiograms. J Am Vet Med Assoc 1995;206:194.
[PubMed] - 3.
Woodbrige, NJ: International Small Animal Cardiac Health Council Recommendations for the diagnosis and treatment of hearth failure in small animals ISACHC Publication.1994;5.
- 4.
Montoya A: Arritmias cardiacas. En Ynaraja E, Montoya A, Bernal J (ed): Manual de electrocardiografía en la clínica del perro. Boehringer-Ingelheim, 2004: 112-197.
- 5.
Wess G, Thomas WP, Berger DM, Kittlelson MD: Applications, complications and outcomes of transvenous pacemaker implantation in 105 dogs (1997-2002). J Vet Intern Med 2006; 20:877-884.
[PubMed] - 6.
Skrodzki M: Electrocardiograma. En Tobias R, Skrodzki M, Schneider M (ed) Cardiología práctica del perro y del gato. Schlütersche Verlagsgesellschaft mbH & Co. 2012; 31-57.
- 7.
Tellez de Peralta G. Arritmias cardiacas. En Tellez de Peralta G (ed). Tratado de cirugía cardiovascular. Ediciones Diaz de Santos 1998; 446- 449.
- 8.
Schwartzman D. Bloqueo y disociación auriculoventriculares. En Zipes&Jalife (ed). Cardiac electrophisiology: From cell to bedside. 4th edition. Edición traducida “Arritmias”. Marban libros 2006; 485-489.
- 9.
Sanders RA, Green HW, Hogan DF, Sederquist K. Use of transesophageal atrial pacing to provide temporary chronotropic support in a dog undergoing permanent pacemaker implantation. J Vet Cardiol 2011;13: 227-230.
[PubMed] - 10.
Estrada AH. Cardiac pacing. En Weisse C, Berent A (ed) Veterinary Image-Guided intervencións. UK, John Wiley & Sons Inc 2015; 518-530.
- 11.
Wiegand UK, Potratz J, Bode F. Cost-effectiveness of dual-chamber pacemaker therapy: does single lead VDD pacing reduce treatment costs of atrioventricular block? Eur Heart J 2001; 22:174-180.
[PubMed] - 12.
Wiegand UK, Bode F, Schneider R. Atrial sensingand AV synchrony in single lead VDD pacemakers: a prospective comparison to DDD devices with bipolar atrial leads. J Cardiovasc Electrophysiol 1999; 10:513-520.
[PubMed] - 13.
Chauhan A, Grace AA, Newell SA. Early complications after dual chamber versus single chamber pacemaker implantation. Pacing Clin Electrophysiol 1994; 17:2012-5.
[PubMed] - 14.
Oyama MA, Sisson DD, Lehmkuhl LB. Practices and outcome of artificial cardiac pacing in 154 dogs. J Vet Intern Med 2001; 15:229-239.
[PubMed] - 15.
Bulmer BJ. VDD pacing in dogs: When, Why and How to perform single-lead atrial synchronous, ventricular inhibited (VDD) pacing. J Vet Cardiol 2006; 8: 25-39.
[PubMed] - 16.
Lichtenberger J, Escollan KF, Bulmer BJ, Sisson D. Long-Term outcome of physiologic VDD pacing versus non-physiologic VVI pacing in dogs with high-grade atrioventricular block. J Vet Cardiol 2015;17: 42-53.
[PubMed] - 17.
Kittleson MD. Kienle RD. Tratamiento antiarritmico de intervención. En Multimedica (ed). Medicina cardiovascular de pequeños animales. España, Multimédica Ediciones Veterinarias, 2000; 525-539.
- 18.
Bright JM. Terapia con marcapasos. En Tilley LP, Smith FW, Oyama M, Sleeper M (ed). Manual de Cardiología canina y felina. España, Multimédica Ediciones Veterinarias, 2009; 355-365.
- 19.
Papich MG. Drug Interactions. En Lumb & Jones (ed) Veterinary Anesthesia and Analgesia. Blackwell Publishing. Fourth Edition. 2007.
- 20.
Cabezas MA, Salamanca I, Cordero S. Complicaciones. En: Manual Clínico de Farmacología y Complicaciones en Anestesia de Pequeños Animales. Multimédica Ediciones Veterinarias. 2014.
- 21.
Mathews KA, Paley DM, Foster RA, et al. A comparison of ketorolac with flunixin, butorphanol, and oxymorphone in controlling postoperative pain in dogs. Can Vet J 1996; 37: 557-567.
[PubMed] - 22.
Gutiérrez-Blanco E, Victoria-Mora JM, Ibancovichi-Camarillo JA, et al. Postoperative analgesic effects of either a constant rate infusion of fentanyl, lidocaine, ketamine, dexmedetomidine, or the combination lidocaine-ketamine-dexmedetomidine after ovariohysterectomy in dogs. Vet Anaesth Analg 2015; 42: 309-18.
[PubMed]