Caso clínico de… Cardiología
M. López, V. Fernández, J. Engel
Contacto: mercedes.l@laclinicaveterinaria.com
Historia clínica
Se presenta en consulta un perro mestizo de 22 kg, entero, de 13 años de edad por presentar tos seca y taquipnea de tres días de evolución, intolerancia al ejercicio, hiporexia y apatía.
En el examen físico se encuentra en buen estado de hidratación, alerta, 38,7 ºC de temperatura, con mucosas rosadas, TRC <2 segundos, y ganglios no infartados. Se encuentra crepitación espiratoria a la auscultación pulmonar en ambos hemitórax y soplo sistólico de proyección mitral de grado IV/VI, frecuencia cardiaca 180 lpm. Frecuencia respiratoria no valorable por jadeo.
Los diagnósticos diferenciales debido a la presencia de soplo apical izquierdo IV/VI incluyen: enfermedad degenerativa de válvula mitral (EDVM), endocarditis mitral, cardiomiopatía dilatada, displasia mitral u otras patologías congénitas o adquiridas del ventrículo izquierdo con dilatación del anillo mitral.
Los diagnósticos diferenciales debido a la disnea, taquipnea, intolerancia al ejercicio y crepitación a la auscultación espiratoria incluyen enfermedad de parénquima pulmonar: edema cardiogénico, neoplasia, neumonía, edema no cardiogénico, enfermedad intersticial (p. ej., fibrosis pulmonar) o hemorragia. Enfermedad bronquial/bronquiolar: Bronquitis (idiopática, bacteriana, vírica), bronquiomalacia, bronconeumonía eosinofílica o neoplasia (primaria o metástasica).
Los diagnósticos diferenciales debido a tos y apatía incluyen: sospecha de estar asociado a los diagnósticos diferenciales anteriores.
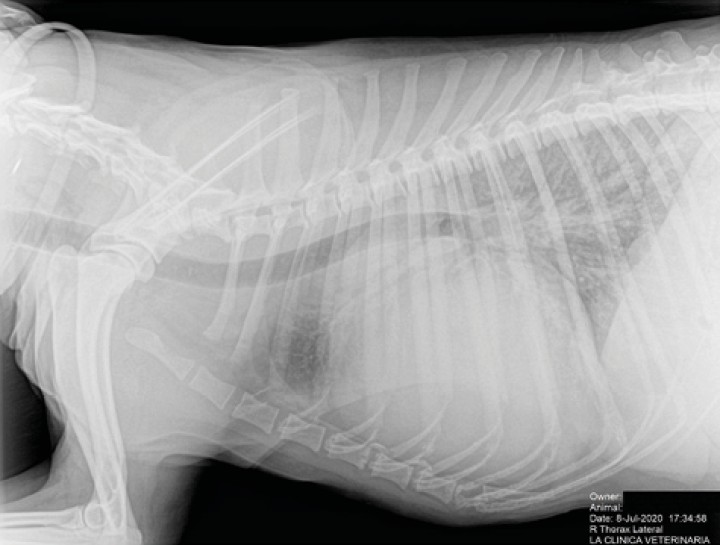
Se realiza radiografía de tórax (Fig. 1) que revela cardiomegalia generalizada severa, índice de Buchanan de 15 cuerpos vertebrales, que puede corresponder a un severo aumento de las cámaras cardiacas, o a la presencia de líquido pericárdico. Se observa, además, un patrón pulmonar intersticial perihiliar, compatible con edema pulmonar, foco de neumonía o hemorragia pulmonar.
Figura 1
Radiografía lateral de tórax en la que se observa cardiomegalia generalizada, VHS 15. Patrón alveolar intersticial compatible con edema pulmonar. Patrón vascular mixto y patrón bronquial en lóbulos caudales, compatible con bronquitis crónica, mineralización por degeneración senil.
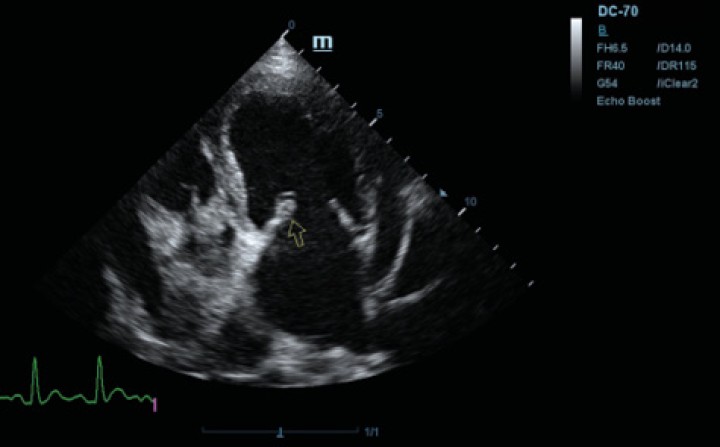
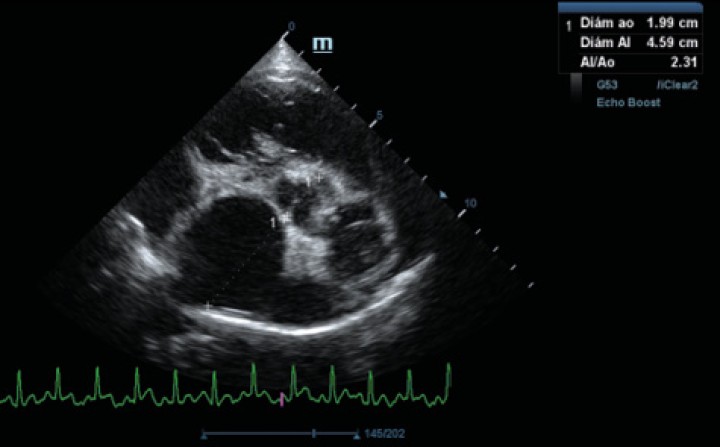
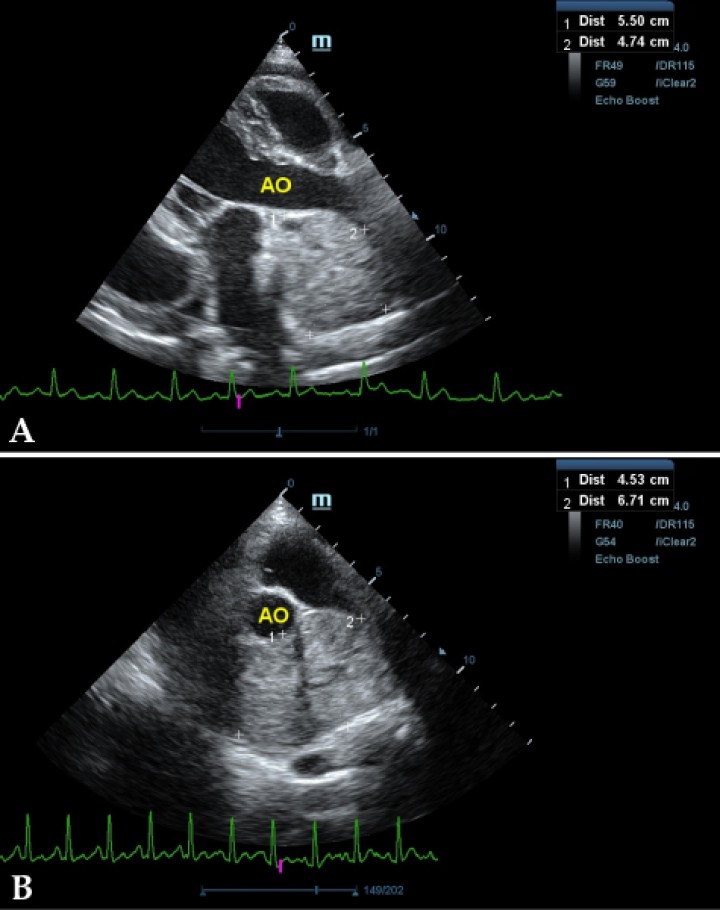
Se realiza ecocardiografía en la cual observamos engrosamiento de la válvula mitral (Fig. 2) y alteración de la estructura de las cámaras cardiacas: ratio atrio izquierdo/aorta 2,25 (Fig. 3), diámetro de ventrículo izquierdo en diástole normalizado (DVIdn) 1,98, patrón de flujo transmitral pseudonormal con velocidad máxima de onda E de 1,7 m/s, tiempo de relajación isovolumétrica (TRIV) acortado, 30 ms, y regurgitación mitral de hasta 4,6 m/s. En la ecocardiografía se observa también una masa hiperecoica bien definida de hasta 7 x 4,3 cm de diámetro en la base aórtica (Fig. 4) y un acúmulo de derrame pericárdico leve que no permite la pericardiocentesis. Además, se detecta un nódulo hiperecoico redondeado de 1,56 cm de diámetro en la válvula tricúspide (Fig. 5).
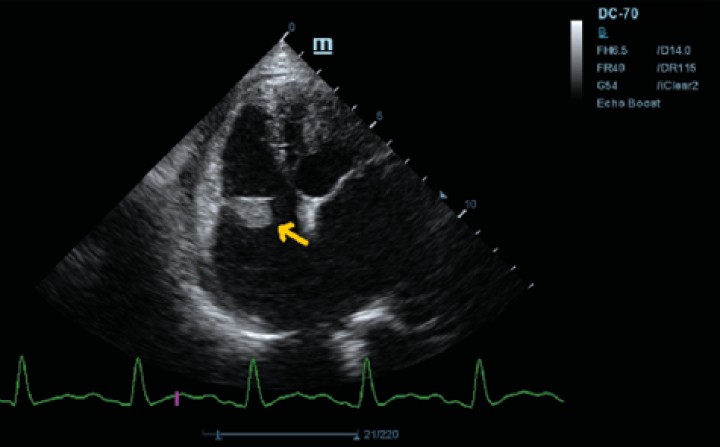
Figura 2
Ecocardiografía en corte paraesternal izquierdo eje largo, de 4 cámaras en la que se observa engrosamiento de la válvula mitral (flecha).
Figura 3
Ecocardiografía en corte paraesternal derecho eje corto en base de corazón, visualizando ratio atrio izquierdo/aorta aumentado.
Figura 4
Ecocardiografía en corte paraesternal izquierdo en base de corazón, en las que se observa la estructura hiperecoica y heterogénea junto a la aorta en un corte de la lesión transversal (A) y otro longitudinal (B). Compatible con neoplasia.
Figura 5
Ecocardiografía en corte paraesternal izquierdo eje largo, optimizada para válvula tricúspide en la que se observa estructura hiperecoica.
Los hallazgos de la válvula mitral son compatibles con enfermedad de la válvula mitral, y combinados con los signos clínicos, los hallazgos radiográficos y los flujos transmitrales establecen un diagnóstico diferencial de fallo cardiaco congestivo izquierdo (enfermedad degenerativa de la válvula mitral estadio C). Los hallazgos de la válvula tricúspide son compatibles con neoplasia, endocarditis, trombo o endocardiosis valvular. La apariencia y localización de la masa es consistente con un tumor de base aórtica (p. ej., quemodectoma o carcinoma tiroideo). La efusión pleural es leve y está probablemente asociada a la neoplasia. Sería menos probable que estuviera asociada a fallo cardiaco congestivo derecho concurrente al no existir atrio derecho aumentado de tamaño, ascitis, congestión hepática o distensión yugular. La velocidad pico de la válvula tricúspide es compatible con una posible hipertensión pulmonar, probablemente leve. Al no existir compresión obvia de las arterias pulmonares, esta se considera asociada a la enfermedad de la válvula mitral y fallo cardiaco (poscapilar, tipo II) o idiopática (tipo I).
¿Cuál es el manejo a corto y medio plazo de un paciente con EDVM en fase C como el que presentamos?
El paciente se hospitaliza durante las primeras 12 horas, estabilizando con oxigenoterapia y administrando un primer bolo subcutáneo de furosemida (Seguril, Sanofi Aventis, Madrid) a 3 mg/kg/8h, y se mantiene el tratamiento ambulatorio de furosemida a 2 mg/kg/8h vía oral en su domicilio. El paciente presenta mejoría clínica a las 48 horas desapareciendo las toses, la taquipnea y la intolerancia al ejercicio, se encuentra más animado y con apetito normal. Se observa una cantidad de líquido pericárdico similar a la detectada previamente en la revisión ecográfica.
Una vez estabilizado y habiendo realizado la ecocardiografía, se instaura tratamiento oral a base de torasemida 0,25 mg/kg/24h (Upcard® Vetoquinol, Madrid), pimobendán 0,25 mg/kg/12h (Vetmedin® Boehringer, Barcelona), espironolactona 2 mg/kg/12h y benazepril 0,25 mg/kg/12h (Cardalis® Ceva, Barcelona).
¿Cuál fue el seguimiento y la evolución?
En la revisión ecográfica de control, tras 7 meses de evolución, podemos observar una disminución de las dimensiones de las cámaras cardiacas izquierdas respecto al estudio anterior, siendo el ratio AI/Ao 1,92 y DVIdn 1,62, patrón de flujo transmitral pseudonormal con velocidad máxima de onda E 1,3 m/s, tiempo de relajación isovolumétrica (TRIV) 31 ms y regurgitación mitral de hasta 6,1 m/s. Además, se aprecia un aumento en la cantidad de derrame pericárdico, provocando taponamiento cardiaco de atrio y ventrículo derechos (Fig. 6).
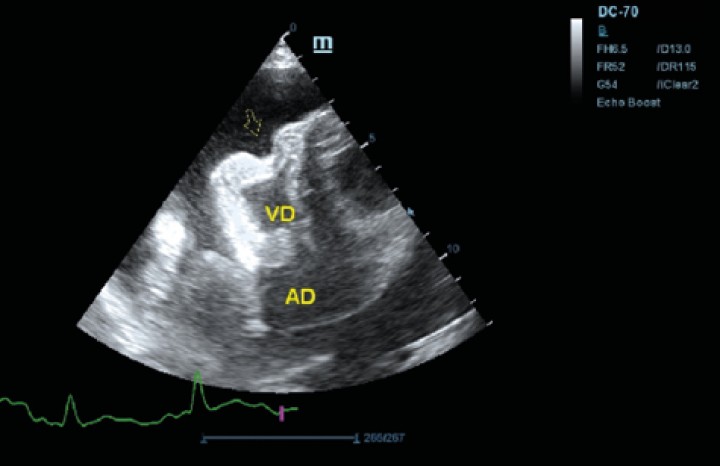
Figura 6
Ecocardiografía en corte paraesternal izquierdo en eje largo optimizada para corazón derecho en la que se observa taponamiento cardiaco en ventrículo derecho (flecha) debido a derrame pericárdico.
Las lesiones de la base aórtica y de la válvula tricúspide se mantienen en las mismas dimensiones. Los hallazgos encontrados en esta ecocardiografía pueden responder a remodelación cardiaca (gracias al tratamiento de la EDVM que se instauró en el momento del diagnóstico), aunque también su interpretación puede verse alterada por la efusión pericárdica. Los propietarios rehúsan la realización de pericardiectomía, por lo que únicamente se realiza pericardiocentesis, bajo sedación intravenosa de medetomidina (0,01 mg/kg; Domtor® Ecuphar, Barcelona) y midazolam (0,3 mg/kg; Midazolam Normon®, Madrid), y butorfanol intramuscular (0,3 mg/kg; Torphasol® Esteve, Barcelona), drenando 500 ml de líquido serosanguinolento, en cuyo análisis se observan células mesenquimales, probablemente compatible con derrame pericárdico secundario al tumor de la base del corazón observado. Como tratamiento ambulatorio oral en su domicilio se mantiene el de pimobendán 0,25 mg/kg/12h (Vetmedin® Boehringer, Barcelona), espironolactona 2 mg/kg/12h y benazepril 0,25 mg/kg/12h (Cardalis® Ceva, Barcelona) y torasemida 0,25 mg/kg/24h (Upcard® Vetoquinol, Madrid).
Cuatro meses después, acude a consulta presentando intolerancia al ejercicio y taquipnea, jadeo y frecuencia cardiaca de 145 lpm. Se realiza ecocardiografía de revisión en la que se observa un aumento de las cámaras cardiacas izquierdas respecto al estudio anterior (ratio AI/Ao 2,36; DVIdn 2,39), manteniendo un patrón de llenado de ventrículo izquierdo normal (con velocidad de onda E mitral 1,4 m/s, velocidad de onda A mitral 0,8 m/s y ratio E/A 1,3) y regurgitación mitral de 4 m/s. Las lesiones de la base aórtica y de la válvula tricúspide se mantienen en las mismas dimensiones. Durante el estudio ecocardiográfico se observan líneas B además de una nueva presentación de derrame pericárdico. Estos hallazgos sugieren una probable descompensación de la enfermedad de la válvula mitral con fallo cardiaco izquierdo y, concurrentemente, recurrencia de la efusión neoplásica con taponamiento secundario. Se realiza un segundo drenaje pericárdico de 900 ml de líquido de similares características macroscópicas. Como tratamiento ambulatorio oral en su domicilio se mantiene el de pimobendán 0,25 mg/kg/12h (Vetmedin® Boehringer, Barcelona), espironolactona 2 mg/kg/12h y benazepril 0,25 mg/kg/12h (Cardalis® Ceva, Barcelona) y se aumenta la dosis de torasemida 0,29 mg/kg/24h (Upcard® Vetoquinol, Madrid).
Finalmente, tras dos meses de evolución, el paciente se presenta en consulta de nuevo con signos de intolerancia al ejercicio, jadeo, pérdida de peso y ascitis. Valorando además ecocardiográficamente la recurrencia del derrame pericárdico, los propietarios rehúsan la pericardio y abdominocentesis y se decide la eutanasia humanitaria del paciente.
¿Cuál es la naturaleza de la lesión en la válvula tricúspide?, ¿tiene relación con la lesión de base aórtica?
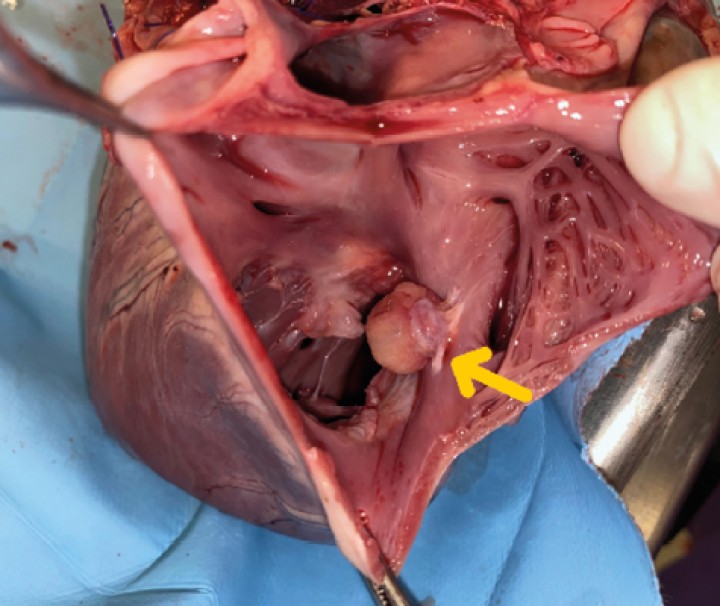
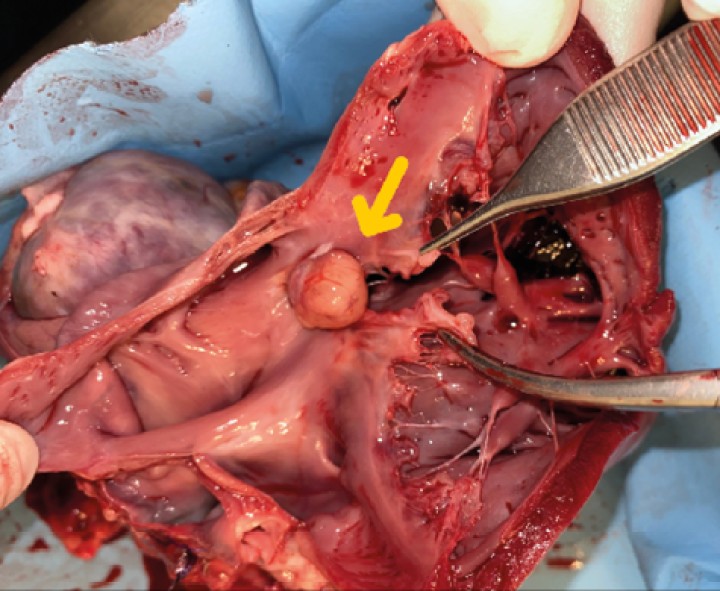
Se realiza la necropsia en la que se observa el corazón dentro del saco pericárdico con abundante líquido pericárdico. Se observa una gran masa redondeada de 7 x 5 x 3 cm en la base de la aorta, de consistencia firme, vascularizada, la cual al corte presenta vascularización y cavitaciones, áreas de hematoma y áreas de tejido graso y tejido fibroso. Se observa engrosamiento y degeneración de ambas válvulas atrioventriculares y, además, presencia de un nódulo en la válvula tricúspide de aspecto liso, color beige, no vascularizado de 1,5 cm. Se realizó en la toma y envío de muestras de las lesiones observadas en la base de corazón y tricúspide (Figs. 7, 8, 9 y 10).
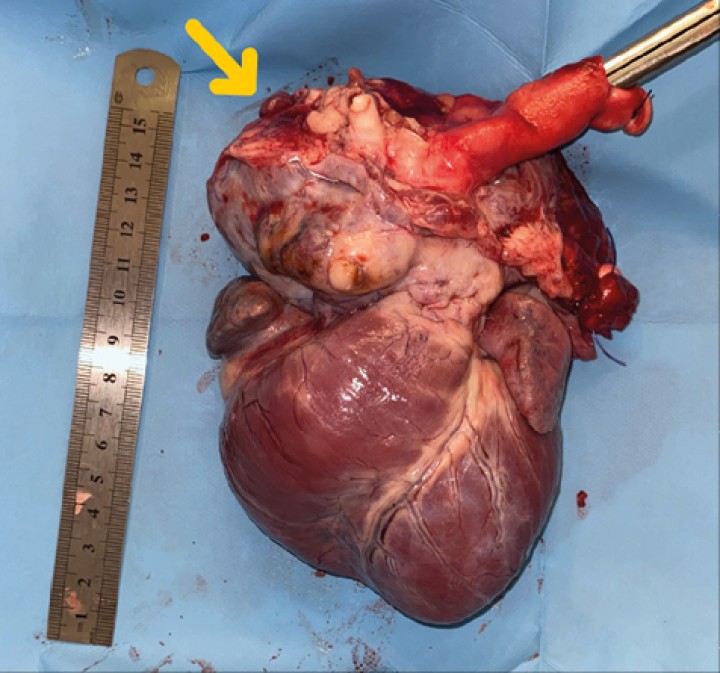
Figura 7
Imagen de corazón evidenciando masa en base aórtica (flecha).
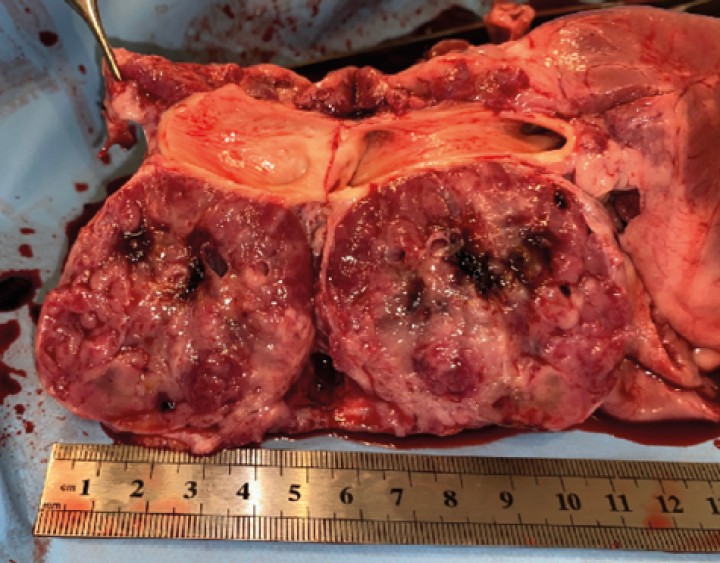
Figura 8
Detalle de masa adherida a aorta. Masa esponjosa, cavitada, vascularizada, con áreas de necrosis y tejido adiposo.
Figura 9
Detalle de masa tricúspide (flecha). Visión desde aurícula derecha.
Figura 10
Detalle de masa tricúspide (flecha) adherida a las valvas. Vista gracias a la apertura completa del ventrículo derecho.
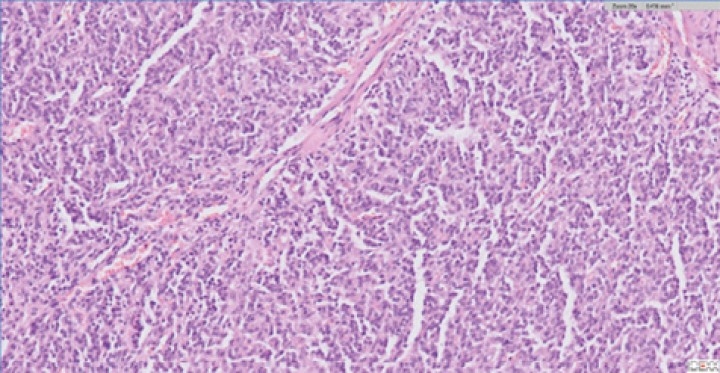
El análisis histopatológico de ambas lesiones confirma la sospecha diagnóstica de quemodectoma, siendo el nódulo tricúspide metástasis de la neoplasia principal en la base aórtica (Fig. 11), ya que al examen microscópico en ambas localizaciones se observaron células de bordes indefinidos, citoplasma escaso a moderado eosinófilo finamente granular, núcleo redondo, cromatina granular y nucléolo variablemente presente, pequeño, redondo y basófilo.
Figura 11
Vista histopatológica de tumor neuroendocrino: Se observa una proliferación de células poligonales formando nidos y paquetes y también áreas de empalizada alrededor de pequeños vasos sanguíneos. Las células muestran bordes indefinidos, citoplasma escaso a moderado eosinófilo finamente granular, núcleo redondo, cromatina granular y nucléolo variablemente presente, pequeño, redondo y basófilo. La anisocitosis y anisocariosis son moderadas.
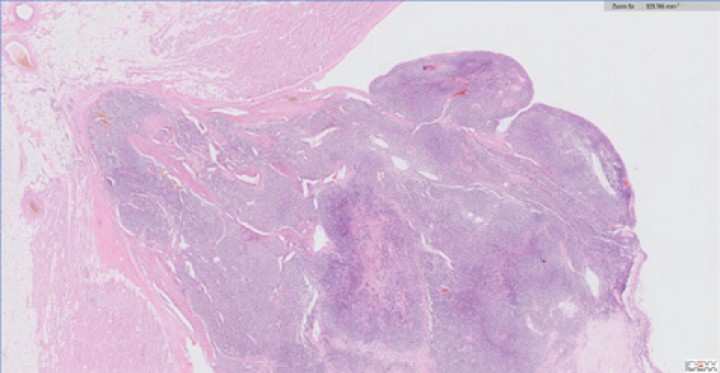
También se observó anisocitosis y anisocariosis moderadas. Se reconocieron mitosis en 10 campos de 40X a través de la autólisis en la muestra. Se diagnosticó así en la muestra de aorta y tejido adiposo de la base cardíaca un carcinoma neuroendocrino, consistente con quemodectoma, con invasión intravascular. En la muestra de la válvula tricúspide y miocardio de la pared ventricular derecha se diagnosticó metástasis valvular miocárdica de carcinoma neuroendocrino y degeneración mixomatosa de la válvula tricúspide, marcada, crónica y difusa (endocardiosis). Además, la lesión neoplásica en tricúspide presentaba carácter infiltrativo hacia el tejido miocárdico de la pared ventricular derecha y epicardio (Fig. 12).
Figura 12
Vista histopatológica de lesión tricúspide, infiltrando, expandiendo y obliterando la válvula tricúspide; en una de las secciones se observa un nódulo moderadamente delimitado, no encapsulado, expansivo y densamente celular que se extiende hacia la luz del ventrículo y atraviesa todo el miocardio hacia el tejido adiposo del epicardio. La masa muestra características similares a lo descrito para la proliferación previa, por lo que se considera metástasis de la primera.
Discusión
La EDVM es la enfermedad adquirida más común y frecuente en la especie canina que diagnosticamos en la clínica de pequeños animales,1 en la cual el aparato valvular atrioventricular izquierdo (en ocasiones también el derecho) sufre una degeneración celular y de la matriz intracelular generando cambios y engrosamiento en el endotelio y subendotelio del mismo. La deformación progresiva de la válvula atrioventricular da lugar a regurgitación hacia el atrio con su consiguiente aumento de volumen y presión, remodelando la estructura atrial y ventricular.1 El avance de esta hipertrofia excéntrica puede alterar la hemodinamia del corazón y dar lugar a insuficiencia cardiaca congestiva, causando en el paciente un cuadro de disnea, taquipnea, intolerancia al ejercicio, etc.
En el caso que presentamos podemos confirmar cardiomegalia severa y edema pulmonar dado que el estudio radiológico del tórax permite establecer el tamaño cardiaco y valorar el patrón pulmonar. La insuficiencia cardíaca congestiva izquierda se caracteriza por un patrón intersticial, que puede evolucionar a patrón alveolar en la región perihiliar que tiende a distribuirse hacia caudodorsal, característico del edema pulmonar cardiogénico, patrón vascular venoso.
La enfermedad se clasifica en cuatro fases clínicas según el consenso del ACVIM (American College of Veterinary Internal Medicine). Se puede clasificar nuestro caso como fase C aguda debido a la aparición de signos cínicos de insuficiencia cardiaca congestiva de forma repentina, confirmada con el estudio radiológico y cardiomegalia severa.1
La ecocardiografía es el método de elección para confirmar el diagnóstico de EDVM y estimar la severidad de la regurgitación mitral. Los hallazgos ecocardiográficos incluyen el engrosamiento y/o prolapso de las hojas mitrales junto con la identificación de la regurgitación mediante Doppler. Como se comprobó en el estudio post mortem en nuestro caso, a menudo se observan alteraciones en la válvula tricúspide, pero suelen ser menos marcadas que las de la válvula mitral.2 La ecocardiografía permite adquirir dimensiones del AI en relación con la aorta, o valoración del diámetro del VI en diástole y sístole, muy útiles para estimar el grado de remodelación (agrandamiento) cardíaco.2
El tratamiento viene determinado por la fase en la que se encuentre nuestro paciente; cuando los signos de insuficiencia cardiaca congestiva aparecen de forma aguda, como ocurrió en nuestro paciente, se recomienda la estabilización mediante oxigenoterapia y diuresis. Una vez estable y normalizada la frecuencia respiratoria, se recomienda el uso de pimobendán, torasemida o furosemida, espironolactona y benazeprilo.1
Respecto a los diuréticos, el fármaco de primera elección tradicionalmente es la furosemida. Sin embargo, en nuestro caso se eligió el uso de la torasemida como tratamiento ambulatorio porque en el estudio TEST la torasemida no fue inferior a la furosemida como tratamiento de primera línea para el FCC causada por la EDVM3 y, además, según el estudio CARPODIEM la torasemida administrada en perros diagnosticados de EDVM que entraron por primera vez en fallo cardiaco congestivo disminuyó significativamente el riesgo de muerte relacionada con causas cardiacas o el abandono prematuro del estudio por razones cardíacas en comparación con la furosemida.4
Se denomina generalmente “tumor de base cardiaca” a cualquier masa ubicada en la base del corazón, asociada a la pared de la aorta ascendente y al tronco pulmonar, pero sin afectación del atrio derecho, siendo los más comunes los quemodectomas.5,6 Se trata de neoplasias benignas no funcionales, localmente invasivas que suelen encontrarse como hallazgo incidental salvo que tengan un tamaño suficiente como para infiltrar el corazón o sus grandes vasos o den lugar a efusión pericárdica y taponamiento cardiaco. Por su carácter benigno raramente metastatizan, aunque se han reportado metástasis en pulmones, hígado, mediastino, nódulos linfáticos, pericardio y, raramente, en adrenales, riñón, bazo y hueso.6,7
Durante la exploración ecocardiográfica de nuestro paciente observamos una masa en el área de la base aórtica, cuya sospecha diagnóstica fue de quemodectoma. No realizamos estudio histopatológico in vivo porque la evaluación citológica de las masas de base aórtica y del líquido pericárdico asociado a las mismas no suele ser diagnóstica, ya que son neoplasias que no exfolian células fácilmente en la toma de muestra.5 Por ello, suele hacerse un diagnóstico de trabajo en base a los hallazgos ecocardiográficos; además, el diagnóstico definitivo histológico corresponde en un 78 % de los casos con el diagnóstico presuntivo de la imagen ecocardiográfica.5 Adicionalmente en nuestro caso, no se cumplían los criterios para realizar una punción con aguja fina siendo una masa móvil y lejana a la pared torácica.8
Dentro de las neoplasias cardiacas primarias, los segundos tumores más frecuentes son los tumores localizados en la base cardiaca asociados a la aorta ascendente y al tronco pulmonar, sin afección del atrio derecho, dentro de los cuales los más comunes en perro son los quemodectomas, con una incidencia del 8 %,9 aunque según diferentes estudios pueden alcanzar hasta un 14-18 % de incidencia;9 también pueden desarrollarse en esta zona masas paratiroideas, carcinoma de tiroides ectópico o linfosarcomas. La mayoría de ellos, 84 %, son de desarrollo primario.10
El interés del caso que presentamos es el carácter metastásico intracardiaco de la neoplasia benigna de base aórtica, quemodectoma, y la congruencia entre la sospecha diagnóstica de quemodectoma emitida tras la ecocardiografía y el diagnóstico definitivo histopatológico. Adicionalmente, los quemodectomas son neoplasias no funcionales de las células paragangliales, quimiorreceptoras, por esto tienen un carácter benigno con un potencial metastático bajo.10 Los tumores de base cardiaca malignos invaden vasos o ganglios regionales y, menos frecuentemente (en un 7 % de los casos), pueden dar lugar a metástasis distantes en pulmón, glándulas adrenales, cerebro, hueso.5,7,11 No obstante, la aparición de metástasis no está asociada al tiempo o pronóstico de supervivencia de los perros que la padecen.11 Patnaik y Liu también detectaron incidencia de infiltración vascular (en el 46 % de los casos) e invasión local (43 %).7
Los tumores de base aórtica pueden producir derrame pericárdico, suponiendo un 10 % de las causas tumorales de derrames pericárdicos.5 El tratamiento inicial pasa por aliviar la sintomatología derivada del derrame pericárdico, ya sea por pericardiectomía, opción que los propietarios de nuestro paciente rehusaron, a pesar de que podría aumentar el pronóstico de vida hasta más de 22 meses,5,11 o pericardiocentesis, la cual finalmente realizamos. La resección quirúrgica también puede plantearse, pero la alta vascularización y asociación con los grandes vasos y nervios la dificulta.12 Se ha descrito también el tratamiento con quimioterapia como toracenib (Palladia®, Zoetis) en los que se sugiere un aumento de la supervivencia.13,14 También encontramos en la bibliografía más reciente tratamiento de ablación con radiofrecuencia15 y stenting vascular, en casos obstructivos.16,17 En nuestro caso, los propietarios rehusaron el uso de cualquier tipo de quimioterápicos.
En relación al pronóstico, la supervivencia media descrita en las estadísticas de Vicari y Brown8 para perros tratados médicamente (sin pericardiectomía) es de 129 +/- 51 días. Nuestro paciente sobrevivió por encima de la media de ese artículo, 180 días.
Fuente de financiación: este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de interés: los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Atkins C., Bonagura J., Etinger S. et al: Guidelines for the diagnosis and treatment of canine chronic valvular heart disease. J Vet Intern Med 2009; 23: 1142-1150.
[PubMed] - 2.
Chetboul V, Tissier R.: Echocardiographic assessment of canine degenerative mitral valve disease. J Vet Cardiol 2012; 14(1): 127-48.
[PubMed] - 3.
Chetboul V, Pouchelon JL, Menard J, et al.: TEST study investigators. Short-Term Efficacy and Safety of Torasemide and Furosemide in 366 Dogs with Degenerative Mitral Valve Disease: The TEST Study. J Vet Intern Med 2017; 31(6): 1629-1642.
[PubMed] - 4.
Besche B, Blondel T, Guillot E, et al.: Efficacy of oral torasemide in dogs with degenerative mitral valve disease and new onset congestive heart failure: The CARPODIEM study. J Vet Intern Med 2020; 34(5): 1746-1758.
[PubMed] - 5.
Rajagopalan V., Jesty S.A., Craig L.E., and Gompf R.: Comparison of Presumptive Echocardiographic and Definitive Diagnoses of Cardiac Tumors in Dogs. J Vet Intern Med 2013; 27: 1092-1096.
[PubMed] - 6.
Montgomery D.L., Bendele R. and Storts R.W.: Malignant aortic tumor with metastasis to bone in a dog. Vet. Pathol 1980; 17: 241-244.
[PubMed] - 7.
Patinaik A. K., Liu S. -K., Hurvitz A. I. and Mcclelland.A. J.: Canine chemodectoma (extra-adrenal paragangliomas) - a comparative study. J. small Anim. Pract. 1975; 16: 785-801.
[PubMed] - 8.
Pedro B., Linney C.,. Navarro-Cubas X, et al.: Cytological diagnosis of cardiac masses with ultrasound guided fine needle aspirates. J. Vet. Cardiol. 2016; 18: 47-56.
[PubMed] - 9.
Wendy A. and David L.: Cardiac Tumors in Dogs: 1982–1995 J Vet Intern Med 1999; 13: 95-103.
[PubMed] - 10.
Treggiari E., Pedro B., Dukes-McEwan J., A. Gelzer R and Blackwood L: A descriptive review of cardiac tumours in dogs and cats. Veterinary and comparative oncology 2015; 15(2): 273-288.
[PubMed] - 11.
Vicari E., Brown D., Holt D. and Brockman D.: Survival times of and prognostic indicators for dogs with heart base masses: 25 cases (1986–1999). J Am Vet Med Assoc 2001; 219 (4): 485-487.
[PubMed] - 12.
Obradovich JE, Withrow SJ, Powers BE, Walshaw R. Carotid body tumors in the dog. Eleven cases (1978-1988). J Vet Intern Med 1992; 6(2): 96-101.
[PubMed] - 13.
Shin HR, Kim JS, Kim SM, Song KH, Seo KW. Metronomic chemoterapy with toceranib phosphate for treatment of a chemodectoma in a dog. J Vet Clin 2017; 34(1): 43-46.
- 14.
Coto GM, Musser ML, Tropf MA, et al. A multi-institutional retrospective analysis of toceranib phosphate for presumed or confirmed canine aortic body chemodectomas. Front Vet Sci 2021; 8: 635057.
[PubMed] - 15.
Gómez Ochoa P, Alférez MD, de Blas I, et al. Ultrasound-Guided Radiofrequency Ablation of Chemodectomas in Five Dogs. Animals 2021; 11(10): 2790.
[PubMed] - 16.
Bussadori CM, Claretti M, Borgonovo S, et al. Branch pulmonary artery stent placement in a dog with heart base neoplasia. Journal of Veterinary Cardiology 2020; 30: 17-22.
[PubMed] - 17. [PubMed]
Weisse C, Scansen BA, Berent AC, Cober RE. Transatrial stenting for long-term management of cardiac tumor obstruction of the right atrium in 3 dogs. J Vet Intern Med 2021; 35(1): 120-129.