Miocardiopatía aguda en un perro con crisis addisoniana. A propósito de un caso clínico
Acute cardiomyopathy in a dog with Addisonian crisis. A case report
C. Torrente, I. Vigueras, C. Villaverde, A. Bassols
Contacto: carlos.torrente@uab.cat
Resumen
Un Bearded Collie, hembra de 10 años de edad es atendida de urgencia por cuadro clínico evolutivo de vómito, letargia y debilidad progresiva. Al examen físico, la paciente presenta depresión, bradicardia severa e hipotensión. El resultado de las pruebas diagnósticas confirma la presencia de azotemia, hiperpotasemia, hiponatremia así como de hipocortisolemia pre y post estimulación con ACTH. El diagnóstico es de crisis addisoniana por lo que se instaura tratamiento con fluidos cristaloides isotónicos y bolos de gluconato de calcio 10%, dextrosa 40% e insulina regular con el objetivo de corregir los signos de cardiotoxicidad asociada a la hiperpotasemia. La condición de la paciente mejora parcialmente, y la terapia con corticoides se inicia de inmediato con la aplicación de dexametasona intravenosa y fludrocortisona por vía oral, transcurridas doce horas tras la admisión. El día 2, la actitud de la paciente mejora, pero persiste la bradicardia sinusal y presenta disnea de aparición aguda. El análisis de gases confirma la presencia de hipoxemia severa e hiperlactatemia. Las concentraciones en sangre de troponina cardíaca, concentraciones seriadas de lactato y relaciones de lactato/piruvato en conjunción con los hallazgos radiológicos, así como las medidas cardíacas realizadas en la ecocardiografía de urgencia, confirman la presencia de insuficiencia cardíaca congestiva secundaria a daño miocárdico agudo. La paciente responde favorablemente a la administración de tratamiento de soporte y oxigenoterapia por lo que, a pesar de la hiperlactatemia persistente, es dada de alta transcurridos seis días de su admisión. En la actualidad la paciente no presenta signo alguno de enfermedad cardíaca y el hipoadrenocorticismo se encuentra bajo control con tratamiento corticoide de substitución.
Palabras clave: Perro, Hipoadrenocorticismo, Fallo miocárdico.
Summary
A 10-year-old spayed female Bearded Collie was presented to the emergency service for evaluation of several days’ history of vomiting, lethargy, and progressive weakness. On presentation, the dog was obtunded, bradycardic, and hypotensive. Results of diagnostic work-up such as complete blood cell count, biochemistry panel (pre-renal azotemia, severe hyperkalemia, and hyponatremia), urinalysis, basal cortisol, and ACTH stimulation test were all consistent with an acute adrenal (Addisonian) crisis. The dog was initially treated with isotonic crystalloids and several bolus of calcium gluconate 10%, dextrose 40%, and regular insulin to correct the cardiotoxicity signs associated to the hyperkalemia. The patient’s condition improved partially and corticoid therapy was started immediately: dexamethasone IV initially and fludrocortisone PO 12h post-admission. On Day 2, the patient’s attitude was better and the electrolyte imbalance was completely corrected, but sinus bradycardia persisted and severe respiratory distress appeared, with arterial blood gas analysis revealing severe hypoxemia and hyperlactatemia. Blood concentrations of cardiac troponin, serial concentrations of lactate and lactate/pyruvate ratios in conjunction with findings on thoracic X-rays and several cardiac measures performed on emergency echocardiography confirmed the presence of congestive heart failure secondary to acute myocardial damage. Despite persistent hyperlactatemia, the patient’s condition improved clinically and was finally discharged 6 days after admission. Currently the patient has no signs of cardiac disease and Addison’s disease is under control with corticosteroid treatment.
Keywords: Dog, Hypoadrenocorticism, Myocardial failure.
Introducción
El hipoadrenocorticismo (HA) o enfermedad de Addison es una enfermedad poco común en la especie canina cuya incidencia, aunque variable, se ha reportado cercana al 0,5%.1,2 Esta enfermedad endocrina resulta del daño, con frecuencia immunomediado, del tejido adrenal que ocasiona la síntesis deficiente de gluco y mineralocorticoides.1-3 El HA espontáneo se presenta con mayor frecuencia en hembras jóvenes o de mediana edad y con cierta predisposición racial: West Highland White Terrier, Springer Spaniel, Perro de Aguas Portugués, Caniche y Bearded Collie,1,3-5 entre otras. Los signos clínicos son inespecíficos y variables en severidad, por lo que pueden presentarse desde pacientes afectados con leves cuadros de sintomatología gastrointestinal a pacientes en shock y colapso agudo con bradiarritmias severas.1-4 La deshidratación, la presencia de signos de hipoperfusión generalizada y la bradicardia, son hallazgos de exploración frecuentes en la presentación emergente de esta enfermedad. Con frecuencia, el componente cardíaco se atribuye a la presencia de anomalías en la conducción cardíaca, secundarias a los desequilibrios electrolíticos (hiponatremia e hiperpotasemia) que comúnmente caracterizan esta urgencia endocrina. Sin embargo, en medicina humana se han descrito recientemente diversos casos de pacientes con cardiomiopatía primaria reversible, directamente vinculada a la deficiencia hormonal y caracterizada fundamentalmente por la presencia de disfunción sistólica aguda.6-9 El presente caso es, atendiendo al conocimiento de los autores, la primera descripción de un caso similar en la especie canina.
Caso clínico
Bearded Collie, hembra castrada de 10 años de edad y 19 kg de peso. La paciente es atendida por el Servicio de Urgencias presentando un cuadro de anorexia progresiva, náuseas, vómitos, letargia y debilidad del tercio posterior. Al examen físico presenta depresión, ligera hipotermia (37,4 ºC), bradicardia (46 lpm), ausencia de soplo o arritmia apreciables a la auscultación, palidez de membranas mucosas, prolongación del tiempo de relleno capilar (TRC) de >2”, pulso débil, prolongación del pliegue cutáneo y molestias a la palpación abdominal. El examen neurológico revela la presencia de depresión mental, pero ausencia de anomalías posturales, en la marcha o en el tono muscular, así como ausencia también de anormalidades en las reacciones posturales, reflejos espinales, sensación dolorosa o examen de pares craneales.
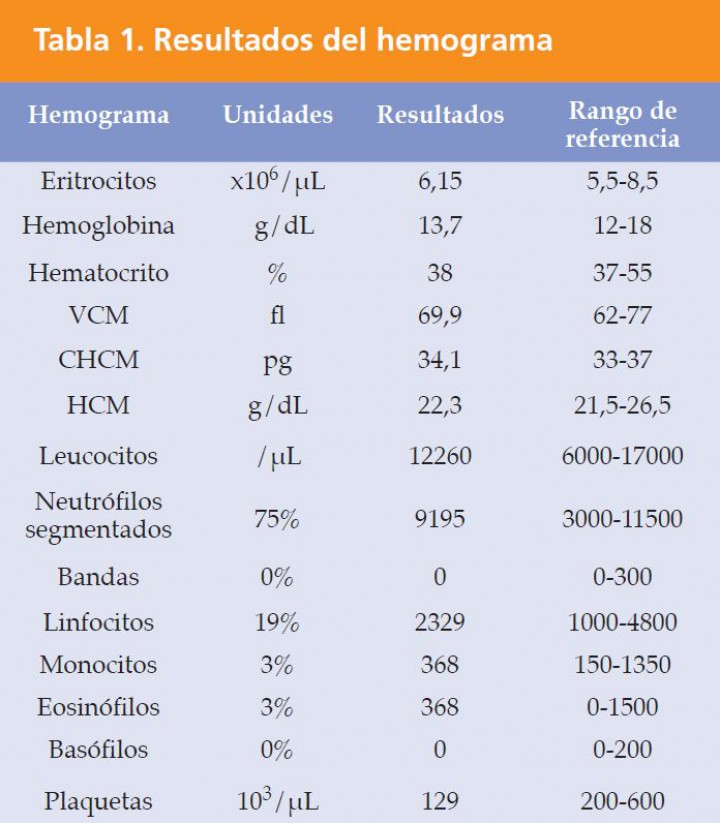
Durante la admisión en el Servicio de Urgencias se extraen a la paciente diversas muestras, tanto de sangre como de orina, para su análisis posterior y se realiza un examen electrocardiográfico, confirmado la existencia de paro auricular intermitente y alteraciones morfológicas compatibles con anomalías en la conducción cardíaca: ausencia de ondas P, prolongación de los complejos QRS y elevación de ondas T. La determinación de la presión arterial sistólica mediante Doppler (Ultrasonographic Doppler flow detector, Parks Medical Electronics Inc, Aloha, OR, USA) confirma la presencia de hipotensión: presión arterial sistólica (PAS) de 75 mmHg (80-120 mmHg). El resultado de las analíticas de urgencia practicadas durante la evaluación inicial de la paciente es el siguiente; hematocrito: 38% (35-55%), proteínas totales: 6,4 g/dL (6-8 g/dL), glucosa: 90,2 mg/dL (65-118 mg/dL), lactato: 1,0 mmol/L (0,6-2,5 mmol/L), Na+: 123,7 mmol/L (141-152 mmol/L), K+: 8,8 mmol/L (4,37-5,34 mmol/L) y ratio Na+/K+: 14.
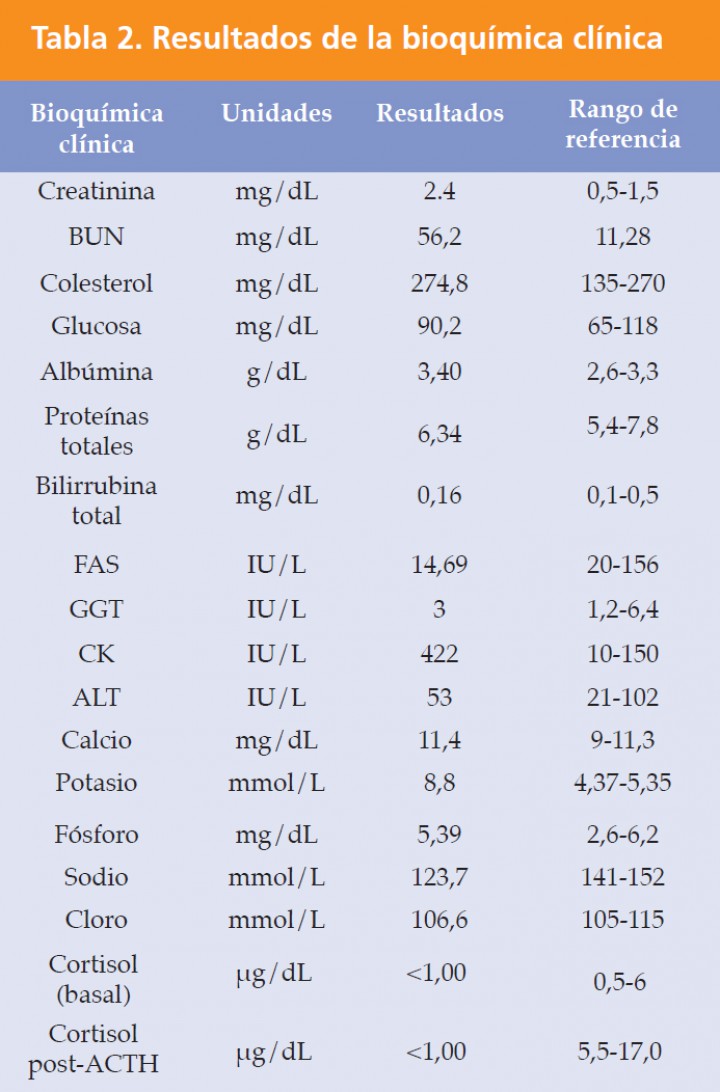
Tras colocar al paciente un catéter intravenoso periférico, se inicia la administración de fluidos isotónicos de reemplazo. Inicialmente se administra un bolo de 20 ml/kg de NaCl 0,9% (suero salino fisiológico 0,9%, B. Braun Medical S.A., Barcelona, España). Simultáneamente se administra un bolo lento de 0,75 ml/kg/IV de gluconato cálcico al 10% (Gluconato Cálcico 10%, B. Braun Medical S.A., Barcelona, España), un bolo de 1 g/kg/IV de glucosa al 40% (Glucosado 40%, B. Braun Medical S.A., Barcelona, España ) y 0,1 UI/Kg/IV de insulina regular (Humulina regular, Novo Nordisk A/S, Bagsvaerd, Denmark) para corregir los efectos cardiotóxicos derivados y disminuir la concentración de potasio sérico. Tras la aplicación de fluidos, la frecuencia cardiaca asciende a 110 lpm y la PAS es de 95 mmHg. El protocolo analítico posterior incluye la realización de un hemograma, bioquímica sanguínea completa, análisis de gases sanguíneos y determinación de cortisol basal. La única anormalidad detectada en el hemograma es una ligera trombocitopenia: 129 x 106/L (200-600 x 106/L) (Tabla 1). La bioquímica revela la presencia de azotemia: creatinina de 2,44 mg/dL (0,5-1,5 mg/dL) y BUN de 20,5 mmol/L (4,0-10,2 mmol/L), así como ligera hipercalcemia: calcio total de 11,4 mg/dL (9-11,3 mg/dL). El análisis de gases venoso denota la presencia de acidosis metabólica con compensación respiratoria: pH 7,28 (7,32-7,43), H2CO3: 12,1 mmol/L (18-26 mmol/L), SBE: -15 mmol/L (-4/+1 mmol/L) y pCO2: 35,7 mmHg (37-45 mmHg). La concentración basal de cortisol confirma la presencia de hipocortisolemia: <1,00 µg/dL (0,5-6 µg/dL) (ver Tabla 2).
VCM: volumen corpuscular medio; CHCM: concentración de hemoglobina corpuscular media; HCM: hemoglobina corpuscular media.
BUN: nitrógeno ureico en sangre, FAS: fosfatasa alcalina; GGT: gamma-glutamil transpetidasa; ALT: alanina aminotranferasa; CK: creatina quinasa; ACTH: hormona adrenocorticotropa.
Dada la sospecha clínica de HA, se realiza un test de estimulación con ACTH, resultando la cortisolemia post-estimulación (<1 µg/dL) muy por debajo del rango de normalidad (5,5-17 µg/dL). Finalmente, el análisis de orina revela la presencia de ligera hiperestenuria (USG: 1,040) y trazas de proteinuria. Atendiendo a los resultados de las pruebas diagnósticas realizadas se establece un diagnóstico de crisis addisoniana, por lo que se inicia el tratamiento con fosfato sódico de dexametasona (Dexametasona, Laboratorios Calier S.A., Barcelona, Spain.) a dosis de 2 mg/kg/IV. Durante su estabilización y estancia en la Unidad de Cuidados Intensivos la paciente es monitorizada a nivel respiratorio, hemodinámico y analítico (Na+, K+, Cl-, calcio, magnesio y glucosa) cada 1-4 h durante las primeras 24h de hospitalización. El soporte de fluidos con soluciones cristalinas de reemplazo se reduce de forma paulatina a lo largo de las primeras horas de tratamiento, permaneciendo la paciente hemodinámicamente estable. Sin embargo, la hiperpotasemia persiste, por lo que se administra una segunda dosis de insulina regular (0,25 IU/kg/IV) y Glucosado al 40% (0,25g/Kg/IV), así como una segunda dosis de dexametasona (1 mg/kg/IV). Diez horas después de su admisión, las concentraciones de creatinina y potasio se normalizan con lo que se inicia en la paciente una pauta conservadora de fluidos (NaCl 0,9% suplementado con glucosa al 2,5%) a velocidad de 3,5 ml/kg/h. La terapia oral con acetato de fludrocortisona (Fludrocortisona, Merk S.L., Barcelona, España) es iniciada a posteriori a dosis de 0,01 mg/kg/PO q12h. Otras medicaciones administradas durante el primer día de tratamiento son maropitant (Maropitant, Pfizer Limited, Kent,United Kingdom) a dosis de 1 mg/kg SQ q 24h, sucralfato (Sucralfato, Merk S.L., Barcelona, España) a 0,5 mg/PO q 8h, y omeprazol (Omeprazol, AstraZeneka AB, Södertälje, Sweden) a 0,7 mg/kg IV q 24h.
Una vez estabilizada la paciente, se procede a proseguir con el protocolo de pruebas diagnósticas (diagnóstico por la imagen). Las radiografías torácicas no revelan hallazgos significativos y el examen ecográfico abdominal únicamente un ligero agrandamiento de la vesícula biliar, hipomotilidad gastro-duodenal y no se visualizan ambas adrenales.
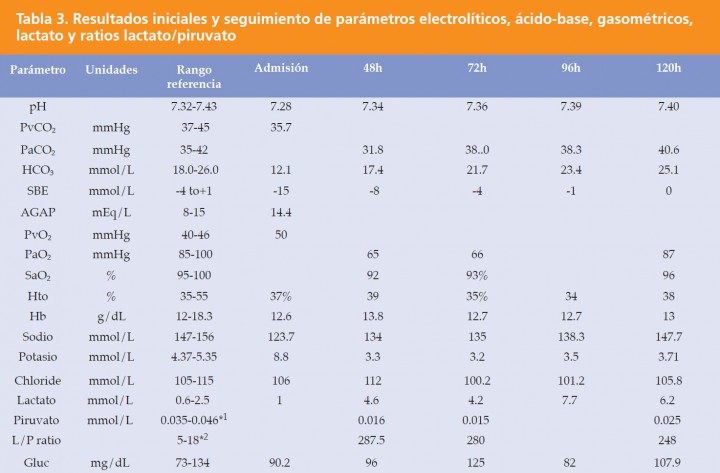
A lo largo del segundo día de ingreso, la paciente presenta una mejoría clínica significativa por lo que se decide reducir el aporte de fluidos a necesidades de mantenimiento y ofrecer libre acceso a la ingesta voluntaria de agua y comida. Durante la noche del segundo día, presenta taquipnea de aparición aguda (72 rpm), reluctancia al decúbito e incremento del murmullo vesicular a la auscultación de ambos hemitórax. La medición del grado de saturación por pulsioximetría revela valores cercanos a 85%, por lo que se extrae una muestra de sangre arterial para determinación de gases sanguíneos, confirmándose la presencia de hipoxemia severa: PaO2 de 65 mmHg (85-100 mmHg) y SaO2 de 92% (>95%) con ratios alveolo-arterial y PaO2/FiO2 de 47 (<10) y 309 (>400), respectivamente. El análisis de gases también revela la presencia de hipocapnia moderada: PaCO2 de 31,8 mmHg (35-42 mmHg) e hiperlactatemia: lactato de 4,6 mmol/L (0,6-2,5 mmol/L). En el examen radiográfico complementario, la paciente presenta un patrón difuso broncointersticial compatible con edema pulmonar. Dada la sospecha de fallo respiratorio hipoxémico secundario a adición venosa por sobrecarga circulatoria, se decide detener el aporte de fluidos intravenosos, administrar una dosis de furosemida (Seguril, Sanofi España, Barcelona, España) a 0,25 mg/kg/IV y administrar oxigenoterapia mediante gafas nasales a 100-150 ml/kg/min. Durante la mañana del día siguiente (3er día), se realiza el estudio ecocardiográfico de la paciente, detectándose una fracción de acortamiento y una fracción de eyección en el rango bajo de normalidad, 27% (25-45%)10 y 53% (50-65%)10 respectivamente, así como un ratio diámetro atrio izquierdo/aorta (LA/Ao) ligeramente incrementado: 1,53 (<1,3)10. Tras el examen ecocardiográfico se obtiene una muestra de sangre para determinaciones de troponina cardíaca (cTnI) y creatina kinasa (CK). La sospecha de fallo agudo miocárdico se confirma atendiendo a los resultados de troponina obtenidos: 50 ng/ml (<0,06). Durante las siguientes 48 h el paciente permanece en la UCI con oxigenoterapia mediante sonda nasal (FiO2 40%). Los parámetros de oxigenación de la paciente mejoran, pero la concentración de lactato se mantiene por encima del rango de normalidad a pesar de la gradual normalización de los parámetros hemodinámicos y de oxigenación (Tabla 3). La concentración de lactato se incrementa dramáticamente (hasta 7,7 mmol/L) en el 4º día de hospitalización, permaneciendo por encima del rango de referencia durante el resto de su estancia hospitalaria. Con el objetivo de determinar la patogénesis de la hiperlactatemia que presenta la paciente, se decide determinar la concentración simultánea de piruvato11 y ratio lactato/piruvato (L/P) de varias de las determinaciones de lactato realizadas, en concreto de muestras correspondientes a los días 2, 3 y 5 (ver Tabla 3). El resultado de tales mediciones confirma la existencia en la paciente de una hiperlactatemia de tipo A (HLTA), probablemente secundaria a hipoxia tisular. Considerando la mejora general del estado del paciente, la ausencia de signos de hipoperfusión generalizada y la documentada lesión miocárdica, los autores atribuyen a la lesión cardíaca la génesis mayoritaria de la hiperlactatemia.
PvCO2: presión venosa parcial de dióxido de carbono; SBE: defecto o exceso de base estandarizado; AGAP: desfase aniónico; PvO2: presión venosa parcial de oxígeno; PavO2: presión parcial arterial de oxígeno; Hto: hematocrito; Hb: hemoglobina; L/P ratio: ratio lactato/piruvato; Gluc: glucosa.
*1 El rango de referencica para el piruvato se estableció en base a muestras de sangre de perros sanos.
*2 El rango de referencia utilizado es de medicina humana.11
Al cabo de seis días la paciente es dada de alta, mostrando una recuperación clínica y analítica completa a excepción de una hiperlactatemia moderada y persistente, que se normaliza finalmente transcurridos 20 días del alta hospitalaria. En la actualidad la paciente no presenta signos de patología cardíaca y el HA se encuentra bajo control con el tratamiento habitual de reemplazo, tanto mineral como glucocorticoide.
Discusión
Los perros con HA con frecuencia presentan signos clínicos inespecíficos y, a menudo, las implicaciones cardíacas de esta enfermedad se atribuyen a los desequilibrios electrolíticos y metabólicos que habitualmente caracterizan esta urgencia endocrina. El compromiso hemodinámico caracterizado por la depleción del volumen circulante y el bajo gasto cardíaco es habitual en la crisis addisoniana, pero la recuperación de la función cardiovascular habitualmente se restablece de forma rápida, una vez es instaurada la terapia de substitución con esteroides. A pesar de ello, en medicina humana se han descrito diversos casos de disfunción cardíaca aguda como complicación asociada a esta patología.6-9,12-14 La miocardiopatía por estrés (Broken heart syndrome), también denominada miocardiopatía de Takotsubo, es un síndrome cardíaco caracterizado por la presencia de disfunción ventricular aguda asociada a estrés (físico o psíquico) en ausencia de obstrucción coronaria.8,15 En el caso de pacientes humanos con crisis addisoniana, se ha teorizado que el daño miocárdico puede estar asociado al efecto tóxico que las catecolaminas circulantes tienen sobre el músculo cardíaco en ausencia del efecto cardioprotector de los glucocorticoides. En estos pacientes, la elevada concentración de catecolaminas induce vasoespasmo de la microcirculación coronaria y por ende disfunción miocárdica, afectando predominantemente a la región apical del ventrículo izquierdo. Además del efecto descrito de las catecolaminas, también se ha postulado que las deficiencias encontradas en el transporte de calcio a nivel del retículo sarcoplásmico del músculo cardíaco, podrían contribuir a explicar el daño miocárdico en pacientes con esta urgencia endocrina.16,17 El papel adicional que pudieran desempeñar otros factores, tales como la inflamación del propio miocardio durante la crisis adrenal o la influencia de fenómenos vinculados a la isquemia-reperfusión asociados a la presentación de la crisis addisoniana, están hoy todavía por dilucidar.15,18,19 En nuestra paciente, la elevada concentración de troponina cardíaca confirma la presencia de lesión en el músculo cardíaco y por tanto puede corroborar la vinculación descrita en la bibliografía humana entre crisis addisoniana y daño miocárdico. A pesar de ello y teniendo en cuenta los resultados ofrecidos por la ecocardiografía de urgencia realizada en nuestra paciente, en nuestro caso no es posible confirmar la presencia de una disfunción sistólica generalizada. En medicina humana diversas técnicas de diagnóstico por la imagen, tales como la angiografía coronaria20 o el examen Doppler tisular,21 se utilizan para evaluar con más detalle la función miocárdica y el grado de afectación sistólica. En opinión de los autores (aunque dichas técnicas no están al alcance de la mayoría de veterinarios clínicos), estudios ecocardiográficos más pormenorizados con mediciones más específicas (p.e. índice de volumen sistólico final (ESVI) o velocidad de acortamiento circunferencial del ventrículo izquierdo (Vcf)),22 podrían haber sido más adecuados a la hora de evaluar las prestaciones sistólicas del miocardio y detectar posibles deficiencias en nuestro caso.
Otra posible explicación de la particular presentación de nuestra paciente podría estar relacionada con la iniciación de la terapia con mineralocorticoides (fludrocortisona). En algunas referencias de medicina humana se hipotetiza que en pacientes con HA existe una adaptación renal a las pérdidas crónicas de agua y sodio que, en condiciones de restablecimiento agudo de la terapia con mineralocorticoides, puede verse sobrepasada, generando la retención aguda de agua y sodio e induciendo sobrecarga circulatoria y, por ende, fallo cardíaco congestivo.23-25 En este sentido, la sobrecarga del atrio izquierdo y la consecuente elevación del ratio diámetro atrio izquierdo/aorta (en ausencia de anomalías valvulares) que denotaba nuestra paciente, podría corroborar dicho argumento. Aunque la presentación particular de nuestro paciente no es estrictamente compatible con una sobrecarga circulatoria pura, dado que se ha documentado la elevación de biomarcadores cardíacos, la instauración del tratamiento con fludrocortisona podría haber influido en tal presentación. La hipervolemia relativa y sobrecarga circulatoria podrían haber generado la expansión del intersticio pulmonar, condicionado el flujo de gases a nivel transcapilar y disminuyendo la captación de oxígeno. A pesar de ello, en opinión de los autores, la magnitud y duración de la hipoxemia vinculada a tal fenómeno no justificaría la magnitud del daño miocárdico documentado (en términos de severidad).
La hiperlactatemia y la acidosis láctica también son hallazgos frecuentes en el paciente con crisis addisoniana. La HLTA se atribuye a condiciones de transporte insuficiente de oxígeno a los tejidos y comúnmente a fenómenos de hipoperfusión tisular asociados a hipovolemia concurrente.26,27 Esta es la causa más prevalente de hiperlactatemia en el paciente con crisis addisoniana, y con frecuencia requiere de la aplicación de fluidoterapia emergente, oxigenoterapia, e incluso de la administración de hemoderivados para su resolución. Sin embargo, existen otras causas que conducen a hiperlactatemia no vinculada a hipoxia tisular o tipo B. La acidosis láctica tipo B (HLTB) acontece en condiciones de transporte tisular de oxígeno adecuado, por degradación de lactato alterada, disfunción mitocondrial o presencia de drogas/toxinas que interfieren en la fosforilación oxidativa o el metabolismo energético celular.26,27 De hecho, el uso de dosis terapéuticas de glucocorticoides puede resultar en hiperlactemia de este tipo significativa, dados sus conocidos efectos sobre el metabolismo de los carbohidratos y el propio lactato.28,29 Considerando que los glucocorticoides favorecen la utilización de aminoácidos y su conversión a piruvato, el incremento en las concentraciones tanto de piruvato como de lactato puede apreciarse en pacientes bajo corticoterapia.28,30 Por el contrario, durante la hipoxia celular, la alteración del estado redox (acidosis) del tejido hipoperfundido favorece la formación de lactato en detrimento de las concentraciones de piruvato.31 El hallazgo de ratios L/P incrementados en el paciente es, por tanto, indicativo de hipoxia celular.31
De hecho, en medicina humana este ratio se ha descrito como un buen marcador de isquemia tisular,31-33 siendo los ratios L/P ≥25 indicadores sensibles de metabolismo anaerobio.33
Por lo que respecta a la génesis de la hiperlactatemia en nuestra paciente, la determinación seriada de concentraciones de lactato, piruvato y ratios L/P a lo largo del periodo de hospitalización y el seguimiento ambulatorio, permitieron confirmar la vinculación de la hiperlactatemia a fenómenos de hipoperfusión regional o hipoxia tisular (HLTA), descartando la posibilidad de hiperlactatemia iatrogénica derivada de la corticoterapia (HLTB). En nuestro caso, considerando la ausencia de signos de hipoperfusión generalizada, la elevación del lactato podría explicarse en base a la lesión miocárdica detectada.
En opinión de los autores, tales hallazgos sugieren la necesidad de evaluar cuidadosamente el estado hemodinámico, el plan de fluidos y la función sistólica en pacientes con crisis addisoniana, incluso en situaciones en las que ya han sido corregidos los desequilibrios electrolíticos y las anomalías de la conducción cardíaca que comúnmente caracterizan esta urgencia endocrina.
Agradecimientos
Los autores quieren agradecer especialmente a los doctores Xavier Roura, Oriol Domènech y Jordi López, su asesoramiento y colaboración en la evaluación de las pruebas diagnósticas realizadas a la paciente.
Fuente de financiación: Esta investigación no se realizó con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: Los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Feldman EC, Nelson RW. Hypoadrenocorticism (Addison’s disease). Canine and Feline Endocrinology and Reproduction. 3rd ed. St. Louis, Missouri, WB Saunders, 2004:394–439.
- 2.
Reusch CE. Hypoadrenocorticism. En Ettinger SJ, Feldman EC, eds. Textbook of Veterinary Internal Medicine. 5th ed. Philadelphia, WB Saunders, 2000:1488–1499.
- 3.
Klein S, Peterson M. Canine Hypoadrenocorticism: Part I. Can Vet Journal 2010; 51:63-69.
- 4.
Klein S, Peterson M. Canine Hypoadrenocorticism: Part II. Can Vet Journal 2010; 51:179-184.
- 5.
Oberbauer A, Benemann K, Belanger J et al. Inheritance of hypoadrenocorticism in bearded collies. Am J Vet Res 2002; 63(5):643–647.
[PMC] - 6.
Wolff B, Machill K, Schulzki I et al. Acute reversible cardiomyopathy with cardiogenic shock in a patient with Addisonian crisis: A case report. Int J Cardiol 2007; 116(2):71-73.
[PubMed] - 7.
Sherlock M, Gittoes NJ, Arlt W. Adrenal crisis causing critical illness related reversible myocardial dysfunction. Clin Endocrinol 2008; 68(4):667-669.
[PubMed] - 8.
Punnam SR, Gourineni N, Gupta V. Takotsubo cardiomyopathy in a patient with Addison disease. Int J Cardiol 2010; 144(2):34-36.
[PubMed] - 9.
Krishnamoorthy A, Mentz RJ, Hyland KA, et al. A crisis of the heart: an acute reversible cardiomyopathy bridged to recovery in a patient with Addison’s disease. ASAIO J 2013; 59(6): 668-670.
[PubMed] - 10.
Luis Fuentes V. Echocardiography and Doppler ultrasound. In Tilley P, Smith FJ, Oyama M et al. Manual of Canine and Feline Cardiology, 4th ed. Philadelphia, WB Saunders, 2008: 78-98.
- 11.
Bergmeyer, Hans Ulrich. Methods of Enzymatic Analysis. Volume VI. 3rd ed. Wiley-Blackwell Ed, 1984: 570-577.
- 12.
Afzal A, Khaja F. Reversible cardiomyopathy associated with Addison’s disease. Can J Cardiol 2000; 16(3):377-379.
[PubMed] - 13.
Conwell LS, Gray LM, Delbridge RG et al. Reversible cardiomyopathy in paediatric Addison’s disease--a cautionary tale. J Pediatr Endocrinol Metab 2003; 16(8):1191-1195.
[PubMed] - 14.
Wiltsaer E, Wilson R, Pringle K. Addison’s disease presenting with an acute abdomen and complicated by cardiomyopathy. J Paediatr Child Health 2004; 40, 644–645.
- 15.
Wittstein I, Thiermann D, Lima J et al. Neurohormonal features of myocardial stunning due to sudden emotional stress. The New Engl J Med 2005; 352(6); 539-548.
[PubMed] - 16.
Narayanan N. Effects of adrenalectomy and in vivo administration of dexamethasone on ATP-dependent calcium accumulation by sarcoplasmic reticulum from rat heart. J Mol Cell Cardiol 1983; 15: 7–15.
[PubMed] - 17.
Narayanan N, Khandelwal RL. Microsomal phosphorylase in rat heart: depletion following adrenalectomy and restoration by in vivo administration of dexamethasone. Endocrinology 1985; 117: 1544–9.
[PubMed] - 18.
Kurisu S, Inoue I, Kawagoe T, et al. Time course of electrocardiographic changes in patients with takotsubo syndrome: comparison with acute myocardial infarction with minimal enzymatic release. Circ J 2004; 68:77–81.
[PubMed] - 19.
Bybee KA, Prasad A, Barsness GW, et al. Clinical characteristics and thrombolysis in myocardial infarction frame counts in women with transient left ventricular apical ballooning syndrome. Am J Cardiol 2004; 94:343–346.
[PubMed] - 20.
Dodge J, Sheehan F. Quantitative contrast angiography for assessment of ventricular performance in heart disease. J Am Coll Cardiol 1983; 1(1): 73-81.
[ScienceDirect] - 21.
Tekten T, Onbasili A, Ceyhan C et al. Novel approach to measure myocardial performance index: pulse-wave tissue Doppler echocardiography. Ecocardiography 2003; 20(6); 503-510.
[PubMed] - 22.
Ware W. Introduction and normal reference information: overview of echocardiography. Cardiovascular disease in small animal medicine. 3rd ed. London, Manson Publishing Ltd, 2011:68-88.
- 23.
Willis FR, Byrne GC, Jones TW. Fludrocortisone induced heart failure in Addison’s disease. J Paediatr Child Health 1994; 30(3):280-281.
[PubMed] - 24.
Derish M, Eckert K, Chin C. Reversible cardiomyopathy in a child with Addison’s disease. Intens Care Med 1996; 22: 460–463.
[Springer] - 25.
Bhattacharyya A, Tymms DJ. Heart failure with fludrocortisone in Addison’s disease. J R Soc Med 1998; 91(8):433-434.
[PubMed] - 26.
Allen S, Holm J. Lactate: physiology and clinical utility. J Vet Emerg Crit Care 2008; 18(2):123-132.
[JorVet] - 27.
Kraut J, Madias N. Lactic acidosis. N Engl J Med 2014; 371(24): 2309-2319.
[NEJM] - 28.
Henneman DH, Bunker JP. The pattern of intermediary carbohydrate metabolism in Cushing’s syndrome. Am J Med 1957; 23(1):34–45.
[PubMed] - 29.
McMahon M, Gerich J, Rizza R. Effects of glucocorticoids on carbohydrate metabolism. Diabetes Metab Rev 1988; 4(1):17–30.
[PubMed] - 30.
Forbath JD, Hall D, Hetenyi JR. The effect of methyl-prednisolone on the turnover of lactate and the conversion of lactate to glucose in dogs. Horm Metab Res 1969; 1(4):178–182.
[Thieme] - 31.
Hotchkiss RS, Karl IE. Reevaluation of the role of cellular hypoxia and bioenergetic failure in sepsis. J Am Med Assoc 1992; 267(11):1503–1510.
[PubMed] - 32.
Solberg HE. Establishment and use of reference values. Tietz NW. Fundamentals of Clinical Chemistry. Philadelphia, WB Saunders, 1987: 202-212.
- 33.
Waelgaard L, Dahl BM, Kvarstein G, et al. Tissue gas tension and tissue metabolites for detection of organ hypoperfusion and ischemia. Acta Anaesthesiol Scand 2012, 56(2):200–209.
[ResearchGate]