La formulación de medicamentos individualizados en veterinaria. Aspectos legales relevantes
Compounding drugs in veterinary medicine. A review of relevant legal aspects
Contacto: dflores@usj.es
Resumen
En el presente artículo de revisión presentamos los aspectos más relevantes en relación a una alternativa terapéutica poco conocida y utilizada por el profesional veterinario. En nuestra profesión, el medicamento industrializado cubre las necesidades farmacoterapéuticas de un enorme espectro de patologías, pero es bien sabido que ocasionalmente se nos presentan situaciones excepcionales en las que las necesidades terapéuticas de un determinado paciente pueden no estar total o adecuadamente cubiertas por la industria. En la presente revisión recogemos el contexto económico y legal del proceso de fabricación industrial del medicamento veterinario, así como sus principales diferencias y similitudes en relación a la formulación magistral de medicamentos individualizados para veterinaria. Destacamos de esta opción terapéutica sus aspectos más relevantes en relación a la calidad y la seguridad en su producción en la oficina de farmacia, así como los aspectos legales relativos a la cascada de prescripción en casos excepcionales de vacíos terapéuticos, donde la formulación magistral puede ser útil para el clínico veterinario como complemento, y nunca como sustitución, del medicamento industrializado.
Palabras clave: Medicamento individualizado, formulación magistral, prescripción excepcional, animales de compañía.
Clin. Vet. Peq. Anim, 2017, 37 (1): 7 - 14
Summary
In the present review, we highlight the most relevant aspects regarding a sadly unknown therapeutic alternative very rarely used by the veterinary professional. In our profession, the industrialized drug covers the pharmacotherapeutic needs of a huge spectrum of pathologies. It is well known that eventually, many veterinarians are presented with exceptional situations in which the therapeutic needs of a particular patient may not be fully or adequately covered by the industry. In the present review we present the economic and legal context of the industrial manufacturing process of the veterinary drugs, as well as its main differences and similarities in relation to the compounding of individualized veterinary drugs, highlighting for this therapeutic option the most relevant aspects in relation to the quality and safety in its production at the community pharmacy, as well as the legal aspects related to the cascade of prescription in exceptional cases of therapeutic voids, where the compounding of drugs can be useful for the veterinary clinician as a complement, and never as a substitute, of the industrialized medicine.
Keywords: Individualized medicines, compounding, exceptional prescription, pets.
Clin. Vet. Peq. Anim, 2017, 37 (1): 7 - 14

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
No cabe duda de que el desarrollo industrial de los medicamentos en el ámbito de la veterinaria ha contribuido significativamente a la mejora de la salud y el bienestar de nuestras mascotas,1 además de dotar al veterinario clínico de pequeños animales de herramientas diagnósticas y terapéuticas de gran valor. Pero no es menos cierto que los nuevos retos del mercado, así como las exigencias legales en cuanto a calidad y seguridad de sus productos, han ejercido una presión sobre los principales laboratorios que les han llevado a potenciar una serie de medicamentos y a desestimar el desarrollo de otros, dejando vacíos terapéuticos en determinadas especies y para determinadas patologías.2 Especialmente complejos y determinantes son los aspectos normativos que regulan la fabricación de medicamentos individualizados.
El objetivo de este artículo es revisar los aspectos legales más relevantes que hacen de la opción terapéutica de la fórmula magistral una valiosa herramienta legalmente disponible para el veterinario clínico de alta calidad y seguridad.
La fabricación industrial de medicamentos veterinarios: aspectos legales y económicos relevantes
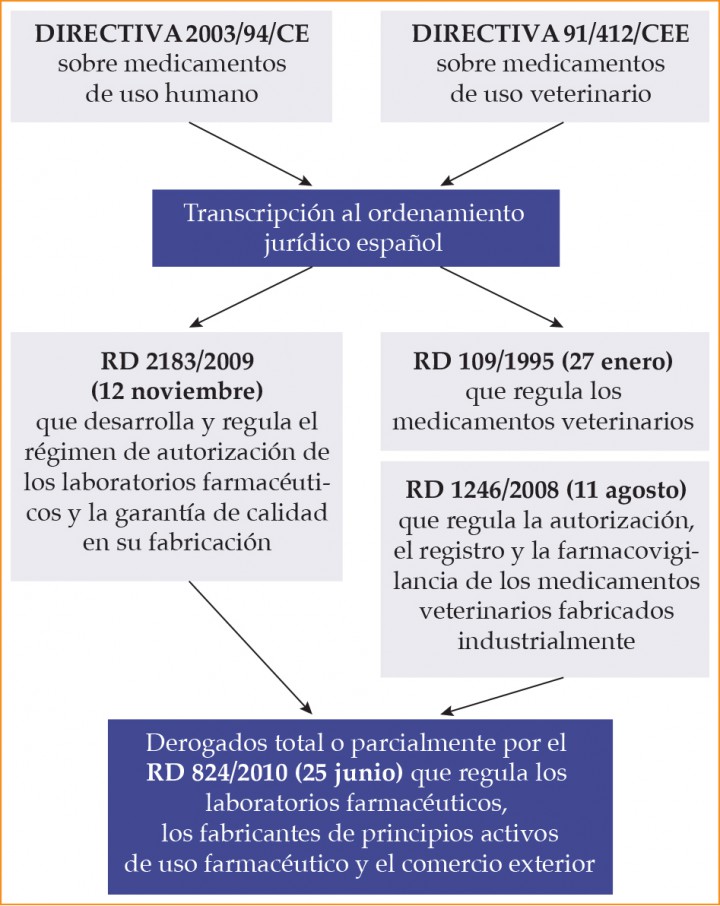
La industria farmacéutica, tanto humana como veterinaria, mantiene unos altos estándares para garantizar la calidad en el desarrollo, la fabricación y el control de los medicamentos. La autorización de fabricación es preceptiva para todo fabricante ubicado en la Unión Europea, independientemente de que sus productos sean vendidos dentro o fuera de ella. La existencia de un sistema para obtener una autorización de comercialización garantiza que los medicamentos sean evaluados por una autoridad competente para asegurar el cumplimiento de los requisitos vigentes relativos a seguridad, calidad y eficacia. Estas evaluaciones hacen especial hincapié en las Normas de Correcta Fabricación (NCF) aplicables a medicamentos de uso humano y veterinario y definidas como “la parte de la garantía de calidad que asegura que los medicamentos son elaborados y controlados de acuerdo con las normas de calidad apropiadas para el uso al que están destinados”. 3 Los principios de las NCF y el marco normativo de los que emanan (Fig. 1) son aplicables a todas las operaciones de autorización, fabricación, almacenaje, registro y farmacovigilancia de los medicamentos veterinarios fabricados industrialmente. En ellas se establecen una serie de exigencias técnicas, de calidad y de seguridad del medicamento veterinario tales como:
- Nuevos desarrollos de calidad, con métodos analíticos adaptados a la farmacopea vigente.
- Eliminación de asociaciones medicamentosas.
- Estudios de estabilidad completos a tres años.
- Realización de lotes piloto.
- Ensayos post-clínicos mediante la realización de ensayos “in vivo”.
- Realización de estudios toxicológicos, farmacoeconómicos y de impacto sobre la cadena alimentaria y el medioambiente equiparables a los exigidos al medicamento industrializado de uso humano.4
Figura 1
Principios de las Normas de Correcta Fabricación.
En relación a los costes de desarrollo y producción de fármacos veterinarios, no resulta sencillo encontrar cifras exactas de los mismos, dadas las numerosas variables que entran en juego y el recelo de los laboratorios a publicar dichas cifras por la alta competencia en el sector. En el caso de medicamentos humanos, se necesitan entre 10 y 15 años y unos 1000 millones de euros para fabricar, registrar y distribuir un nuevo fármaco.5 En este contexto, y aunque el enfoque de beneficio/riesgo de los medicamentos de uso humano es muy diferente al de los medicamentos veterinarios, podemos intuir que la inversión adicional en Investigación, Desarrollo e Innovación (I+D+i) de la industria farmacéutica veterinaria para la producción de sus productos requiere grandes cantidades de dinero, ya que han de someterse a los mismos y rigurosos procesos regulatorios que los medicamentos humanos y han de garantizar tanto la seguridad del consumidor como la del medioambiente.6
La formulación magistral de medicamentos individualizados: aspectos relevantes de calidad y seguridad
Durante tiempos inmemoriales, el ser humano ha recolectado plantas y otros elementos de la naturaleza para la preparación de remedios contra las enfermedades. Uno de los más antiguos tratados de medicina y farmacopea que se conoce data del antiguo Egipto (Papiro Ebers) y está fechado en el año 1500 antes de Cristo. Desde el mundo clásico (Grecia y Roma) hasta la segunda mitad del siglo XIX, la figura del farmacéutico era la figura clave en la elaboración y dispensación de preparados medicinales. Su actividad floreció en el Renacimiento propiciada por una revolución en los conocimientos farmacéuticos, que se consolida como ciencia en la Edad Moderna, cuando nacen y proliferan farmacopeas y formularios. La formulación magistral se constituye como base de la actividad farmacéutica, junto con la formulación oficinal. En la segunda mitad del siglo XIX, se crean los primeros medicamentos de síntesis y surgen los primeros laboratorios farmacéuticos. A partir de este momento, la fabricación industrial de medicamentos gana terreno a la formulación magistral, la cual quedó relegada e incluso desterrada de la práctica habitual de la medicina y la veterinaria.
En la actualidad, el incremento en la esperanza de vida de nuestras mascotas, la cronificación de muchas patologías antes inexistentes o que no se trataban, la mayor concienciación social por sus cuidados y la preocupación por su calidad de vida hacen que las expectativas de los propietarios hayan aumentado considerablemente. Así, el clínico veterinario se ve en la obligación de atender una serie de necesidades terapéuticas que no siempre se encuentran totalmente cubiertas por el mercado industrializado, debido a las presiones normativas y económicas detalladas en el apartado anterior. Es en casos como los mencionados a continuación en los que la formulación magistral puede ser una opción adecuada:7
- El medicamento sólo está disponible en ciertas dosis y se necesitan otras distintas debido a la naturaleza del paciente.
- El medicamento se ha dejado de preparar y ya no es posible encontrarlo o, si existe, no se puede disponer de él en el tiempo necesario sin poner en riesgo la salud del paciente o incluso su vida.
- La elaboración industrial (excipientes, colorantes, aditivos, saborizantes, etc.) no siempre es la más adecuada para nuestras mascotas, dificultad que se acentúa con la heterogeneidad y variabilidad de las especies que el veterinario debe tratar.
- Se necesita una forma farmacéutica o un vehículo no disponible en el mercado que posibilite la administración del principio activo por otra vía diferente a la del medicamento industrializado.
- Patologías poco frecuentes que por su baja incidencia o prevalencia se encuentran huérfanas de medicamentos específicos.
Estos serían sólo algunos ejemplos de las múltiples circunstancias que pueden presentarse al veterinario clínico y cuya solución supone un reto no siempre resuelto de forma satisfactoria.
Algunas de las dudas que le pueden surgir al veterinario clínico sobre el medicamento individualizado, producido y envasado por el farmacéutico en la botica del barrio, guardan relación con la calidad y la seguridad del mismo. La percepción mayoritariamente extendida entre los profesionales de la veterinaria es que nada es tan seguro ni de tanta calidad como el medicamento industrializado, ya que desconocen la estricta regulación y normalización que conlleva la elaboración de una fórmula magistral que la equipara, en seguridad y calidad, a la del medicamento industrializado.7
En primer lugar, para que una oficina de farmacia pueda fabricar y dispensar medicamentos individualizados debe ser aprobada por la Agencia Española del Medicamento y Productos Sanitarios (AEMPS).8 Para ello, debe demostrar a la Agencia que sus procesos de fabricación y control de calidad garantizan que son adecuados para el uso al que van a ser destinados, que cumplen con los requisitos de autorización y que no suponen ningún riesgo para los pacientes por una inadecuada seguridad, calidad o eficacia.9 Para conseguir esta finalidad, debe existir un Sistema de Calidad Farmacéutica diseñado de forma lógica y correctamente implantado que incorpore las Normas de Correcta Fabricación y la Gestión de Riesgos para la Calidad.
Los aspectos normativos que regulan la elaboración y el control de calidad de las fórmulas magistrales (FM) y preparados oficinales (PO) y aseguran así la calidad de los preparados son los siguientes:
- El Real Decreto 175/2001, de 23 de febrero, que reúne las tres definiciones esenciales en formulación magistral y la Ley 29/2006, de 26 de julio, de garantía de calidad y uso racional de los medicamentos y productos sanitarios que recoge sus requisitos de elaboración:
1. Fórmula magistral (FM). Medicamento destinado a un paciente individualizado, preparado por el farmacéutico, o bajo su dirección, para cumplimentar exactamente una prescripción facultativa detallada de las sustancias medicinales que incluye, según las normas de correcta elaboración y control de calidad establecidas al efecto, dispensado en una farmacia o servicio farmacéutico, y con la debida información al usuario. Los requisitos de las FM son:
- Ser preparadas con sustancias de acción e indicación reconocidas legalmente en España según las directrices del Formulario Nacional (FN) (Fig. 2).
- Si no se dispone de medios, se podrá pedir a entidades legalmente acreditadas por la autoridad sanitaria competente la realización de una o varias fases de elaboración y/o control de las FM.
- Se observarán las «Normas de correcta elaboración y control de calidad».
- Las FM irán acompañadas del nombre del farmacéutico que las prepare y de la información necesaria para su correcta identificación, conservación y utilización.
- Las FM para animales estarán prescritas por su veterinario y serán preparadas por el farmacéutico o bajo su dirección, en su oficina de farmacia.
Figura 2
La información galénica y farmacológica incluida en el Formulario Nacional es indispensable para la elaboración de medicamentos de calidad, seguros y eficaces.
2. Fórmula magistral tipificada (FMT). Recogida en el FN por su frecuente uso y utilidad. Por ejemplo: gotas óticas de ácido acético, jarabe de ipecacuana, colodión con ácido salicílico y ácido láctico, etc.
3. Preparado oficinal (PO). Medicamento preparado por un farmacéutico o bajo su dirección, dispensado en su oficina de farmacia o servicio farmacéutico, enumerado y descrito por el FN, destinado a su entrega directa a los enfermos a los que abastece dicha farmacia o servicio farmacéutico. Los requisitos son:
- Estar enumerados y descritos en el FN.
- Cumplir las normas de la Real Farmacopea Española (RFE).
- Ser elaborados por un farmacéutico o bajo su dirección y garantizados por el farmacéutico de la oficina de farmacia o del servicio farmacéutico que lo dispense.
- Deberán presentarse y dispensarse bajo principio activo (p. a.) o, en su defecto, con una denominación común o científica, o la expresada en el FN; nunca como marca comercial.
- Los PO irán acompañados del nombre del farmacéutico que los prepare y de la información necesaria para su correcta identificación, conservación y utilización.
- Excepcionalmente, las oficinas de farmacia y servicios farmacéuticos que no tengan los medios necesarios podrán pedir a entidades legalmente autorizadas por la administración sanitaria la realización de una o varias fases de la elaboración y/o control de calidad, pero solo de los PO que requieran prescripción.
- El Real Decreto 294/1995, de 24 de febrero se regulan la Real Farmacopea Española (RFE), el Formulario Nacional (FN) y los órganos consultivos del Ministerio de Sanidad en esta materia. Decreta que el FN contendrá las formulas magistrales tipificadas (FMT) y los preparados oficinales (PO) reconocidos como medicamentos. Establece que su actualización permitirá que los profesionales dispongan de un instrumento moderno adaptado a las nuevas exigencias del ejercicio tradicional de la preparación de FN y PO.
La legislación relativa al FN es la siguiente:
- Orden SCO/3262/2003, de 18 de noviembre, por la que se aprueba el Formulario Nacional. En diciembre de 2003 se publicó la primera edición por mandato de la Ley del medicamento.
- Orden SCO/3123/2006, de 29 de septiembre, por la que se actualiza el Formulario Nacional. En abril de 2007 se publicó la primera edición revisada y actualizada.
El personal que participa en la preparación de medicamentos en las oficinas de farmacia debe tener la cualificación y experiencia necesarias. De acuerdo con la legislación vigente:
- El farmacéutico tiene la responsabilidad sobre las preparaciones que se realicen en su oficina de farmacia y es el único profesional legalmente cualificado para manipular y producir medicamentos destinados a la especie humana o especies animales.
- La elaboración de preparados, así como las operaciones de control de calidad, pueden ser realizadas por el farmacéutico o por el personal técnico debidamente formado y cualificado bajo su control directo.
- El farmacéutico, según la formación y cualificación de su personal, debe atribuir las funciones a cada técnico por escrito, indicando la etapa de la preparación y del control de calidad en la que va a intervenir cada uno.
- El farmacéutico debe promover y actualizar la formación de su personal, procurando que alcance un nivel científico y técnico adecuado en todo lo referente a la elaboración correcta y el control de calidad de las FM y los PO.
Las normas de higiene del personal deben ser elaboradas y escritas por el farmacéutico, y recoger como mínimo:
- La prohibición de comer, fumar y mascar chicle, así como la de realizar prácticas antihigiénicas susceptibles de contaminar el lugar de preparación.
- La necesidad de utilizar armarios para guardar la ropa y los objetos personales.
- El uso de ropa adecuada según los tipos de preparación, como: bata estéril, gorro, calzado especial, guantes, mascarillas, calzas. Asimismo, es importante su renovación regular y siempre que sea necesario (Fig. 3).
- La suspensión temporal del trabajo a todo aquel que sufra lesiones en la piel o alguna enfermedad contagiosa.
Figura 3
Técnico con la vestimenta adecuada para trabajar en zonas limpias bajo campana de flujo laminar.
La prescripción veterinaria: cascada de prescripción o prescripción excepcional por vacío terapéutico
Hay estudios10 que ponen de manifiesto la confusión que genera la prescripción veterinaria y qué opciones medicamentosas existen para el veterinario clínico. La duda sobre la legalidad de la formulación magistral y su aplicabilidad en el ámbito veterinario existió durante años en determinados ambientes profesionales y ante la industrialización a gran escala del medicamento. A pesar de que la cascada de prescripción de medicamentos en animales está recogida explícitamente en la legislación española en el Real Decreto 1132/2010, siguen existiendo dudas sobre qué formas medicamentosas se pueden prescribir y cuándo hacerlo.
Opiniones corporativas aparte y a pesar de que existe una demanda por parte de algunos profesionales clínicos de una liberalización en la dispensación de los medicamentos de uso veterinario en España,11 el hecho fehaciente y recientemente ratificado por el Tribunal Supremo (en sentencia del 11 de noviembre del 2014) es que ningún centro, entidad o estructura alguna que no sea un laboratorio farmacéutico, una oficina de farmacia o un servicio de Farmacia Hospitalaria está capacitado legalmente para “fabricar, adaptar, acondicionar o manipular” medicamentos, incluidos el fraccionamiento, acondicionamiento y presentación de los mismos. Este hecho puede llegar a complicar tratamientos para los cuales no hay un producto adecuado en el mercado.
En este sentido y ante posibles vacíos terapéuticos como los ya presentados y comentados, el veterinario clínico puede hacer uso de la prescripción en cascada o prescripción excepcional por vacío terapéutico que viene recogida en el artículo 81 del Real Decreto 109/1995. Posteriormente, su redacción legal se ha modificado, siendo la diferenciación entre animales destinados, o no destinados, a producir alimentos de consumo humano la novedad más importante.
La última redacción es la que se incluye en el citado Real Decreto 1132/2010, de 10 de septiembre, por el que se modifica el RD 109/1995. En sus artículos 81 y 82 (Tabla 1) se recogen las condiciones para las prescripciones excepcionales por vacío terapéutico en los animales que no van a entrar en la cadena alimentaria y en los que sí van a usarse para producir alimentos, respectivamente.
La cascada de prescripción para animales no destinados al consumo humano, como los animales de compañía y los caballos de uso deportivo, sería como sigue: 12
- Medicamento veterinario registrado para la misma especie y la misma enfermedad (indicación). En este caso no hay prescripción excepcional, es la norma general.
- Si el anterior no existe, un medicamento veterinario con similar efecto terapéutico al deseado, registrado para su uso en la misma especie, pero para diferente enfermedad (indicación) o para su uso en una especie diferente.
- Si seguimos sin un producto disponible, tenemos dos nuevas opciones: un medicamento registrado en España para uso humano o un medicamento veterinario, con similar efecto terapéutico registrado en otro Estado miembro de la Unión Europea, para la misma o diferente enfermedad (indicación) y para la misma o diferente especie. Si, a pesar de todo, seguimos sin encontrar el producto adecuado, se puede prescribir una autovacuna de uso veterinario, un preparado oficinal o una fórmula magistral.
En este sentido, el veterinario clínico siempre debe hacer uso, en primer lugar, de los medicamentos industrializados veterinarios, pero la variabilidad de especies y de individuos dentro de las mismas que caracteriza a nuestro sector puede dificultar que un único medicamento se adapte a todas las necesidades de una población tan heterogénea. También puede darse el caso de un vacío terapéutico2 en el que la industria veterinaria no produzca un medicamento concreto, obligando al veterinario a utilizar medicamentos de uso humano que, por su forma de presentación o administración, tampoco se adapten a nuestros pacientes, o a medicamentos veterinarios que no se encuentren disponibles en nuestro país. Esta situación obliga a recurrir a la importación de los mismos, lo cual dificulta en gran medida los tratamientos, sobre todo de patologías crónicas tales como desequilibrios hormonales o tratamientos oncológicos, ya que dicho proceso burocrático de importación puede dilatarse varios días e incluso semanas.
Utilidades de la formulación en veterinaria
En numerosos países de nuestro entorno,13,14 la formulación magistral en la elaboración de medicamentos individualizados también ha sido fuente de controversias y dudas en el pasado, aunque su utilización en la actualidad es práctica habitual desde hace varios años.15 Ha proporcionado además a los veterinarios una mayor capacidad de adaptación a los requerimientos particulares de los pacientes ya que, a pesar del amplio número de medicamentos existentes en el mercado y la diversidad en sus formas de dosificación, no siempre cubren las necesidades del clínico y sus pacientes.
Es en estos casos cuando la formulación magistral se convierte en una herramienta terapéutica que no sólo es totalmente legal, como acabamos de ver, sino que tiene unas garantías de calidad y seguridad totalmente equiparables a la del medicamento industrializado. Aún en los casos en que nuestros pacientes son tributarios de los mismos por padecer enfermedades que responden favorablemente a la intervención farmacológica ya existente, siempre existirán pequeños grupos de pacientes que necesitan formas de dosificación inexistentes en el mercado farmacéutico, pero que pueden prepararse con cierta facilidad por la oficina de farmacia autorizada a partir de la adaptación de medicamentos fabricados industrialmente disponibles en el mercado, o a partir de materias primas disponibles para el farmacéutico, tal y como se hace en medicina humana.
Satisfacer estas necesidades terapéuticas conlleva manipular medicamentos preexistentes, fraccionándolos en numerosos casos y, en suma, adaptándolos a las necesidades del paciente individual. Este proceso de personalización de medicamentos exige personal capacitado e instalaciones adecuadas y es práctica habitual en numerosas farmacias de nuestro entorno a las que podemos acudir y en las que podemos apoyarnos para proporcionar mejores cuidados a nuestros pacientes.
La formulación va a permitir al veterinario el diseño de un medicamento y un protocolo terapéutico individualizado para un animal en concreto, atendiendo a sus necesidades farmacoterapéuticas específicas y siempre en estrecha colaboración con el farmacéutico. Algunas de las necesidades, divididas en función de si están relacionadas con el medicamento o el animal, podrían ser las siguientes:
1. Múltiples situaciones relacionadas con el medicamento industrial (pudiendo partir, en la mayor parte de las ocasiones, del propio medicamento comercializado por la industria):
- Ajustar la dosificación del medicamento industrializado por parte del farmacéutico a partir del medicamento industrial.
- Cambio de excipiente / conservante del medicamento industrializado por parte del farmacéutico en caso de reacciones alérgicas o indeseadas.
- Otra vía de administración no producida por la industria en función de las necesidades del paciente.
- Asociación de principios activos.
- Medicamento comercializado por la industria que se ha dejado de fabricar.
- Patología sin interés comercial por su reducida incidencia y prevalencia.
- Medicamento con estabilidad corta, p. ej.: colirios.
- Tratamientos novedosos no comercializados.
- Formas farmacéuticas novedosas no fabricadas por la industria, p. ej.: formas de administración transdérmica.
2. Razones específicas del animal, cuando sea necesario:
- Individualizar la dosis.
- Individualizar el sabor.
- Individualizar el olor.
- Individualizar la forma farmacéutica.
Conclusiones
El veterinario clínico tiene a su disposición una amplia amalgama de sustancias y medicamentos para uso diagnóstico y terapéutico. Siendo esto cierto, también lo es que la excepción siempre se nos presentará en un momento dado y las sustancias que estamos acostumbrados a utilizar, por rutina o comodidad, no siempre se van a ajustar a las necesidades individuales de todos los pacientes. Es en este momento cuando el veterinario se puede apoyar en otros profesionales sanitarios, como los farmacéuticos, para proporcionar a nuestros pacientes los mejores cuidados posibles.
El veterinario es el profesional que mejor conoce las necesidades de nuestras mascotas y el único legalmente reconocido y cualificado para prescribir y aplicar tratamientos sobre los mismos. Así mismo, es el farmacéutico el que tiene la potestad y facultad legal de manipular y adaptar esos medicamentos, siguiendo las instrucciones del veterinario, en función de esas necesidades particulares del paciente en cuestión.
Cuando nos referimos al medicamento individualizado, es capital remarcar este carácter individual del preparado, ya que la elaboración de un catálogo de productos medicamentosos por parte de una farmacia entraría en conflicto con la industria farmacéutica. El veterinario debe ajustarse además a la cascada de prescripción descrita anteriormente y al espíritu de la misma que hace de la fórmula magistral un complemento del medicamento industrializado y no un sustitutivo del mismo. Así mismo y como hemos mencionado, el medicamento es potestad del farmacéutico, por lo que igualmente deberemos evitar la manipulación y/o adaptación de los mismos para su dispensación al cliente final.
En definitiva, es importante saber en cada momento quién puede hacer qué, y qué terrenos entran en la legalidad y cuáles se alejan de ella, de manera que las profesiones sanitarias se complementen y no entren en conflicto.
Fuente de financiación: este trabajo no se realizó con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- 1.
Organización Mundial de Sanidad Animal. Boletín de Medicamentos Veterinarios, nº 2010-1.
- 2.
Informe del Comité de Disponibilidad de Medicamentos Veterinarios (CODI-VET) sobre Vacíos Terapéuticos y otras necesidades prioritarias. 5 Enero 2016.
- 3.
Guía de Normas de Correcta Fabricación de Medicamentos de Uso Humano y Veterinario. Agencia Española del Medicamento y Productos Sanitario (AEMPS). Subdirección General de Inspección y Control de Medicamentos.
- 4.
Directiva 2009/9/CE de la Comisión de 10 de febrero de 2009, Anexo 1, Parte 3, Capítulo 1. Diario Oficial de la Unión Europea.
- 5.
Sevillano EG. ¿Cuánto cuesta fabricar un medicamento? Sección economía diario “El País”. 23 Marzo 2015.
- 6.
Infografía Veterindustria. “Somos parecidos pero no iguales. Medicamentos veterinarios vs medicamentos de humana.
- 7.
Fernández MI, De la Jara AM, Merino C, Gómez B, Ruíz ML. Formulación Magistral. 1º ed., Editorial McGraw Hill / Interamericana de España, 2010; 8-11.
- 8.
Ley 10/2013, de 24 de Julio por la que se modifica la ley 29/2006, de 26 de Julio, de garantías y uso racional de medicamentos y productos sanitarios, Artículo 23.
- 9.
Real Decreto 175/2001. Guía de Normas de Correcta Fabricación de Medicamentos de Uso Humano y Veterinario. Capítulos 1 y 2. AEMPS, Departamento de inspección y control de medicamentos.
- 10.
Lobo M, Díaz MJ, García J, Frejo MT. Estudio piloto sobre la prescripción en situaciones excepcionales. Uso de medicamentos de humana en medicina veterinaria. Clín Vet Peq Anim 2011; 31:143-147.
[UAB] - 11.
Villagrasa, M.“Resulta incompatible para un profesional dispensar y a la vez prescribir medicamentos”.
[Argos] - 12.
Real Decreto 1132/2010, de 10 de septiembre. “BOE” núm. 233, de 25 de septiembre de 2010; 81447-81463.
- 13.
Compounding: FAQs for veterinarians. The Animal Health Institute, The American Veterinary Association. https://ebusiness.avma.org/files/productdownloads/Vet_Compounding.pdf. Acceso: febrero de 2016.
[Vet Compounding] - 14.
Mark G. Drug Compounding for Veterinary Patients. Am Assoc Pharm Sci Jo 2005; 7 (2): 281-87.
[PubMed] - 15.
Davidson G. The Compounding Controversy: What Veterinarians Should Know to Protect Themselves and Their Patients. J Am Anim Hospital Assoc 2003, 39: 13-17.
[PubMed]