Caso clínico de Medicina Interna
M. Suarez-Rey, E. González-Pérez, A. Seoane-Mojon, G. Santamarina-Pernas
Contacto: maruska.suarez@usc.es
Historia clínica
Un perro mestizo, no castrado, de 5 años y 4,6 kg fue referido para evaluación de enzimas hepáticas elevadas. Tres meses antes de la presentación, había permanecido ingresado tras un episodio de vómitos y sangrado gastrointestinal severo que en su momento fue filiado a una pancreatitis. El paciente fue manejado de forma sintomática y transfundido, y evolucionó favorablemente. En sus chequeos subsiguientes su veterinario detectó enzimas hepáticas elevadas de forma persistente y presencia de hematuria en ausencia de crecimiento bacteriano. Salvo estos hallazgos, en el momento de la consulta era un paciente asintomático. El animal se encontraba perfectamente vacunado y desparasitado y su tratamiento actual consistía en un alimento de prescripción de alta digestibilidad y con bajo contenido en grasas. La exploración física no mostró hallazgos relevantes, salvo la presencia de un mayor consumo de agua y el hecho de que el paciente parecía mostrar periodos de somnolencia profunda intercalados con normalidad y/o respuestas exageradas frente a estímulos habituales. Estos cambios de comportamiento no parecían tener relación con la alimentación.
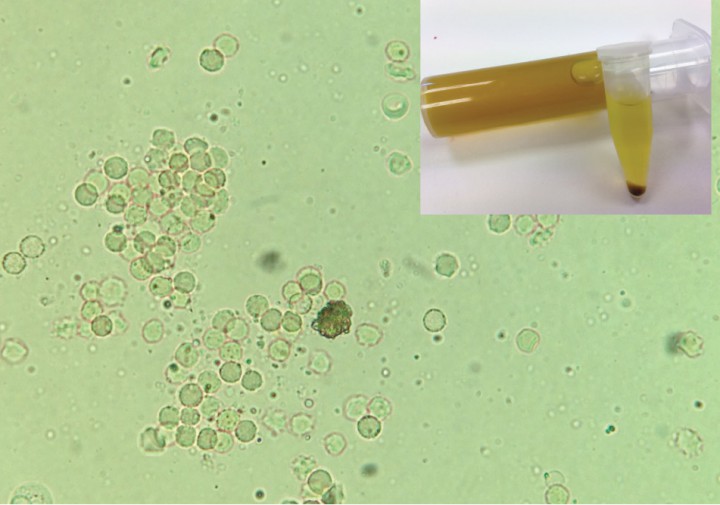
Se realizó un hemograma y bioquímica (Tabla 1 y 2). En el examen de orina se observó baja densidad 1.014; el sedimento mostró gran cantidad de eritrocitos, presencia ocasional de cristales de urato amónico y ausencia de bacteriuria visible (Fig. 1).
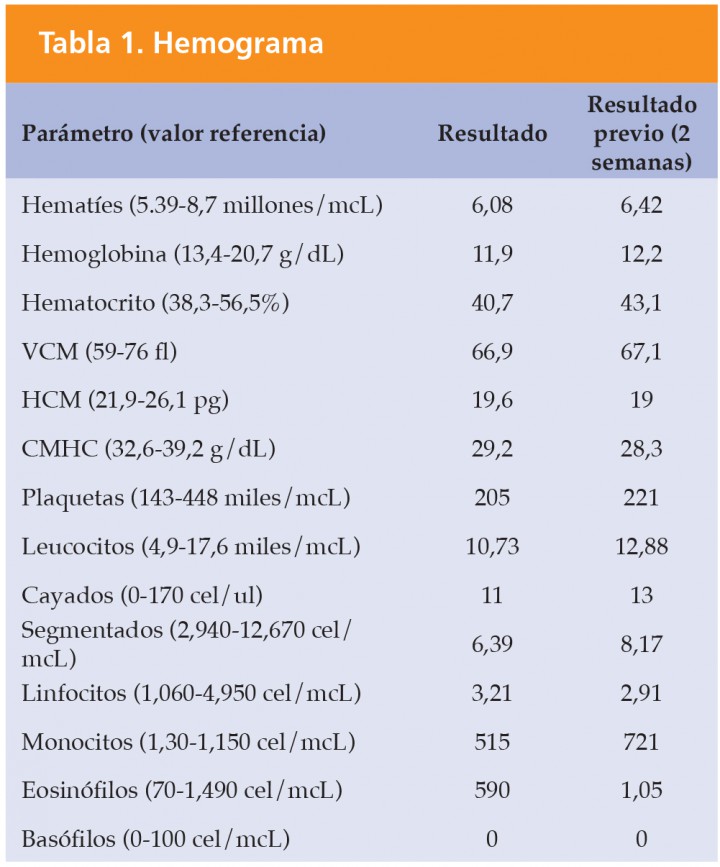
VCM volumen corpuscular medio; HCM hemoglobina corpuscular media; CMHC concentración de hemoglobina corpuscular media.
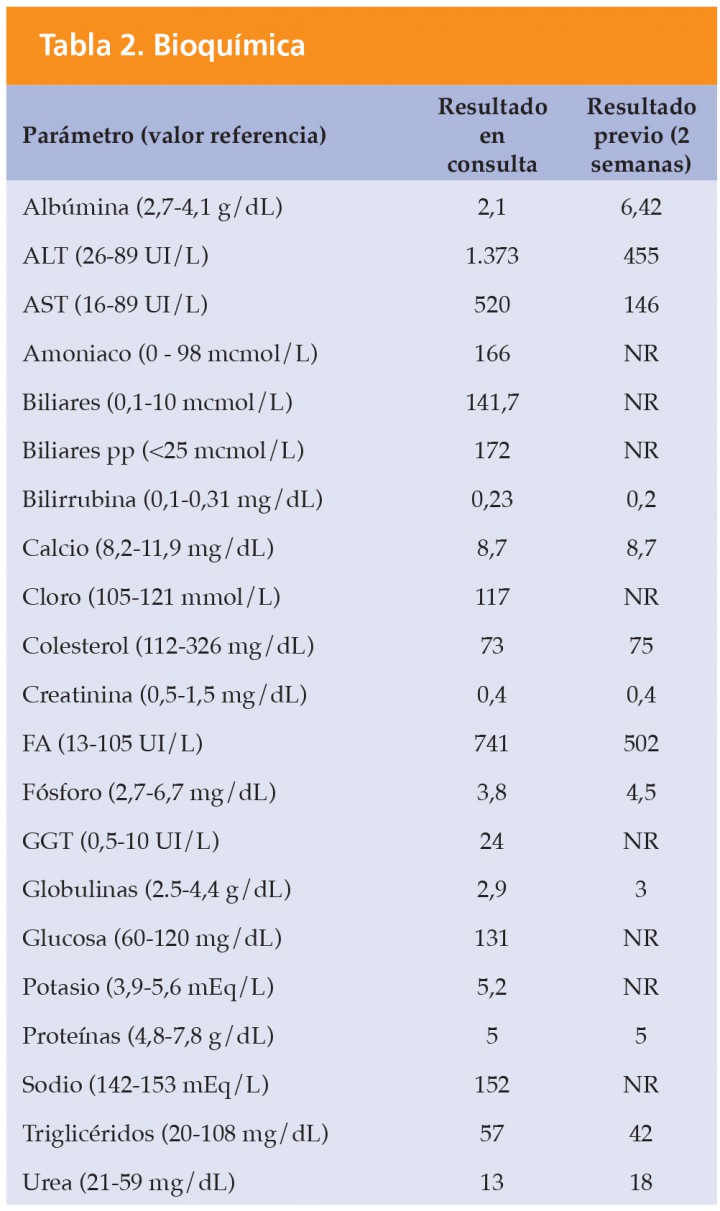
ALT alanina aminotransferasa; AST aspartato aminotransferasa; FA fosfatasa alcalina; GGT -glutamil transpeptidasa.
Figura 1
Detalle de la orina y de sedimento urinario. Se aprecia en el centro de la imagen un cristal de urato de amonio. En pacientes con enfermedad hepatobiliar la deficiencia de urato oxidasa hepática puede conducir a concentraciones séricas aumentadas de ácido úrico, lo que, en conjunción con la hiperamonemia, genera la aparición de estos cristales, que se detectan en casi la mitad de los perros con shunts portosistémicos.
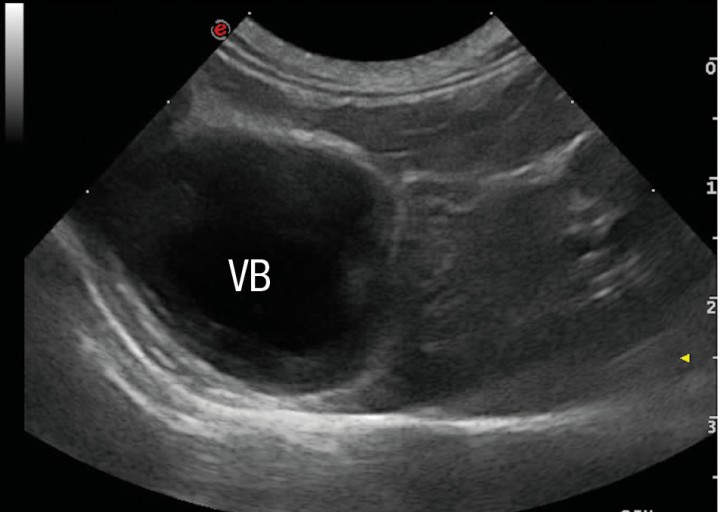
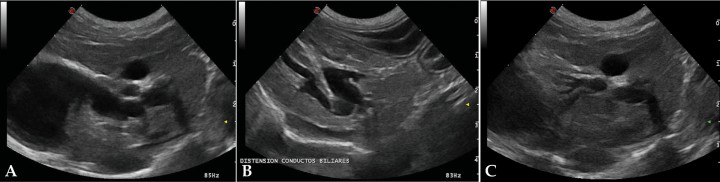
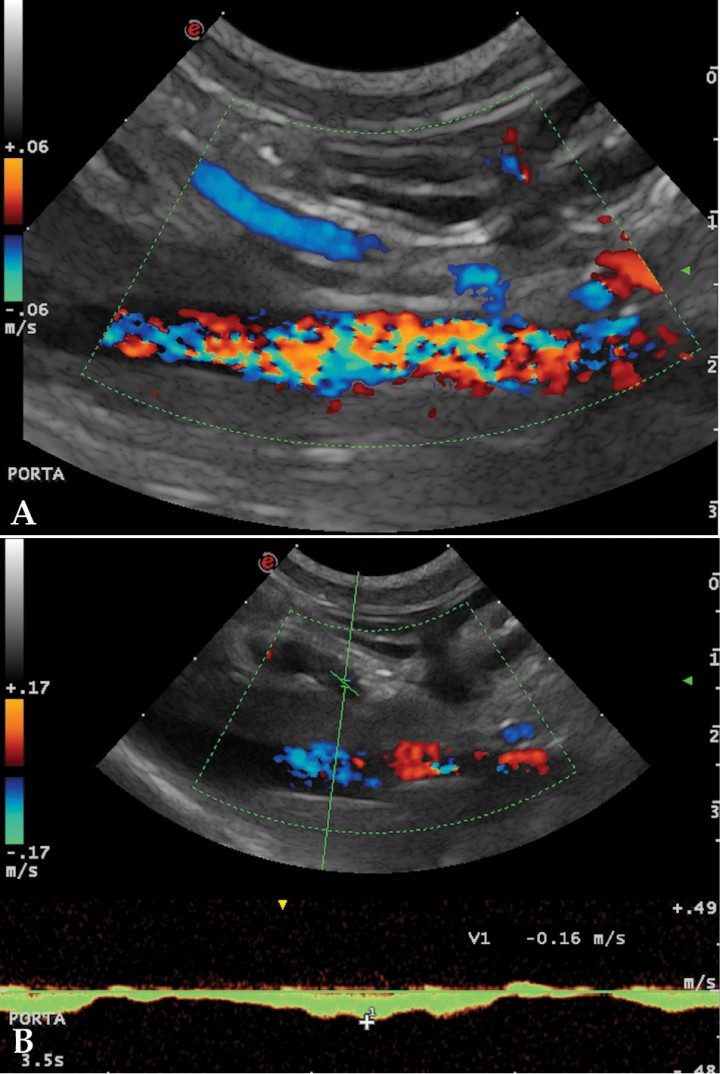
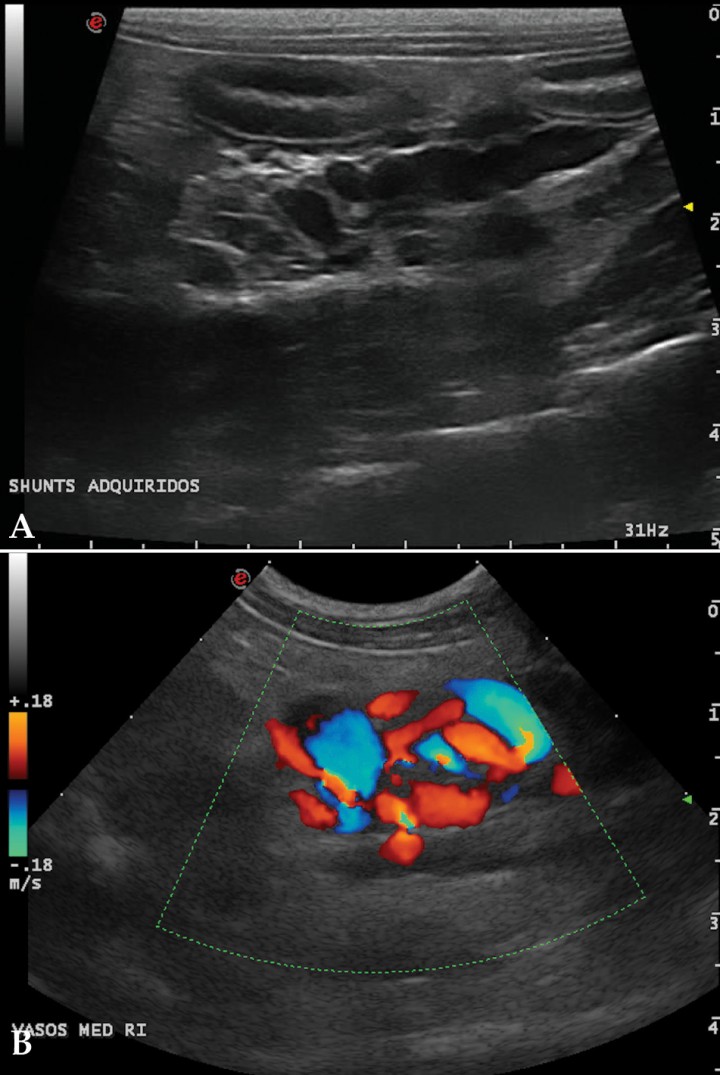
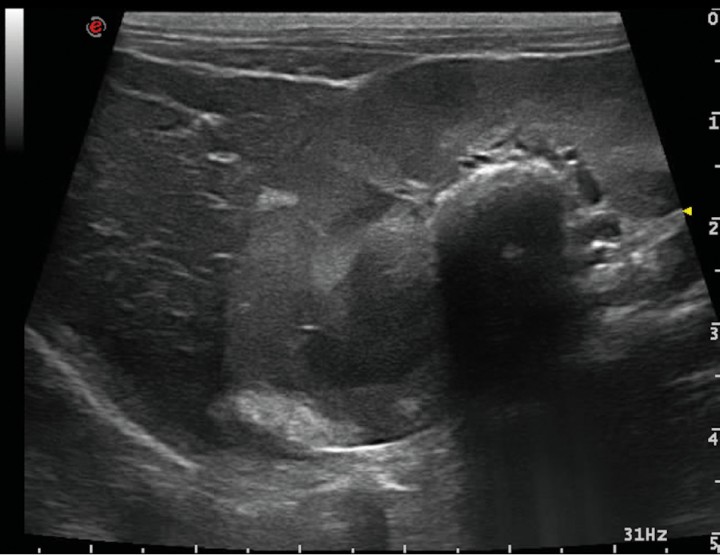
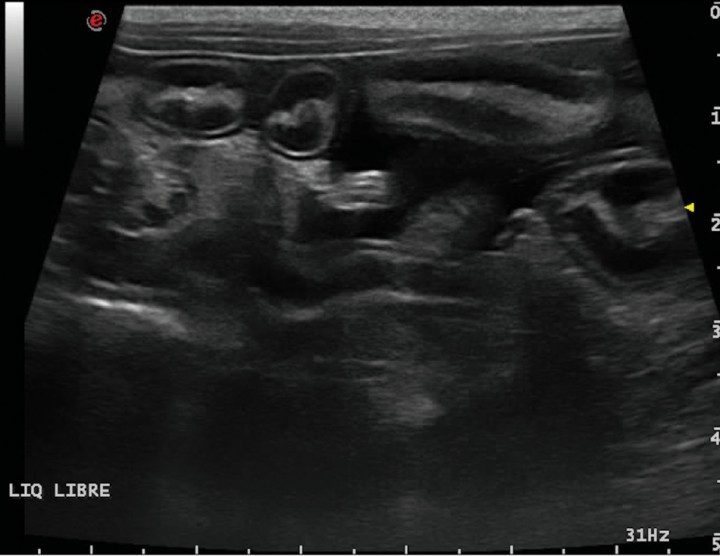
La ecografía hepática mostro un hígado de pequeño tamaño, con presencia de focos hiperecoicos y con sombra acústica (Fig. 2). Los conductos biliares mostraban distensión severa y aspecto tortuoso, manteniendo su comunicación con la vesícula biliar, sin evidencia de obstrucción en algún punto concreto de su recorrido (Fig. 3). La papila duodenal se visualizaba normal. La vena porta presentaba pequeño tamaño, flujo hepatópeto y velocidad aparentemente reducida (Fig. 4). Se evidenció la presencia de múltiples vasos de aspecto tortuoso adyacentes al riñón izquierdo (Fig. 5). Ambos riñones presentan múltiples infartos renales y focos mineralizados en la corteza, sedimento con sombra acústica en pelvis renal izquierda y presencia de cálculos en riñón derecho (Fig. 6). Pequeña cantidad de líquido libre anecoico (Fig. 7).
Figura 2
Corte transversal del hígado. Se aprecia una disminución de tamaño del hígado. Vesícula biliar. (VB).
Figura 3
(A) Cortes longitudinales de hígado parasagitales y oblicuos derechos. Se observa dilatación de los conductos biliares intrahepáticos y conducto cístico, así como la relación con la vesícula biliar (B y C) Conductos biliares dilatados.
Figura 4
(A) Corte longitudinal a nivel del hilio hepático. Doppler color. Vena porta con flujo hepatófugo. (B) Patrón del flujo portal con Doppler espectral. Ilustra el flujo de la vena porta en dirección hepatófuga y con la velocidad reducida.
Figura 5
(A) Corte longitudinal, medial al riñón izquierdo. Múltiples vasos sanguíneos distendidos y tortuosos compatibles con shunts portosistémicos extrahepáticos adquiridos. (B) Corte longitudinal, medial al riñón izquierdo. Detalle Doppler color.
Figura 6
Corte longitudinal a nivel del riñón derecho - hígado. Área hiperecoica con marcada sombra acústica en región de pelvis renal (urolitiasis) y múltiples áreas hiperecoicas de forma acuñada, sin sombra acústica en región cortical (infartos renales).
Figura 7
Corte longitudinal. Líquido libre abdominal anecoico entre asas de intestino delgado.
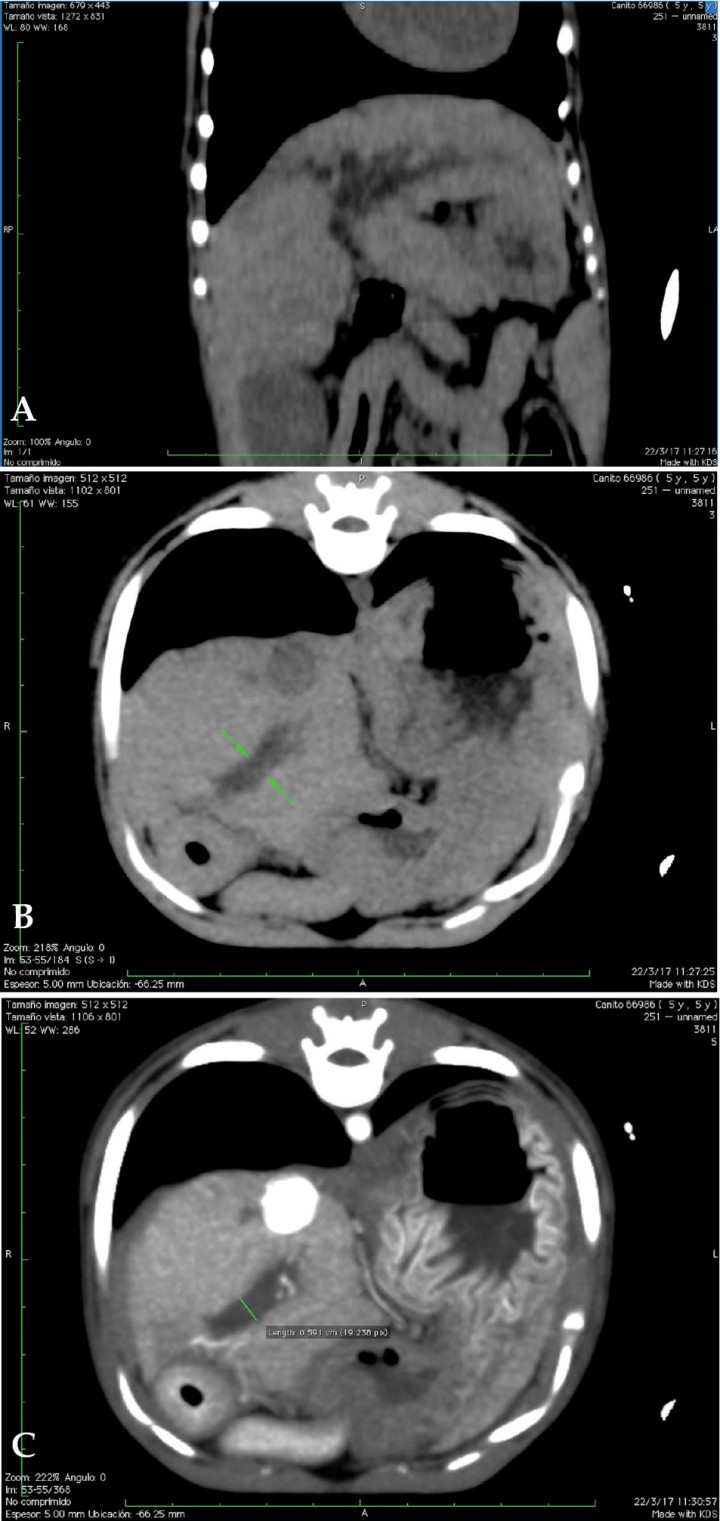
Para descarte de posible obstrucción del tracto biliar extrahepático se procedió a estudio mediante TC (Figs. 8 y 9). No se observó ninguna causa que pudiera justificar la dilatación de la vía biliar.
Figura 8
(A) Reconstrucción multiplanar (MPR) en plano dorsal en ventana de tejido blando. Imagen sin contraste. Se identifican, hipodensos, los conductos biliares dilatados. (B y C) Imágenes axiales pre y postcontraste del conducto biliar común distendido, sin evidencias de obstrucción mecánica del mismo.
Figura 9
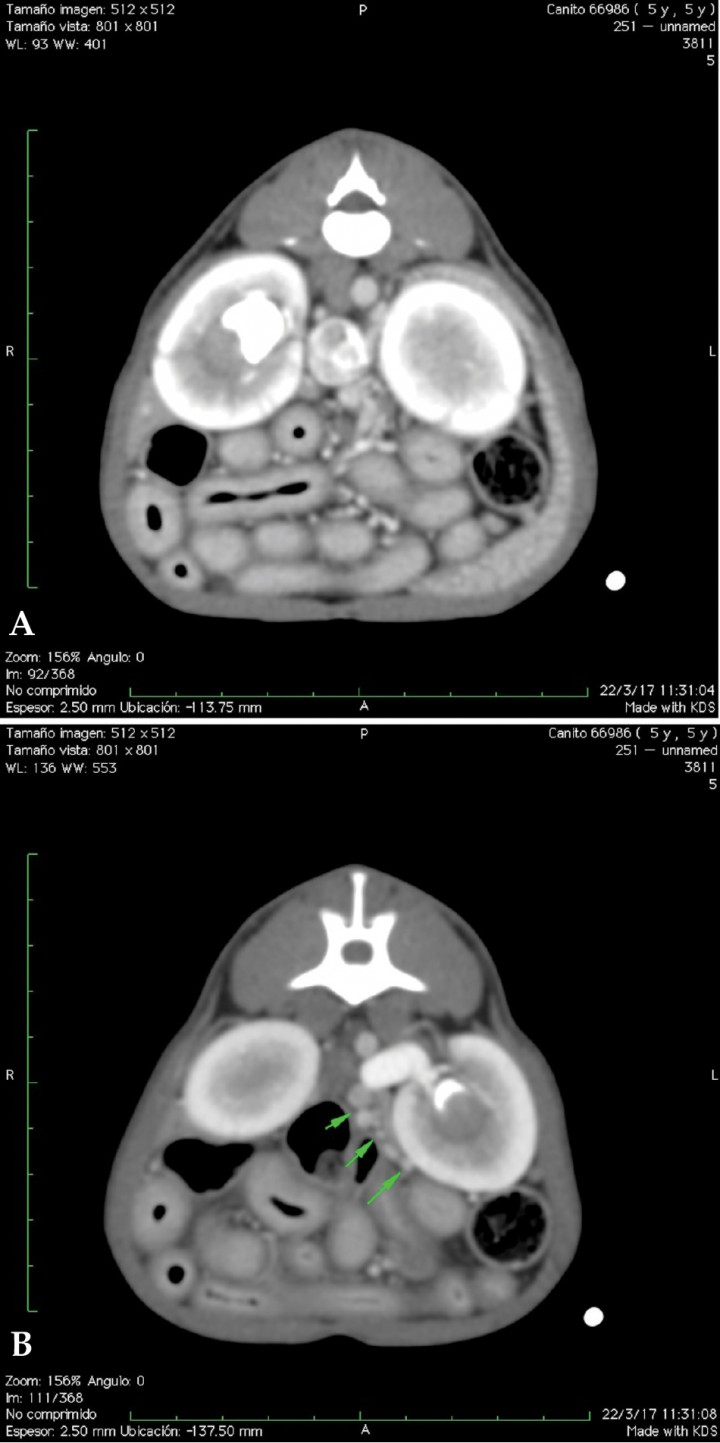
Imágenes axiales con contraste a nivel renal. (A) Dilatación de la vena cava con múltiples vasos sanguíneos tortuosos adyacentes (shunts portosistémicos adquiridos), urolito en pelvis del riñón derecho. Áreas estriadas hipodensas (captación de contraste irregular) en ambas corticales renales. (B) Dilatación de la vena renal izquierda y pequeños vasos sanguíneos de aspecto tortuosos en la proximidad del riñón izquierdo (shunts portosistémicos adquiridos). Urolito en pelvis del riñón izquierdo.
En base a los hallazgos observados en las analíticas sanguíneas, urianálisis y técnicas de imagen, el diagnóstico presuntivo fue de enfermedad quística biliar por posible malformación de la placa ductal, con hipertensión portal asociada y desarrollo de comunicaciones extrahepáticas adquiridas y probable nefrolitiasis de urato amónico.
Se inició terapia con dieta de prescripción hepática, lactulosa, metronidazol, ácido ursodesoxicólico y S-adenosilmetionina. Hasta la fecha el paciente continúa estable y con seguimientos periódicos.
¿Reflejan los resultados de laboratorio la pertinencia de un estudio diagnóstico profundo?
Desde un punto de vista conceptual, los trastornos en las pruebas laboratoriales hepáticas se pueden clasificar como colestáticos, hepatocelulares o mixtos: un patrón colestático o inducible se caracteriza por aumentos predominantes en las actividades de fosfatasa alcalina (ALP) y de γ-glutamil transpeptidasa (GGT); un patrón hepatocelular tiene aumentos predominantes y proporcionales a la intensidad del daño en las actividades de la alanina aminotransferasa (ALT) y la aspartato aminotransferasa (AST) secundarios a daño o necrosis de hepatocitos; y un patrón mixto de aumento de la actividad enzimática hepática, sugiere lesión hepatocelular y colestasis concurrentes.
Si bien en pacientes asintomáticos en los que se observan elevaciones leves y aisladas de alguna de estas enzimas podría ser adecuado la simple repetición del estudio bioquímico para confirmar la persistencia del hallazgo, la realización de pruebas diagnósticas adicionales está más que justificada en todos aquellos pacientes que presenten aumentos mayores al doble del intervalo de referencia en marcadores hepatocelulares y/o esté presente un patrón mixto de lesión debido a una mayor probabilidad de enfermedades graves, tal como es el caso aquí presentado (Tabla 2), independientemente de que se manifiesten o no síntomas1.
¿Qué nos indica la presencia de ácidos biliares elevados?
La medición de ácidos biliares séricos (ABS) refleja la eficiencia de la circulación enterohepática y su uso clínico primario es evaluar la función hepática en pacientes con sospecha de enfermedad hepática con concentraciones séricas de bilirrubina que están dentro del intervalo de referencia, tal cual es el caso aquí presentado (Tabla 2). Su incremento en sangre (ayunas y/o postpandrial) es un indicador muy sensible de disfunción hepatobiliar por colestasis, existencia de comunicaciones portosiste?micas o disminución de la reserva de hepatocitos. La especificidad de los ABS para el diagnóstico de la enfermedad hepatobiliar es del 100% con valores >20 mmol/L en ayunas y 25 mmol/L en muestras postpandriales, pero no permiten diferenciar por sí mismos un problema hepatocelular de uno vascular o colestático, y tampoco existe correlación entre los valores de ABS y la severidad de la lesión hepática o de la comunicación vascular2.
¿Qué nos indica la presencia de comunicaciones extrahepáticas múltiples?
Las comunicaciones portosistémicas múltiples se deben a procesos que provoquen hipertensión portal (HTP) continuada. Las causas de HTP3 se clasifican de acuerdo con la localización del sitio de máxima resistencia al flujo portal. Las tres categorías principales son prehepática (algo dificulta el flujo portal antes de llegar al hígado), intrahepática (procesos que comprometen al tejido hepático, siendo la cirrosis, fibrosis y hepatopati?a cro?nica las causas más frecuentes) y posthepática (aunque no suele provocar el desarrollo de comunicaciones portosistémicas múltiples porque las presiones en el sistema venoso portal y en el sistémico se incrementan al mismo tiempo).
En perros, las comunicaciones múltiples son comúnmente esplénicas, y se presentan en el área perirrenal izquierda y la raíz del mesenterio (Fig. 5). Esto es debido a que el incremento de la resistencia al flujo sanguíneo portal determina que las conexiones microvasculares no funcionales, presentes al nacimiento entre la vena porta y las vías sistémicas, se tornen funcionales, de manera que las comunicaciones portosistémicas representan dilataciones adquiridas de comunicaciones microvasculares normales entre la vena porta y las venas sistémicas.
En nuestro paciente (Figs. 4, 5 y 7) la presencia de estos shunts múltiples, junto con el perfil de flujo portal y la presencia de ascitis, son altamente sugerentes de que el proceso de base está provocando HTP.
¿A nivel clínico, qué nos sugiere la presencia de un hígado de pequeño tamaño, renomegalia bilateral y urolitiasis?
Estos hallazgos suelen aparecer de forma secundaria a la reducción del flujo venoso portal al hígado. La microhepatía puede observarse en caso de hipoplasia primaria de la vena porta, hepatitis crónica o cirrosis, y la renomegalia bilateral puede verse en caso de trastorno hipertensivo portal congénito, pero la combinación de estos tres hallazgos se ha visto que tiene un valor predictivo positivo del 100% de presencia de trastorno vascular hepático.4
¿Qué otras técnicas realizarías para alcanzar el diagnóstico definitivo?
La biopsia hepática sería la prueba que nos permitiría confirmar nuestra sospecha. Lograremos identificar si la hipertensión es producto de una enfermedad hepática primaria (cirrosis, hepatitis disecante, fibrosis biliar) o de una hipoplasia de la vena porta que curse con fibrosis. También permitiría diferenciar las lesiones quísticas observadas, aunque el diagnóstico en la mayoría de quistes biliares (enfermedad poliquística juvenil, enfermedad poliquística en adultos, dilatación congénita de grandes conductos) es ecográfico.
Dado el pequeño tamaño del hígado para acceso mediante biopsia ecoguiada, se propuso la realización de laparotomía para toma de tejido hepático, pero no fue autorizada. Posiblemente el empleo de técnicas menos invasivas, como hubiera sido una biopsia laparoscópica, habría facilitado la toma de decisiones por parte del propietario.
Discusión
La presentación clinicopatológica de este paciente no difiere de otras hepatopatías y fueron los hallazgos ecográficos, presencia de dilataciones del árbol biliar en ausencia de obstrucción o impedimento al paso del flujo biliar, junto con los signos de HTP, los que sugieren una posible malformación de la placa ductal (MPD).5
En medicina humana se reconocen diferentes enfermedades císticas congénitas del hígado provocadas por el desarrollo anormal de los conductos biliares (Fig. 10), junto con una variedad de enfermedades concurrentes, tales como trastornos del colágeno y poliquistosis renal. La dilatación de los grandes conductos biliares intrahepáticos y extrahepáticos, como se observa en este paciente, se correspondería con la enfermedad de Caroli (EC) de los seres humanos, y representa un defecto embrionario temprano en la formación de los conductos biliares intrahepáticos. El caso aquí presentado es muy sugestivo de la presencia de EC,6,7 pero la bibliografía actual recomienda englobar estas enfermedades bajo el termino genérico de malformaciones de la placa ductal.8
Figura 10 Las vías biliares intra y extrahepa?ticas se originan en una estructura embrionaria denominada placa ductal; los defectos en su remodelacio?n o su persistencia, dan origen a malformaciones que suelen tener diferentes expresiones y cuadros clínicos dependiendo del momento del desarrollo en el que se produzca y de la parte de la vía biliar afectada. La fibrosis hepática congénita y los hamartomas biliares son manifestaciones de la malformación de los pequeños ductos o canalículos biliares, la enfermedad poliquística representa la malformación de los ductos biliares intrahepáticos de mediano tamaño, la enfermedad de Caroli es el resultado de la malformación de los ductos biliares de gran tamaño y los quistes de cole?doco son resultado de la alteración de los ductos biliares extrahepa?ticos. La enfermedad de Caroli puede ocurrir también en asociación con la fibrosis hepática congénita, siendo llamada entonces síndrome de Caroli.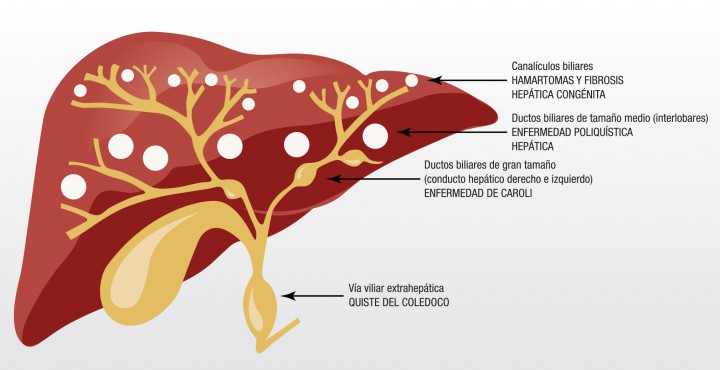
En perros, la mayoría de estas enfermedades aparecen en la literatura como series de casos y es reciente que empiecen a ser reconocidas. Las MPD abarcan varias anomalías del desarrollo de la tríada portal, incluyendo la fibrosis hepática congénita (FHC) y la enfermedad de Caroli. Es posible que ciertos desórdenes ya reconocidos, como la hipoplasia venosa portal, pueda estar relacionada con estas anomalías de la placa ductal, puesto que el desarrollo embrionario de los conductos biliares y la circulación portal se sabe que están vinculados.
La EC, también conocida como ectasia comunicante del árbol biliar, se caracteriza por la presencia de dilataciones multifocales de los grandes ductos biliares segmentarios e intrahepáticos que mantienen su comunicación con el árbol biliar, y parece ocurrir como resultado de la detención de la maduración de los conductos biliares medianos intrahepáticos. Cuando se asocia a FHC, se denomina síndrome de Caroli y hay manifestaciones de hipertensión portal. Los informes en la literatura veterinaria son escasos, se describen 8 casos en una serie publicada en 2003,6 dos casos7 en Golden Retriever emparentados, que además presentaban fibrosis portal y quistes renales; y en un trabajo reciente,8 con 30 Bóxer con MPD, dos de ellos presentaban alteraciones coincidentes con EC.
La fibrosis hepática congénita fue descrita9 en 2010 en 5 perros de diferentes razas. Desde entonces no ha habido muchas otras descripciones, pero es posible que la enfermedad no sea bien reconocida y que algunos de estos casos sean mal clasificados como fibrosis portal, cirrosis, colangitis o hepatitis crónica. A nivel histológico un hallazgo que permite la distinción de estas otras alteraciones es la falta de proliferación de los conductos biliares embrionarios demostrada por ausencia de Ki67 en las tinciones de inmunohistoquímica.6 Es posible que esta enfermedad pueda tener un componente racial, tal como se desprende del estudio de Pillai8 con 30 perros de raza Bóxer y estudios10 en el Skye Terrier, en el que sugieren que la hepatitis descrita en esta raza pudiera ser en realidad una FHC.
El tratamiento para estos trastornos es paliativo, mediante el manejo de la encefalopatía hepática con dietas restringidas en proteínas, lactulosa y metronidazol, y la restricción de sodio dietético y el uso juicioso de diuréticos en caso de ascitis. Los seres humanos con síndromes similares son tratados según la extensión con lobectomía hepática y resecciones segmentarias hasta trasplante hepático.
Las complicaciones descritas8 fueron la presencia de inflamación portal, colangitis e infección bacteriana, formación de colelitos y acumulación de cobre hepatocelular concurrente, pero que no parecía relacionada. Por ello se recomienda el seguimiento periódico del paciente para la identificación temprana de estas posibles complicaciones.
En conclusión, este caso sirve para familiarizarnos con esta afección, de manera que cuando visualicemos dilataciones saculares o quísticas de las vías biliares intrahepáticas (que pueden haber sido interpretadas como obstrucción biliar extrahepática), junto con la presencia de hipertensión portal, incluyamos en nuestro diagnóstico diferencial las malformaciones de la placa ductal.
Fuente de financiación: este trabajo no se realizó con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Alvarez L, Whittemore J. Liver enzyme elevations in dogs: diagnostic approach. Compend Contin Educ Vet. 2009;31(9):416-8.
[PubMed] - 2.
Center SA, ManWarren T, Slater MR, et al. Evaluation of twelve-hour preprandial and two-hour postprandial serum bile acids concentrations for diagnosis of hepatobiliary disease in dogs. J Am Vet Med Assoc 1991;199(2):217-26.
[PubMed] - 3.
Buob S1, Johnston AN, Webster CR. Portal hypertension: pathophysiology, diagnosis, and treatment. J Vet Intern Med. 2011;25(2):169-86.
[PubMed] - 4.
d’Anjou MA, Penninck DG, Cornejo L, Pibarot P (2004) Ultrasonographic diagnosis of portosystemic shunting in dogs and cat. Vet Radiol Ultrasound 45:424-437.
[PubMed] - 5.
Watson P. Canine Breed-Specific Hepatopathies. Vet Clin North Am Small Anim Pract. 2017;47(3):665-682.
[PubMed] - 6.
Görlinger S, Rothuizen J, Bunch S, et al. Congenital dilatation of the bile ducts (Caroli’s disease) in young dogs. J Vet Intern Med 2003;17(1):28-32.
[PubMed] - 7.
Last RD, Hill JM, Roach M, et al. Congenital dilatation of the large and segmental intrahepatic bile ducts (Caroli’s disease) in two golden retriever littermates. J S Afr Vet Assoc 2006;77(4):210-4.
[PubMed] - 8.
Pillai S, Center SA, McDonough SP, et al. Ductal plate malformation in the liver of boxer dogs: clinical and histological features. Vet Pathol 2016;53(3):602-13.
[PubMed] - 9.
Brown DL, Van Winkle T, Cecere T, et al. Congenital hepatic fibrosis in 5 dogs. Vet Pathol 2010;47(1):102-7.
[PubMed] - 10.
Watson PJ, Reading MR, Constantino-Casas F. Skye terrier hepatitis re-appraised: is this a congenital ductal plate abnormality? Proceedings ECVIM Congress. Liverpool, United Kingdom, September 2013.