Diabetes mellitus en un perro con carcinoma folicular de tiroides
Diabetes mellitus in a dog with follicular thyroid carcinoma
L. Pérez-López, Y. Brito-Casillas, A.M. Wägner, C. Melián
Contacto: carlos.melian@ulpgc.es
Resumen
Las neoplasias tiroideas representan del 1 al 4 % de las neoplasias caninas. Aproximadamente el 90 % de los tumores tiroideos en el perro son carcinomas, pero sólo el 10 % de estos tumores tiroideos son hiperfuncionantes y ocasionan síntomas de hipertiroidismo. Se expone un caso clínico de un perro macho de 7 años de edad, con diabetes, carcinoma tiroideo folicular y síntomas de hipertiroidismo. La coexistencia de diabetes e hipertiroidismo no ha sido descrita previamente en el perro.
Palabras clave: carcinoma tiroideo, diabetes mellitus, hipertiroidismo.
Clin. Vet. Peq. Anim, 2018, 38 (1): 23 - 27
Summary
Thyroid neoplasms represent 1-4% of all neoplasms in dogs. 90% are thyroid carcinomas, and only 10% of these are hyperfunctional and cause hyperthyroidism. A clinical report of a 7-year-old male dog with diabetes, follicular thyroid carcinoma and symptoms of hyperthyroidism, is presented. The coexistence of diabetes and hyperthyroidism has not been previously described in dogs.
Keywords: thyroid carcinoma, diabetes mellitus, hyperthyroidism.
Clin. Vet. Peq. Anim, 2018, 38 (1): 23 - 27

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
Las neoplasias tiroideas representan del 1 al 4 % de las neoplasias caninas. El 90 % de los tumores tiroideos en el perro son carcinomas, el 9 % son adenomas y el restante 1 % lo constituyen otras formas menos frecuentes de tumores tiroideos o metástasis tiroideas de otras neoplasias.1
La mayoría de los tumores tiroideos son grandes, invasivos y no funcionales, por lo que no suelen dar lugar a un cuadro clínico de hipertiroidismo, y normalmente se localizan ventral o ventrolateralmente en el cuello. La mayor parte de los tumores funcionales son carcinomas de gran tamaño, con invasión local y/o metástasis a distancia. Sólo el 10 % de los carcinomas tiroideos y, ocasionalmente, los adenomas tiroideos, producen cantidades excesivas de hormonas tiroideas y dan lugar a signos clínicos de hipertiroidismo.2
En medicina humana, los pacientes hipertiroideos presentan una resistencia a la acción de la insulina y un incremento de la gluconeogénesis. Existe además una disminución de la recaptación periférica de glucosa3,4 y un incremento de la lipólisis promovido por una activación noradrenérgica.5,6 También se ha demostrado que puede ocurrir una alteración del metabolismo de la glucosa en gatos hipertiroideos en los que, aunque presentan niveles de glucemia basal similares a los eutiroideos, se observa una disminución de la eliminación de glucosa y un incremento en la secreción de insulina.7
Según nuestro conocimiento, la coexistencia de hipertiroidismo y diabetes no ha sido descrita en perros. Exponemos el caso de un perro con un carcinoma tiroideo, signos clínicos de hipertiroidismo y diabetes mellitus.
Caso clínico
Un perro macho entero de 7 años y de raza West Highland White Terrier (Fig. 1) llegó remitido a nuestra consulta con un cuadro clínico de poliuria y polidipsia intensas, pérdida de peso, debilidad extrema, deshidratación, taquicardia y taquipnea de dos semanas de duración.
Figura 1
Perro de 7 años con diabetes mellitus y síntomas de hipertiroidismo.
El día anterior acudió a la clínica remisora donde se realizó el diagnóstico de diabetes en base a la presencia de los síntomas descritos y la detección de un valor de glucemia superior a 686 mg/dl. Otras alteraciones bioquímicas observadas fueron un ligero aumento del nitrógeno ureico en sangre (39; valores de referencia: 7-27 mg/dl) y de la albúmina (4,3; valores de referencia 2,3-4 g/dl); el resto de parámetros, así como las enzimas pancreáticas, estaban dentro de los rangos de referencia. En ese momento, el animal fue hospitalizado, se le administró fluidoterapia, y anteriormente a la remisión a nuestro centro también fue tratado con 4,0 UI de insulina regular (Actrapid®, Novo Nordisk, Madrid, España).
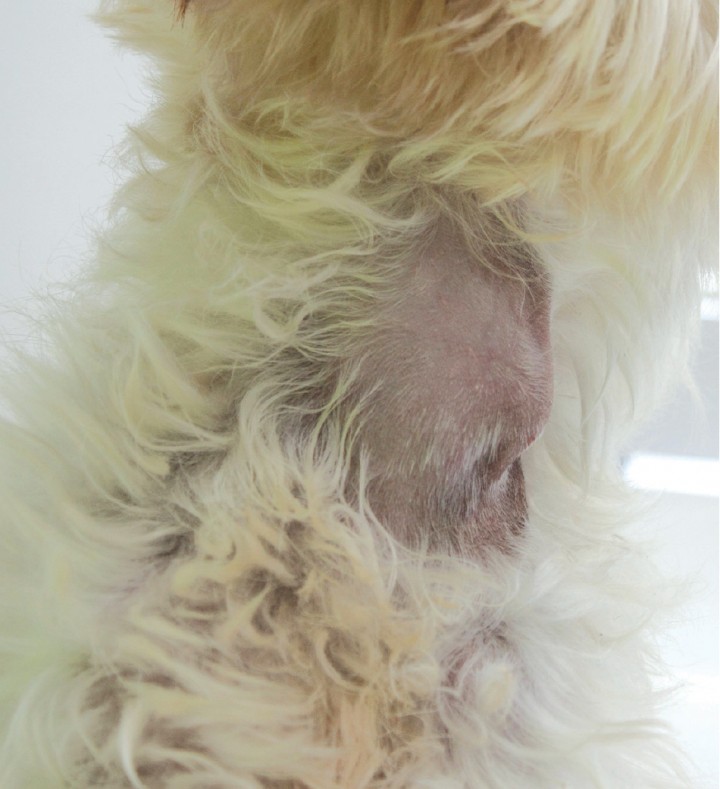
En el momento del ingreso en nuestro centro su peso era de 6 kg, lo que suponía una pérdida de peso de 2 kg con respecto a su peso habitual. A la exploración inicial se observaron signos de deshidratación del 5-7 % del peso corporal, taquicardia (220 pulsaciones por minuto), taquipnea y una masa de unos 2 cm de diámetro y consistencia dura en la región cervical ventral (Fig. 2). La presión arterial sistólica (Vet BP Doppler, Mano Medical®) fue de 140 mmHg (rango de referencia 90-140). En este momento el animal mostraba hipoglucemia (58 mg/dl), y no presentaba cuerpos cetónicos en plasma.8 Se realizó una ecografía abdominal que evidenció un ligero aumento de tamaño del hígado y un páncreas con un parénquima hiperecogénico de forma homogénea. Ambas glándulas adrenales presentaban un tamaño y contorno normal. El grosor máximo de ambas glándulas adrenales, que se midió en un plano longitudinal, fue de 6 mm en la glándula adrenal derecha y 6,9 mm en la glándula adrenal izquierda.
Figura 2
Masa en la región cervical ventral.
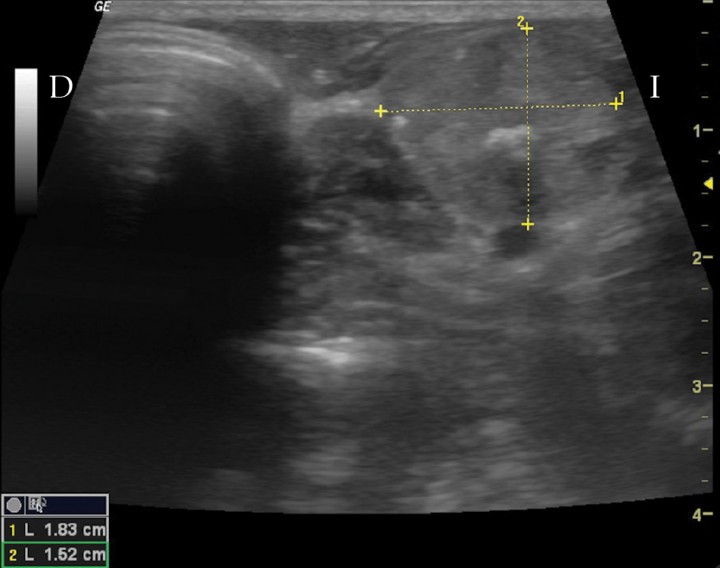
Se ingresó en cuidados intensivos para el tratamiento con fluidoterapia (Ringer Lactato + 5 % de glucosa). Unas 12 h después, se encontraba ya hidratado y nuevamente con hiperglucemia (231 mg/dl), por lo que se instauró el tratamiento con una dosis baja de insulina (Caninsulin®, MSD, Salamanca, España) de 0,2 UI/kg/12 h. Transcurridas 4 horas después de la administración de esta dosis, se observó un nadir de glucosa de 36 mg/dl. La glucosa ascendió a 77 mg/dl a las 6 horas, y a 164 mg/dl a las 9 horas. Transcurridas 12 horas después de dicha administración, la glucosa presentaba un valor de 245 mg/dl. En este momento, debido a la hipoglucemia observada durante el nadir de glucosa, se disminuyó la dosis de insulina a 0,1 UI/kg. El siguiente valor de la glucosa preinsulina fue de 286 mg/dl y, esta vez, el nadir de glucosa a las 4 h fue de 244 mg/dl y el siguiente valor de la glucosa preinsulina, de 291 mg/dl. El paciente recibió el alta y se continuó en casa con este tratamiento de insulina, si bien, dos días después de haber estado hospitalizado, acudió a revisión y persistían la taquicardia (150 lpm) y la taquipnea. Se detectó una hiperglucemia de 470 mg/dl, por lo que se incrementó la dosis de insulina a 0,2 UI/kg/12 h y se realizaron estudios adicionales. La ecografía cervical confirmó la presencia de una masa tiroidea con un diámetro máximo de 1,8 cm (Fig. 3). Se realizó también una punción ecoguiada de la masa y los resultados de la citología indicaron un epitelio tiroideo morfológicamente normal. En las radiografías de tórax y abdomen no se observaron lesiones radiológicas compatibles con metástasis pulmonares o masas.
Figura 3
Imagen ecográfica en plano transversal de la masa cervical. D: derecha. I: izquierda.
En la determinación de hormonas tiroideas se observó una T4 total canina de 1,1 µg/dl (1-4 µg/dl) y una TSH canina <0,03 ng/ml (0,03-0,6 ng/ml).
El animal continuó perdiendo peso; unos 20 días después del diagnóstico pesaba 5,2 kg, momento en el que la glucemia persistía en valores de 550 mg/dl, por lo que la dosis de insulina se incrementó a 0,44 UI/kg cada 12 horas.
Un mes después del diagnóstico, persistían los síntomas de taquicardia y taquipnea por lo que se realizó una tiroidectomía unilateral. El día anterior a la cirugía la dosis de insulina se disminuyó a 0,3 UI/kg/12 h (Caninsulin®, MSD, Salamanca, España), debido a que en el estudio preanestésico se detectó un valor de glucosa de 76 mg/dl.
La evaluación histopatológica de la masa extirpada reveló la presencia de un carcinoma tiroideo folicular bien diferenciado, que macroscópicamente presentaba un crecimiento bien delimitado y encapsulado. Tras la intervención quirúrgica se resolvieron la taquicardia y la taquipnea. Unos 10 días después de la cirugía el paciente presentaba bradiarritmia, estaba animado, con bastante apetito, y su peso había aumentado hasta 5,8 kg.
Unos 45 días después de la cirugía su peso se había incrementado a 6,2 kg, la glucemia era de 435 mg/dl y la dosis de insulina se aumentó a 0,4 UI/kg/12 horas. También se volvieron a medir las hormonas tiroideas. Los valores de TSH se habían normalizado (0,14 ng/ml) y la T4 mostró un valor por debajo del rango de referencia (<0,5 µg/dl). A partir de ese momento, no fue posible realizar un seguimiento del paciente.
Discusión
La mayoría de los perros con tumores tiroideos no presentan signos compatibles con hipertiroidismo, sino únicamente manifestaciones clínicas asociadas al crecimiento o invasión de la neoplasia tiroidea en la región del cuello como disfagia, disfonía o disnea. Este paciente, además de una masa en la región cervical ventral, presentaba otros signos clínicos como taquicardia, taquipnea y pérdida de peso que son compatibles con un estado de hipertiroidismo. La medición de T4 total dio un resultado dentro del rango de referencia, si bien la concentración de TSH canina era indetectable, resultado que sería esperable en un perro con hipertiroidismo. En la actualidad, no disponemos de estudios que evalúen la utilidad de la medición de la TSH canina en perros hipertiroideos. En nuestra opinión, la presencia de una masa cervical junto con otros signos compatibles con hipertiroidismo (taquicardia, jadeo y/o pérdida de peso) y una concentración de TSH indetectable debería hacernos sospechar de esta enfermedad.
En medicina humana está establecido el diagnóstico del hipertiroidismo subclínico, aconsejando el tratamiento en estos pacientes cuando presentan una TSH <0,1 mUI/l y valores normales de T4.9 En la especie felina se ha descrito que aquellos gatos geriátricos que tienen una T4 normal y que presentan una concentración indetectable de TSH (<0,03 ng/ml) tienen mayor riesgo de desarrollar hipertiroidismo en un periodo de un año.10 También se ha descrito el hipotiroidismo subclínico tras el tratamiento con yodo radioactivo en el que los gatos presentan concentraciones normales de T4 total y niveles elevados de TSH.11
En este caso clínico, el hecho de que la concentración de T4 total estuviera dentro del rango de referencia no confirma el diagnóstico de hipertiroidismo, si bien tampoco lo descarta, ya que las enfermedades no tiroideas, en este caso la diabetes, pueden disminuir las concentraciones de T4 total dando lugar a un resultado falso negativo.12-14 Esto se denomina síndrome del eutiroideo enfermo; el mecanismo fisiopatológico no se conoce exactamente, pero algunos autores sugieren que es una respuesta protectora frente al estrés que supone una enfermedad.14 Las enfermedades no tiroideas pueden disminuir la concentración de T4 en gatos con hipertiroidismo hasta situar los niveles de T4 en el rango de referencia e incluso, ocasionalmente, por debajo del rango de referencia.12 El hipertiroidismo canino es una enfermedad con una prevalencia muy baja, lo que hace que no existan estudios que evalúen el efecto de enfermedades no tiroideas sobre las concentraciones de T4 y TSH en perros hipertiroideos, si bien sería de esperar que ocurra un efecto similar al descrito en gatos hipertiroideos.12,13 No haber podido determinar la concentración de T4 libre para la confirmación del diagnóstico del hipertiroidismo es una limitación de este caso clínico; aun así, la resolución de los signos clínicos tras la cirugía, junto con el aumento de peso, también son indicativos de que existía un estado de hipertiroidismo.
En medicina humana se ha demostrado que el exceso de hormonas tiroideas promueve la hiperglucemia al incrementar los niveles de ácidos grasos libres en plasma, lo cual aumenta la gluconeogénesis y glucogenólisis hepática, además de incrementar la formación de lactato en el músculo y el tejido adiposo (Ciclo de Cori).3 Por tanto, el estado de hipertiroidismo puede predisponer a la diabetes mellitus. La coexistencia de hipertiroidismo y diabetes mellitus en animales de compañía es muy baja. El hipertiroidismo en gatos puede aumentar los niveles de glucosa basal y producir una resistencia a la insulina, pero es difícil que progrese hacia diabetes;15 normalmente basta con tratar el hipertiroidismo para corregir la hiperglucemia. Aún así, los niveles de insulina y el test de tolerancia de glucosa no se normalizan.7 En el caso de los perros, según nuestro conocimiento, la coexistencia de ambas enfermedades no ha sido descrita. En medicina humana, la prevalencia observada de la coexistencia de diabetes e hipertiroidismo se sitúa alrededor del 1-3,2 % en pacientes con diabetes.16-18 Por otro lado, en pacientes con hipertiroidismo debido a tiroiditis autoinmune (enfermedad de Graves), es más frecuente observar casos de diabetes tipo 1. Utilizando la prueba de tolerancia oral a la glucosa, se observó que el 41,3 % de los pacientes con enfermedad de Graves e hipertiroidismo presentaban prediabetes y el 11,3 %, diabetes.19
En el caso que se describe aquí, después de la tiroidectomía, el estado del animal mejoró y éste recuperó peso, pero no se observó una mejora del control de la glucemia. No es posible determinar en qué medida el hipertiroidismo ha influido en la aparición de la diabetes, pero los cambios ocurridos sobre el metabolismo de la glucosa parecen ser irreversibles. Tras la cirugía, los niveles de TSH se normalizaron, pero los de T4 disminuyeron por debajo del rango de referencia. Dado que desconocemos la evolución en el tiempo de la T4 y la TSH, no podemos descartar un hipotiroidismo causado de forma iatrogénica, aunque sería muy poco probable el desarrollo de hipotiroidismo permanente tras una tiroidectomía unilateral.20
En perros con masas en la región cervical, realizar una citología mediante punción ecoguiada nos puede ayudar en el diagnóstico, especialmente para confirmar el origen tiroideo de la masa en espera de la confirmación del tejido de la biopsia para diagnóstico definitivo.21 Del mismo modo, la ecografía y la Tomografía Computarizada (TC) también pueden ser útiles para evaluar el origen tiroideo de la masa, así como para valorar si hay afectación bilateral y establecer el tamaño y la invasión local o a distancia de la neoplasia. En el caso de las neoplasias tiroideas, es importante realizar una radiografía de tórax o una TC para evaluar si hay presencia de metástasis pulmonares. Para diagnosticar si la masa es funcional y está ocasionando un hipertiroidismo, se pueden medir los niveles plasmáticos de T4 total, T4 libre y TSH.2 Comúnmente los perros con hipertiroidismo presentan niveles de T4 total y libre elevados, y cabe esperar unos niveles bajos de TSH, si bien la utilidad de la TSH en el diagnóstico del hipertiroidismo canino no ha sido aún establecida.
En el presente caso clínico, la confirmación del diagnóstico de ambas enfermedades puede ser difícil por varios motivos. Por un lado, como mencionamos antes, la diabetes descompensada puede disminuir la concentración de hormonas tiroideas reduciendo la concentración de T4 hasta valores normales en un paciente hipertiroideo.12 Por tanto, se recomienda estabilizar la diabetes inicialmente antes de realizar las pruebas de función tiroidea. Por otro lado, el hipertiroidismo también puede asociarse a un estado hipercatabólico caracterizado por aumento de los requerimientos energéticos en reposo, aumento de la lipólisis, aumento de la gluconeogénesis y aceleración del recambio proteico, lo que conlleva una alteración de las pruebas para el diagnóstico y la monitorización de la diabetes, como la fructosamina o la hemoglobina glicosilada.19,22 En gatos, se ha observado que los valores de fructosamina son más bajos en los animales hipertiroideos que en los eutiroideos.22 Por otro lado, en un estudio en pacientes con enfermedad de Graves e hipertiroidismo, la Hb1Ac mostró menor sensibilidad para el diagnóstico de la diabetes frente al grupo control de pacientes con bocio eutiroideo.19
Para lograr una buena respuesta al tratamiento de la diabetes es importante realizar un diagnóstico completo y correcto de cada paciente. Si un perro diabético presenta signos clínicos compatibles con hipertiroidismo como taquicardia y taquipnea, es muy importante realizar una palpación de la región del cuello, ya que los perros hipertiroideos suelen presentar una masa palpable en dicha región. Además, en el manejo clínico debemos tener en cuenta las alteraciones en el metabolismo de la glucosa y en las pruebas diagnósticas que esta patología puede ocasionar. La presencia de un hipertiroidismo no diagnosticado en un paciente diabético puede alterar la respuesta a la insulina y también podría aumentar el riesgo cardiovascular.15,23 Aunque, de forma general, podemos concluir que para conseguir un adecuado manejo y control de la diabetes en la especie canina es clave el diagnóstico de las posibles enfermedades concurrentes.
Fuente de financiación: este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado. La descripción del caso clínico ha sido realizada durante el periodo de beca predoctoral de L. Pérez-López (Convocatoria 2015 de programa de ayudas a la investigación de la Universidad de Las Palmas de Gran Canaria).
Conflicto de intereses: los autores declaran que no existe conflicto de intereses en los datos publicados.
Bibliografía
- 1.
Wucherer KL, Wilke V. Thyroid Cancer in Dogs: An Update Based on 638 Cases (1995-2005). J Am Anim Hosp Assoc. 2010; 46:249-254.
[PubMed] - 2.
Pérez-Alenza MD and Melián C. Manual de endocrinología Veterinaria. 1ª ed. Barcelona: Multimédica Ediciones Veterinarias; 2008 p.113-127.
- 3.
Mitrou P, Raptis SA, Dimitriadis G. Insulin Action in Hyperthyroidism: A Focus on Muscle and Adipose Tissue. Endocrine Reviews (2010); 31:663-679.
[PubMed] - 4.
Dimitriadis G, Mitrou P, Lambadiari V et al. Insulin-stimulated rates of glucose uptake in muscle in hyperthyroidism: The importance of blood flow. J of Clin Endocrin and Metab. 2008; 93:2413-2415.
[PubMed] - 5.
Nedvidkova J, Haluzik M, Bartak V et al. Changes of noradrenergic activity and lipolysis in the subcutaneous abdominal adipose tissue of hypo- and hyperthyroid patients: An in vivo microdialysis study. Stress: Current Neuroendocrine and Genetic Approaches 2004;1018:541-549.
[PubMed] - 6.
Morigny P, Houssier M, Mouisel E, Langin D. Adipocyte lipolysis and insulin resistance. Biochimie. 2016;125:259-266.
[PubMed] - 7.
Hoening M, Peterson ME, Ferguson DC. Glucose tolerance and insulin secretion in spontaneously hyperthyroid cats. Res in Vet Sc 1992;53: 338-341.
[PubMed] - 8.
Brady MA, Dennis JS, Wagner-Mann C. Evaluating the use of plasma hematocrit samples to detect ketones utilizing urine dipstick colorimetric methodology in diabetic dogs and cats. J Vet Emerg and Crit care 2003;13(1):1-6.
[Wiley] - 9.
Santos Palacios S, Pascual-Corrales E, Galofre JC. Management of subclinical hyperthyroidism. Int J Endocrin Metab. 2012; 10(2):490-6.
[PMC] - 10.
Wakeling J, Elliott J, Syme H. Evaluation of Predictors for the Diagnosis of Hyperthyroidism in Cats. J Vet Intern Med. 2011;255:1057-1065.
[PubMed] - 11.
Peterson ME, Nichols R, Rishniw W. Serum thyroxine and thyroid-stimulating hormone concentration in hyperthyroid cats that develop azotaemia after radioiodine therapy. J Small Anim Pract. 2017; Sep;58(9):519-530.
[PubMed] - 12.
Mcloughlin MA. Influence of Systemic Nonthyroidal Illness on Serum Concentration of Thyroxine in Hyperthyroid Cats. J Am Anim Hosp Assoc, 1993; 29(3): p.227-234.
- 13.
Peterson ME, Melián C and Nichols R. Measurement of serum concentrations of free thyroxine, total thyroxine, and total triiodothyronine in cats with hyperthyroidism and cats with nonthyroidal disease. J Am Vet Med Assoc. 2001. 15; 218(4): 529-536.
[PubMed] - 14.
Kantrowitz LB, Peterson ME, Melián C , Nichols R. Serum total thyroxine, total triiodothyronine, free thyroxine, and thyrotropin concentrations in dogs with nonthyroidal disease. J Am Med Assoc. 2001; 219(6):765-769.
[PubMed] - 15.
Abrams-Ogg ACG. Difficult to regulate Diabetic Cats. American College of Veterinary Internal Medicine.2008.
- 16.
Perros P, McCrimmon RJ, Shaw G and Frier BM, Frequency of thyroid dysfunction in diabetic patients: value of annual screening. Diabet Med. 1995; 12(7):622-7.
[PubMed] - 17.
Nederstigt C, Crossmit EPM, de Koning EJP, Dekkers OM. Incidence and prevalence of thyroid dysfunction in type 1 diabetes. J of Diabet and Its Compl 30 (2016) 420-425.
[PubMed] - 18.
Al-Geffari M,1 Ahmad NA, Al-Sharqawi AH et al Risk Factors for Thyroid Dysfunction among Type 2 Diabetic Patients in a Highly Diabetes Mellitus Prevalent Society. Int J Endocrinol. 2013;2013:417920.
[PubMed] - 19.
Yang L, Shen X, Yan S, Yuan X, Lu J, Wei. HbA1c in the diagnosis of diabetes and abnormal glucose tolerance in patients with Graves’ hyperthyroidism_ Diabetes. Res Clin Pract. 2013;101(1):28-34.
[PubMed] - 20.
Liptak, JM. Canine thyroid carcinoma. Clin Tech in Sm Anim Pract 2007; 22:75-81.
[PubMed] - 21.
Mesa H, Rodríguez-Guisado F, Melián C, Méndez JM, Ruiz A, Muñóz MC. La citologi?a como herramienta diagno?stica: Comparativa en cinco casos clínicos confirmados mediante histopatología. Consulta Difus Vet. 2016; 236:46-54.
[Dialnet] - 22.
Graham PA, Mooney CT, Murray M. Serum fructosamine concentrations in hyperthyroid cats. Res in Vet Sc 1999;67:169-173.
[PubMed] - 23.
Kahaly GJ, Dillmann WH. Thyroid hormone action in the heart. Endocr Rev. 2005;26(5):704-28.
[PubMed]