Fallo hepático en un perro tras intoxicación por ingestión de semillas de Cycas revoluta
Liver failure in a dog after intoxication from ingestion of Cycas revoluta seeds
C. García, A. Segarra, N. Bedía, G. Cerviño
Contacto: cristina.groldan@hotmail.com
Resumen
En medicina veterinaria, las cicadáceas, como Cycas revoluta, son plantas potencialmente tóxicas. Los signos clínicos incluyen problemas gastrointestinales, hepáticos y neurológicos. No hay antídoto específico y el tratamiento es sintomático, con una mortalidad muy variable, por lo que es fundamental identificar indicadores tanto clínicos como analíticos tempranos, así como un tratamiento eficaz que disminuya los efectos de estas toxinas. En este caso se describen los signos clínicos, el manejo terapéutico y la evolución de un perro tras la ingestión de semillas de Cycas revoluta.
Palabras clave: perro, intoxicación Cycas revoluta, fallo hepático, palma de sagú, .
Clin Vet Peq Anim 2025, 45 (3): 193-197
Summary
In veterinary medicine, cycads, such as Cycas revoluta, are potentially toxic plants. Clinical signs include gastrointestinal, hepatic, and neurological problems. There is no specific antidote, and treatment is symptomatic, with a highly variable mortality rate, making it essential to identify both clinical and analytical early indicators, as well as an effective treatment to reduce the effects of these toxins. This case describes the clinical signs, therapeutic management, and the progression of a dog after ingesting Cycas revoluta seeds.
Keywords: dog, Cycas revoluta poisoning, hepatic failure, sago palm, .
Clin Vet Peq Anim 2025, 45 (3): 193-197

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
Las cicadáceas, comúnmente conocidas como “planta de sagú” o “cica”, son un grupo de plantas cuyo origen se sitúa en el sur de Japón. Cycas revoluta es la especie más difundida en nuestro país.1 La intoxicación por cícadas se ha descrito en personas y animales, principalmente en perros y rumiantes.1 Aunque todas las partes de la planta pueden ser tóxicas, las semillas y raíces presentan mayor concentración de toxinas.1 Los signos clínicos suelen desarrollarse dentro de los primeros 20 minutos hasta las 72 horas tras la ingestión e incluyen hipersalivación, vómitos y diarreas, alteraciones neurológicas, como ataxia, convulsiones y temblores, y otros propios de una hepatopatía, como ictericia, ascitis o hemorragias.1-3 Las alteraciones analíticas más comunes son el aumento de la actividad de las enzimas hepáticas, incremento en la concentración de la bilirrubina y coagulopatías.2,3 Actualmente, el tratamiento se basa en terapias de descontaminación, cuya elección dependerá del momento de la ingestión del tóxico así como del estado del paciente, y control de los signos clínicos.4 El pronóstico es variable y se reportan tasas de mortalidad de hasta el 67 % en perros.3
A continuación, se describe la evolución clínica, analítica y radiológica de un perro con este tipo de intoxicación, así como su manejo terapéutico, en una unidad de cuidados intensivos (UCI).
Caso clínico
Acude a consulta un perro mestizo, macho entero de 8 meses de edad y 15 kg de peso, sin antecedentes médicos, remitido al Servicio de Urgencias y Cuidados Intensivos por un cuadro gastrointestinal tras la ingestión de semillas de Cycas revoluta hacía 72 horas. El tutor refiere vómitos y temblores varias horas después de la ingestión y en su centro veterinario se inicia tratamiento con protector gástrico, hepático y dieta gastrointestinal, sin observar mejoría clínica.
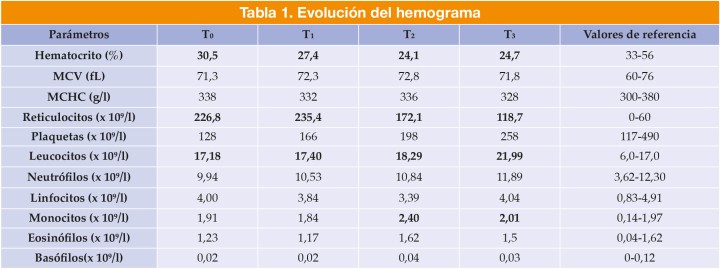
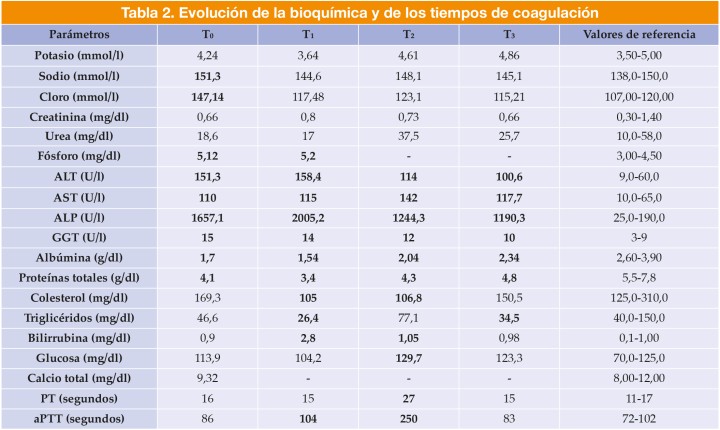
A su llegada, destaca un estado mental deprimido, una deshidratación del 8 %, una frecuencia cardíaca (FC) de 140 latidos por minuto y una palpación abdominal dolorosa con onda ascítica positiva. Entre las alteraciones analíticas (Tabla 1, T₀) cabe destacar una leve leucocitosis, anemia normocítica normocrómica regenerativa, aumento leve de la actividad de la alanina aminotransferasa (ALT), de la aspartato aminotransferasa (AST) y de la gamma glutamiltransferasa (GGT) y moderado de la fosfatasa alcalina (ALP) e hipoalbuminemia grave.
MCV: volumen corpuscular medio; MCHC: concentración de hemoglobina corpuscular media. En negrita aparecen los valores fuera de rango.
Se hospitaliza al paciente para su estabilización mediante la administración de un bolo de cristaloide isotónico (Isofundin®, 15 ml/kg en 20 minutos, IV, B. Braun Medical, S.A., Rubí) consiguiendo un índice de shock (ratio entre la FC y presión arterial sistólica) de 0,8 (valor de referencia <1). Tras la estabilización inicial, se amplía el protocolo con la realización de una ecografía de abdomen donde se visualiza una disminución del tamaño del hígado con parénquima levemente hiperecoico, efusión peritoneal moderada y estómago con pared irregular y prominencia de los pliegues. Se toma una muestra del líquido libre que es compatible con trasudado puro. Para completar el perfil analítico se miden los tiempos de protrombina (PT) y de tromboplastina parcial activada (aPTT), los valores de amoníaco y de ácidos biliares, que resultan en rango. El análisis de orina no muestra alteraciones relevantes y la lipasa pancreática específica canina (cPLI cuantitativa) no es compatible con pancreatitis.
Teniendo en cuenta la historia clínica de nuestro paciente, el examen físico y los hallazgos de las pruebas complementarias, se plantean como diagnósticos diferenciales: hepatopatía aguda/crónica agudizada, de origen tóxico seguramente o, menos probable inflamatorio/infeccioso, inmunomediado, tumoral, degenerativo o congénito. No se puede descartar la concomitancia con un proceso gastrointestinal agudo/crónico agudizado. Se consideró poco probable la coexistencia de una endocrinopatía, como Síndrome de Cushing.
Se traslada al paciente a la UCI y se inicia fluidoterapia intravenosa con una solución cristaloide isotónica de reemplazo (Isofundin®, IV, B. Braun Medical, S.A., Rubí, a dosis de mantenimiento + 8 % de deshidratación, para una vez resuelta la deshidratación mantener a dosis de mantenimiento), maropitant (Cerenia®, 1 mg/kg SID, IV, Zoetis, Bélgica), omeprazol (Omeprazol®, 1 mg/kg BID, IV, Laboratorios Normon, S.A., Tres Cantos), metamizol (Nolotil®, 25 mg/kg TID, IV, Boehringer Ingelheim España, S.A., Sant Cugat del Vallès) y protectores hepáticos: Oxomet®, silibina, fosfatidilcolina y vitamina E (Prolivet®, dosis en función del peso, PO, Bioibérica, Barcelona) y n-acetilcisteína (Flumil®, 140 mg/kg dosis única seguida de 70 mg/kg QID, IV, Zambon S.A.U., Sta. Perpètua de Mogoda).
Tras 24 horas, se observan edemas en las extremidades posteriores y región ventral del cuello y leve ictericia. Además, el paciente desarrolla taquipnea y en la T-FAST (“Focussed Assessment with Sonography for Trauma”) se evidencia leve derrame pleural. El control analítico (Tabla 1, T₁) muestra un descenso del hematocrito, empeoramiento de las enzimas hepáticas y agravamiento de los marcadores de disfunción hepática como hiperbilirrubinemia, hipocolesterolemia e hipoalbuminemia. Debido a la hipoalbuminemia y aparición de sintomatología asociada, se transfunde albúmina humana (Albutein® 20 %, Instituto Grifols, S.A., Parets del Vallès, 2 ml/kg durante 2 horas seguido de 0,2 ml/kg/h durante 10 horas IV). Los tiempos de coagulación permanecen normales.
A las 36 horas del ingreso, hay un empeoramiento clínico con la aparición de melena junto con una prolongación de los tiempos de PT y aPTT (Tabla 1, T₂) superior al 25 % confirmando la presencia de una coagulopatía (posiblemente secundaria a la disfunción hepática aguda). Ante estos hallazgos, se añade al tratamiento vitamina K (Vitamina K1 (Dômes Pharma), 5 mg/kg SID, primera dosis IV y, posteriormente, PO) y se transfunde plasma fresco congelado (10 ml/kg durante 3 horas IV). Además, hay un agravamiento de la anemia sin signos de descompensación que se asocia a la coagulopatía y al sangrado gastrointestinal.
Con la evolución del cuadro clínico y laboratorial se concluye que el diagnóstico más probable es un fallo hepático agudo por una intoxicación por Cycas revoluta.
Al tercer día de hospitalización, hay una mejoría en el estado clínico. El hemograma y la bioquímica (Tabla 1, T₃) reflejan un incremento en el valor del hematocrito, un aclaramiento de las enzimas hepáticas y una mejoría de los marcadores de disfunción hepática (Tabla 2, T₃).
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; ALP: fosfatasa alcalina; GGT: gamma glutamiltransferasa; PT: tiempo de protrombina; aPTT: tiempo de tromboplastina parcial activada. En negrita aparecen los valores fuera de rango.
El paciente presenta una evolución clínica satisfactoria y se procede al alta hospitalaria tras 5 días ingresado. Se establece tratamiento ambulatorio que incluye protector hepático, gastroprotector y vitamina K.
Discusión
Cycas revoluta es una planta ornamental popular utilizada como fuente de alimentación o con fines medicinales y decorativos.5-6 Se describen tres tipos de toxinas: cicasina, β-metilamino-l-alanina y un compuesto no identificado de alto peso molecular.6-7 La cicasina es un azoxiglucósido que se hidroliza a la especie tóxica metilazoximetanol, con capacidad hepatotóxica causando necrosis hepática coagulativa centrolobulillar y de la zona media e irritación gastrointestinal; además, presenta actividad cancerígena, mutagénica y teratogénica.8 La β-metilamino-l-alanina se relaciona con enfermedades neurodegenerativas en la especie humana.9-10 Por último, se sospecha que el compuesto no identificado podría causar parálisis de las extremidades posteriores y degeneración axonal en el sistema nervioso central.5-6
Cuando la exposición es mediante ingestión, estas toxinas causan signos gastrointestinales, neurológicos y daño hepático;7 sin embargo, otra forma de exposición es la vía dérmica que genera inflamación, edema, prurito o dolor.1 Los signos clínicos varían según la dosis consumida y absorbida, el tiempo de exposición, la parte de la planta ingerida y el tipo de toxina.2
En pacientes caninos se ha descrito que algunos de los signos clínicos aparecen dentro de las primeras 4 horas tras la ingestión; por el contrario, las anomalías clinicopatológicas pueden no observarse hasta 72 horas después. Estas incluyen elevación en la actividad de la ALT, AST y ALP, hipoproteinemia, elevación de la bilirrubina, trombocitopenia y coagulopatía.3-7
En nuestro caso, el tutor confirmó que el paciente había ingerido 5-6 semillas de Cycas revoluta por lo que, aunque se realizaron pruebas laboratoriales para descartar otro posible origen, se concluyó que nuestro paciente presentaba una insuficiencia hepática aguda de origen tóxico. En el momento del ingreso, había alteración hepática con elevación de la ALT, ALP, AST, GGT e hipoalbuminemia. Tras varias horas de hospitalización, se evidenció un incremento en la concentración de bilirrubina, así como una alteración de la hemostasia secundaria con una prolongación de los tiempos de coagulación, lo que puso de manifiesto una insuficiencia hepática grave.
Un estudio reveló una tasa de mortalidad superior al 50 % y determinó que la actividad inicial de la ALT, los tiempos de coagulación, las concentraciones de bilirrubina y albúmina y un descenso en el número de plaquetas eran los parámetros más útiles para determinar el pronóstico.10 En cuanto a la alteración en los tiempos de coagulación, en este caso lo más probable es que fuese debido a una disfunción hepática, ya que hay otros marcadores como la hipoalbuminemia y la hiperbilirrubinemia que apoyan el fallo hepático.
Dada la gravedad de los signos clínicos y la falta de un antídoto específico, el tratamiento se basa en la descontaminación para prevenir/limitar la absorción de toxinas4-5 y en el soporte individualizado mediante fluidoterapia vía intravenosa para asegurar la perfusión tisular y mantener un equilibro hídrico y electrolítico.5 La descontaminación habitualmente consiste en una combinación de emesis, adsorción y, en algunos casos, de lavado gástrico.4 Considerando que nuestro paciente había ingerido la toxina hacía más de 24 horas, la inducción del vómito y la descontaminación gastrointestinal no se contempló. La inducción de la emesis se considera más eficaz cuando se realiza varias horas después de la ingestión y siempre que el paciente se encuentre estable y sin deterioro neurológico. El lavado gástrico se realiza en aquellos pacientes donde el vómito está contraindicado; la tasa de recuperación es inferior al 20 % después de 1 hora y disminuye considerablemente con el tiempo. En cuanto a la administración del carbón activo (con o sin catártico), puede estar justificada incluso si la emesis se ha realizado de forma exitosa. El carbón activo oral es un adsorbente que reduce la absorción gastrointestinal de toxinas, sobre todo de aquellas que son poco solubles en agua y de alto peso molecular.4 En el caso del metilazoximetanol (principal toxina activa de las cícadas), se caracteriza por ser soluble en agua y tener bajo peso molecular, lo que suscita un gran interés en el empleo del carbón activo en esta intoxicación, sospechando que la presencia de un catártico en el carbón activado podría explicar el beneficio observado en su uso.3 La administración de enemas, aunque se encuentra en estudio, podría ser útil por el metabolismo y la absorción de estas toxinas.4
El resto de la terapia se basó en medidas paliativas para la gastroenteritis y suplementos hepatoprotectores.4 Entre los nutracéuticos recomendados se incluyen la S-adenosil metionina (SAMe), la silimarina, la vitamina E y la n-acetilcisteína.3-12 En el caso clínico descrito, se emplea la vitamina E y n-acetilcisteína por sus efectos antioxidantes.
La administración de plasma fresco congelado y vitamina K está recomendada en alteraciones secundarias de la hemostasia.4-12 En nuestro caso se inició la suplementación con vitamina K y se realizó una transfusión de plasma fresco congelado consiguiendo una reducción de la PT y de la aPTT. En situaciones de sangrados profusos se recomienda la administración de concentrado de eritrocitos o incluso sangre entera.12
En conclusión, la insuficiencia hepática por intoxicación por Cycas revoluta es una enfermedad grave y potencialmente mortal. En opinión de los autores, es interesante centrar la investigación en nuevas terapias de descontaminación, ya que son clave en el aumento de la tasa de supervivencia. El diagnóstico temprano y una rápida actuación son fundamentales en el pronóstico de los pacientes.
Fuente de financiación: artículo esponsorizado por Dômes Pharma.
Conflicto de intereses: la autora declara que este artículo es una colaboración con Dômes Pharma.
Bibliografía
- 1.
Forrester MB, Layton GM, Varney SM: Cycas revoluta (sago cycad) exposures reported to Texas poison centers. Am J Emerg Med 2020; 38(8): 1611-1615.
[PubMed] - 2.
Albretsen JC, Khan SA, Richardson JA. Cycad palm toxicosis in dogs: 60 cases (1987-1997). J Am Vet Med Assoc 1998; 213(1): 99-101.
[PubMed] - 3.
Lake BB, Edwards T, Atiee G, Stone R, Scott L. The characterization of cycad palm toxicosis and treatment effects in 130 dogs. Aust Vet J 2020; 98(11): 555-562.
[PubMed] - 4.
Fatourechi L, DelGiudice LA, Sookhoo N. (2013). Sago palm toxicosis in dogs. Compend Contin Edu Vet 2013; 35(4): e1-8.
- 5.
Maeso C, Morales C, Obrador R, Abarca E, Carrera I: Presumptive Cycad Toxicosis in a Dog, Clinical and Magnetic Resonance Imaging Findings: A Case Report. Frontiers in Veterinary Scienc. 2020; 7: 468.
[PubMed] - 6.
Cortinovis C, Caloni F: Epidemiology of intoxication of domestic animals by plants in Europe. Vet J 2013; 197(2): 163-168.
[PubMed] - 7.
Clarke C, Burney D: Cycad Palm Toxicosis in 14 Dogs from Texas. J Am Anim Hosp Assoc 2017; 53 (3): 159-166.
[PubMed] - 8.
San Andrés Larrea MI, San Andrés Larrea MD, Rodriguez Fernández C: Plants, Poisonous (Animals). En Philip Wexler (ed): Encyclopedia of Toxicology (Third Edition), Academic Press, 2014, Pages 960-969.
- 9.
Spencer PS, Edwin Garner C, Palmer VS, Kisby GE: Chapter 11 - Environmental Neurotoxins Linked to a Prototypical Neurodegenerative Disease. En Michael Aschner, Lucio G. Costa (ed): Environmental Factors in Neurodevelopmental and Neurodegenerative Disorders, Academic Press, 2015, Pages 211-252.
- 10.
Rivadeneyra-Domínguez E, Rodríguez-Landa J. Cycads and their association with certain neurodegenerative diseases. Neurologia (English Edition) 2014; 29 (9): 517-522.
[PubMed] - 11.
Ferguson D, Crowe M, McLaughlin L, Gaschen F: Survival and prognostic indicators for cycad intoxication in dogs. J Vet Intern Med 2011; 25(4): 831-837.
[PubMed] - 12.
Berent A: Chapter 113-Hepatic failure, En: Deborah C. Silverstein, Kate Hopper (ed): Small Animal Critical Care Medicine (Third Edition), W.B. Saunders, 2023, Pages 664-665.