Factores clínicos y patológicos importantes en el pronóstico del mastocitoma canino
Main clinical and pathological prognostic factors in canine mast cell tumors
P. Clemente-Vicario, C. Naranjo-Freixa
Contacto: clemente@colvet.es
Resumen
El mastocitoma es el tumor maligno de piel y tejido subcutáneo más frecuentemente diagnosticado en el perro. Su comportamiento biológico y la supervivencia de los perros puede ser muy variable y se han investigado distintos factores para tratar de predecir su agresividad y poder ofrecer el tratamiento adecuado a cada caso. Actualmente hay una variedad de pruebas de laboratorio disponibles, aunque no todas tienen el mismo efecto en la predicción del pronóstico. Se revisan a continuación aquellos factores, clínicos o patológicos, que han mostrado tener un valor pronóstico y ser importantes en la toma de decisiones clínicas.
Palabras clave: mastocitoma, pronóstico, grado, recuento mitótico.
Clin. Vet. Peq. Anim, 2018, 38 (4): 235 - 240
Summary
Mast cell tumor is the malignant tumor of the skin and subcutaneous tissue most frequently diagnosed in the dog. Their biological behavior and the survival of dogs can be very variable and different factors have been investigated to try to predict their aggressiveness and be able to offer the appropriate treatment in each case. Currently there is a variety of laboratory tests available although not all of them have the same effect in predicting the prognosis. We review here those factors, clinical or pathological, that have been shown to have a prognostic value and be important for clinical decisions.
Keywords: mast cell tumor, prognosis, grade, mitotic count.
Clin. Vet. Peq. Anim, 2018, 38 (4): 235 - 240

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
El mastocitoma canino es un tumor frecuente con un comportamiento clínico y una supervivencia muy variable (Figs. 1 y 2). Un porcentaje de estos casos se presentan con metástasis a linfonodo regional o a distancia en el momento del diagnóstico. A diferencia de otros tumores, las metástasis a distancia suelen ser en hígado o bazo, y no en pulmones. Los avances en las técnicas diagnósticas han supuesto una mejora en el conocimiento del tumor, pero no todos los datos se han podido usar para predecir su comportamiento o su respuesta al tratamiento.
El objetivo de este trabajo es revisar aquellos factores, clínicos o patológicos, que han mostrado tener un valor pronóstico y ser importantes en la toma de decisiones clínicas.
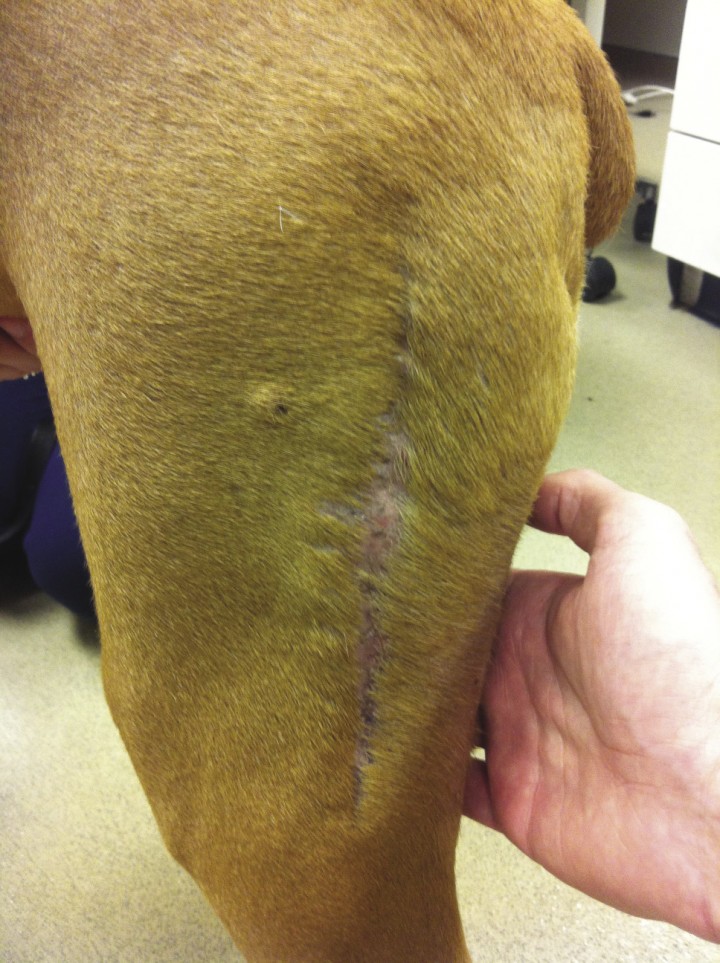
Figura 1
Nódulo de unos milímetros cercano a la cicatriz de un mastocitoma previo.
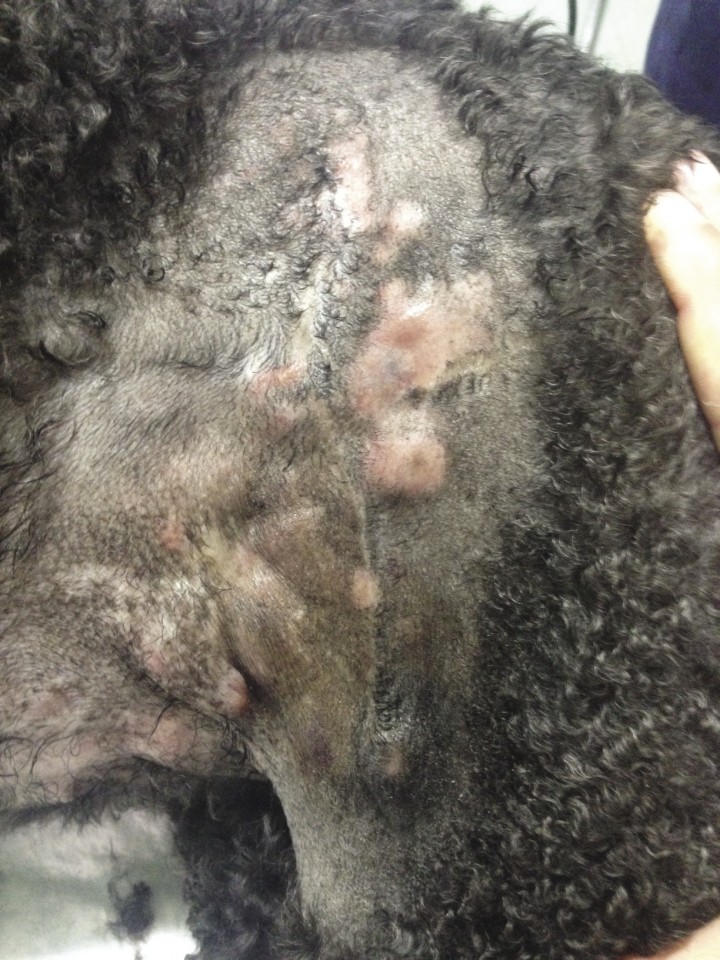
Figura 2
Múltiples nódulos grandes y mal delimitados a lo largo de toda la cicatriz de un mastocitoma.
Factores patológicos
El grado histológico de malignidad ha sido tradicionalmente usado para clasificar los mastocitomas cutáneos. La clasificación de Patnaik1 de 1984 usó 83 casos de mastocitoma, operados con márgenes amplios y sin evidencia de tumor tras la cirugía, que no recibieron tratamiento médico postquirúrgico. Los casos tuvieron un seguimiento de cuatro años. El 93 % de los casos de grado I sobrevivieron al menos 4 años, mientras que este porcentaje fue del 47 % en los de grado II y solo del 6 % en los de grado III. No se encontraron diferencias en otros factores como la edad o el género de los animales. Este sistema ha sido ampliamente utilizado para predecir el pronóstico de los mastocitomas caninos.
La clasificación de Patnaik predice de forma fiable el pronóstico de la gran mayoría de los mastocitomas de grado I y III, pero no de los de grado II en los que aproximadamente la mitad tienen un comportamiento biológico agresivo. Además, a la hora de aplicarla se han documentado desacuerdos entre los patólogos. Un estudio donde 60 muestras de mastocitoma fueron evaluadas por 10 patólogos (8 diplomados y 2 tras haber completado la residencia de patología) obtuvo un acuerdo total en lo que se refiere al grado histológico en solo 4 de los 60 tumores.2 Dos factores de desacuerdo entre los patólogos a la hora de clasificar los tumores en este estudio fueron la infiltración del subcutáneo y la presencia de mitosis (en la clasificación de Patnaik ambos suponen al menos grado II, mientras que en otras referencias anteriores3 se podían incluir en grado I).
Debido a esta falta de repetibilidad y de capacidad pronóstica para el grado II, un grupo de patólogos propuso una nueva clasificación (Kiupel) donde los mastocitomas son divididos en solo dos grupos: grado bajo o alto.4 En este estudio, 28 patólogos evaluaron 95 tumores. El acuerdo al aplicar la clasificación original de Patnaik fue del 63 % para los grados I y II y del 75 % para el grado III. Seis patólogos evaluaron posteriormente todas las muestras para aplicar la nueva clasificación, siendo el acuerdo del 97 %. El tiempo libre de enfermedad y la supervivencia fueron significativamente mayores en los de bajo grado (14 meses y 85 meses) que en los de alto grado (8 y 10 meses, respectivamente). Así, la nueva clasificación parece tener menor variabilidad entre patólogos y ofrece buena información pronóstica para ambos grupos. Se consideró un mastocitoma de alto grado si presentaba al menos uno de los siguientes hallazgos (nótese que estos parámetros han de buscarse en la zona de mayor actividad mitótica y con mayor anisocariosis):
- 7 figuras mitóticas o más en 10 campos de alto aumento,
- 3 o más células multinucleadas (3 o más núcleos) en 10 campos de alto aumento,
- 3 o más núcleos anormales (atípicos, segmentados, de forma irregular) en 10 campos de alto aumento,
- cariomegalia (al menos el 10 % de las células neoplásicas con núcleos el doble de grande).
La combinación de ambas clasificaciones (p. ej., grado II (Patnaik), bajo grado (Kiupel) frente a grado II, alto grado) ayuda a definir mejor el pronóstico de los mastocitomas de grado II.5 En este estudio, todos los tumores de grado I fueron de grado bajo, y todos los de grado III, de alto grado, por lo que el beneficio en la información pronóstica se observó solamente en los de grado II. Por ello, la recomendación es informar con ambas clasificaciones6 y es lo que sugieren diferentes grupos de trabajo sobre mastocitoma (Veterinary Cancer Society, Brazilian Consensus for the diagnosis, treatment and prognosis of cutaneous mast cell tumors in dogs).
Sin embargo, a pesar de la importancia del grado histológico en el pronóstico, son necesarios otros factores que puedan ayudar a predecir el comportamiento biológico de la enfermedad, ya que mastocitomas con un mismo grado de malignidad pueden tener distinto comportamiento biológico.
El número total de mitosis en 10 campos de alto aumento (400x) en la zona con mayor actividad mitótica del tumor (método de selección del campo) es una medida indirecta de la proliferación celular. Debe informarse como recuento mitótico y no como índice mitótico.7 El recuento mitótico tiene la ventaja de que puede realizarse con la tinción rutinaria de hematoxilina-eosina sin ser necesarias técnicas de inmunohistoquímica. El recuento mitótico es un factor pronóstico predictivo de la supervivencia en casos de mastocitoma: un recuento de seis o más fue indicativo de un peor pronóstico independientemente del grado histológico del tumor, mientras que entre cero y cinco, el pronóstico fue mejor.8
Se ha propuesto el uso de diferentes marcadores como Ki67 (que identifica células en cualquier fase activa del ciclo celular) o AgNOR (que es un índice de proliferación) o la combinación de ambos como una forma más precisa de evaluar la proliferación celular de un tumor,9 aunque no hay un punto de corte claramente establecido dado que diferentes estudios usaron diferentes técnicas (células positivas de cada mil, células positivas en espacio de la rejilla microscópica) y distintos puntos de corte.
Ki67 no es un factor necesario para clasificar los mastocitomas como alto o bajo grado.4 Además, al comparar el recuento mitótico con el índice Ki67, ambos parámetros fueron capaces de identificar los mastocitomas con peor pronóstico10 de forma independiente de otros factores. Aquellos tumores con recuento mitótico de 6 o más se asociaron con una supervivencia más corta (26 % de perros vivos al año del diagnóstico) que los casos con recuento mitótico entre cero y cinco (83 % de animales vivos al año). De forma similar, los casos con un índice Ki67 menor a 0,01 presentaron un 80 % de supervivencia al año frente al 42 % si Ki67 era superior a 0,01.
Sin restar importancia a la información que distintos marcadores de proliferación celular puedan ofrecer, es importante tener en cuenta que una información muy similar, en lo que se refiere a su valor pronóstico, puede obtenerse simplemente de un recuento mitótico, sin necesidad de técnicas especiales de tinción. El recuento mitótico debe incluirse en el informe de histopatología como número absoluto de mitosis en el número de campos evaluados (idealmente un mínimo de 10 campos).11 En caso de muestras de pequeño tamaño, debe informarse como el número total de mitosis en el número de campos evaluados (p. ej., 7 mitosis en 6 campos de alto aumento).
Sin embargo, cabe señalar que a pesar de su importancia en el pronóstico del mastocitoma, el recuento mitótico no puede usarse como único factor a tener en cuenta, ya que un 30 % de los mastocitomas de alto grado tienen un recuento bajo,9 por lo debe interpretarse con el resto de los factores clínicos y patológicos.
La proliferación de mastocitos está normalmente regulada por un receptor de la membrana denominado KIT (CD117), presente en los mastocitos y en otras células como las células de Cajal en el intestino. Esta proteína KIT está codificada por el protooncogen c-kit. En un estudio, la descripción de una mutación en el gen c-kit ayudó a comprender la causa de algunos de los mastocitomas caninos.12 Esta mutación provoca una activación continua de las señales de proliferación celular mediante la fosforilación del receptor KIT. Distintos estudios han comunicado una incidencia de la mutación de entre el 8 y el 60 % de los mastocitomas13-16 y un peor pronóstico en los casos con mutación.
La presencia de este receptor puede evidenciarse mediante inmunohistoquímica y se han descrito tres patrones de tinción: localizada en la membrana celular, de forma difusa en el citoplasma y localizada de forma paranuclear, esta última observada en los mastocitomas y las dos primeras en mastocitos normales.17 Además, se ha observado una relación de estos patrones con el grado histológico del tumor o los índices de proliferación,18,19 siendo el patrón citoplasmático o paranuclear más frecuente en tumores más agresivos y el patrón de membrana más común en tumores de bajo grado. Sin embargo, en tumores de grado II pueden observarse todos los patrones.
Se ha intentado ver una relación entre el patrón de expresión de KIT y la mutación en c-kit y aunque en el patrón I (localizado en la membrana celular) no se observaron casos con mutación, en los patrones II y III (difuso en el citoplasma y paranuclear, respectivamente) hubo casos tanto con mutación como sin ella, por lo que no puede usarse esta técnica de inmunohistoquímica para predecir la presencia de mutación en el tejido tumoral.20
Dado que la activación de KIT es mediante fosforilación de la proteína, se ha investigado si la fosforilación puede usarse como factor pronóstico del comportamiento del tumor o si guarda relación con la presencia de mutación en c-kit. En el estudio, se observó que aunque la presencia de proteína fosforilada (pKIT) se asoció con un peor pronóstico, ésta se identificó tanto en tumores con la mutación como sin ella, por lo que no puede usarse para predecir la presencia de mutación.21 Además, la existencia de pKIT estaba fuertemente relacionada con otros factores pronósticos como el recuento mitótico o el grado histológico. Hallazgos similares que evidencian la relación entre pKIT y el grado histológico han sido publicados posteriormente.22
Diferentes estudios han evaluado los márgenes quirúrgicos necesarios para una escisión completa del tumor y la relación de estos márgenes con el riesgo de recurrencia local,23-26 evidenciando que el riesgo de recurrencia es mayor en tumores de alto grado (incluso con márgenes limpios) que en los de bajo grado. Como ocurre con otros factores descritos, no puede usarse como único parámetro, ya que no todos los tumores extirpados de forma incompleta recurren. La información sobre los márgenes ha de incluirse en el informe de patología siguiendo las recomendaciones publicadas.11 La descripción tiene que ser detallada e incluir la distancia (mm) entre las células tumorales y el borde quirúrgico, evitando términos ambiguos como estrecho o cercano. El uso de tinciones por parte del clínico ayudará al patólogo a identificar los diferentes márgenes quirúrgicos.
Factores clínicos
La raza y la edad parecen ser factores importantes en el comportamiento biológico de los mastocitomas, ya que hay razas que se asocian con tumores de alto grado y otras con lesiones de bajo grado. Mientras que en las razas braquicefálicas la mayoría de los mastocitomas son de bajo grado,27 el Shar Pei presenta un alto riesgo de que los mastocitomas sean de alto grado.28 Los mismos estudios encontraron que la gran mayoría de los mastocitomas en perros jóvenes eran de bajo grado, mientras que con la edad aumentan los tumores de alto grado, siendo la incidencia mayor en perros mayores de 11 años.
La localización anatómica parece estar relacionada en parte con el grado del tumor, ya que en localizaciones como el torso, la cabeza, la cola o las extremidades, más del 80 % de los tumores son de bajo grado, mientras que en la zona perineal, inguinal o del escroto tienden a ser de alto grado.28
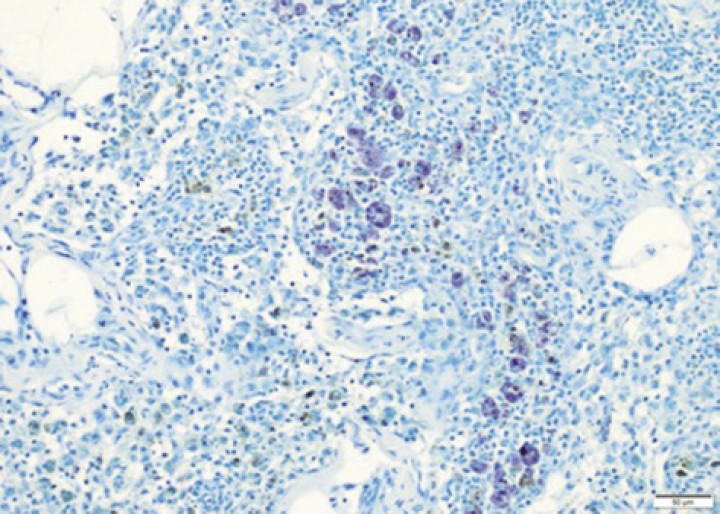
La extensión de la enfermedad en el momento del diagnóstico (estadio clínico) es importante también para el pronóstico. El riesgo de metástasis a linfonodo y a distancia (hígado y bazo) en el momento del diagnóstico es del 30 % y el 7 %, respectivamente,29 aunque en algunas localizaciones como el morro, hasta el 58 % de los casos tienen metástasis en linfonodo en el momento del diagnóstico.30 Este riesgo de metástasis depende del grado histológico,31 siendo del 6 %, el 16 % y el 50 % para los grados I, II y III, respectivamente, y si se usa la clasificación de 2011, del 15 % y el 30 % para los grados bajo y alto. Es muy poco frecuente que se observen metástasis a distancia sin que haya metástasis en linfonodos.29,32 Es necesaria la citología de hígado y bazo para detectar la presencia de metástasis, ya que la sensibilidad de la ecografía es muy baja.33 Cambios ecográficos pueden ser debidos a patologías no relacionadas con el mastocitoma y órganos ecográficamente normales pueden presentar metástasis. El uso de la tinción de azul de toluidina puede facilitar la visualización de los mastocitos y ayudar a diagnosticar los casos de metástasis (Fig. 3).
Figura 3
Biopsia de linfonodo con la tinción de azul de toluidina, donde se identifican algunos mastocitos. 20x. Imagen cortesía de laboratorios IDEXX.
En un estudio de mastocitomas con metástasis a distancia en el momento del diagnóstico,32 la mitad de los casos eran mastocitomas de grados I o II (según la clasificación de Patnaik), el 35 % eran de bajo grado (según la clasificación de Kiupel) y la mitad de los casos presentaron mutación en c-kit, lo que pone de manifiesto la limitación de cada uno de los factores si se interpreta de forma individual.
Predicción de respuesta a terapia
Predecir el comportamiento tumoral puede ayudar a decidir el tratamiento a instaurar. Sería especialmente interesante poder predecir la respuesta a los tratamiento moleculares como los inhibidores del receptor KIT (los dos inhibidores actualmente aprobados en España son masitinib y toceranib). Se ha observado una mayor tasa de respuesta a toceranib en caso de mutación en el exón 11 del gen c-kit: 60 % de respuesta en los tumores con la mutación y 30 % en los tumores sin la mutación.34
A pesar de una mayor probabilidad de respuesta, diferentes trabajos han mostrado que ni la presencia de mutación ni el patrón de localización de KIT evidenciado con la inmunohistoquímica pueden predecir la respuesta al tratamiento con inhibidores de la tirosina quinasa35,36 y es necesario comenzar el tratamiento para saber qué caso responde y cuál no. La tasa de respuesta a toceranib y a vinblastina es similar independientemente de que exista o no mutación en el exón 11.35 En el caso de masitinib, la tasa de respuesta es de alrededor del 50 % (similar al 36 % del grupo placebo) y su uso mejora la supervivencia solo en tumores que presentan la mutación,16 aunque esto no implica que todos los casos con mutación respondan.
Tampoco la presencia de KIT fosforilado sirve para predecir la respuesta, ya que no hay relación entre la existencia de pKIT en el tumor y la respuesta a toceranib de acuerdo con un estudio donde solo 4 de 7 casos con expresión de pKIT respondieron a toceranib fosfato.22
Conclusión
Tal y como se ha descrito, no hay ningún factor patológico o clínico que pueda predecir por sí solo el comportamiento del mastocitoma. Es necesario combinarlos y tener en cuenta distintos datos para poder determinar el pronóstico y decidir el tratamiento. Desde el punto de vista clínico, la raza, la edad, los signos clínicos y el estadio clínico son fundamentales y deben incluirse en la historia clínica que se remite al laboratorio de patología. El informe de patología debe incluir siempre el grado histológico de malignidad (preferiblemente usando las dos clasificaciones), el recuento mitótico y los bordes quirúrgicos dada su importancia pronóstica. Todos estos datos pueden obtenerse con las tinciones habituales. En la evaluación de metástasis, puede considerarse el uso de tinciones especiales como el azul de toluidina. Otros factores que requieren inmunohistoquímica o diagnóstico molecular pueden considerarse, pero no cambian de forma significativa la información pronóstica obtenida con los descritos anteriormente.
Fuente de financiación: este trabajo no se realizó con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Patnaik AK, Ehler WJ, MacEwen EG. Canine cutaneous mast cell tumor: morphologic grading and survival time in 83 dogs. Vet Pathol. 1984;21(5):469-474.
[PubMed] - 2.
Northrup NC, Harmon BG, Gieger TL, et al. Variation among pathologists in histologic grading of canine cutaneous mast cell tumors. J of Vet Diagnos Investigation. 2005;17(3):245-248.
[PubMed] - 3.
Bostock DE. The prognosis following surgical removal of mastocytomas in dogs. J Small Anim Pract. 1973;14(1):27-41.
[PubMed] - 4.
Kiupel M, Webster JD, Bailey KL, et al. Proposal of a 2-tier histologic grading system for canine cutaneous mast cell tumors to more accurately predict biological behavior. Vet Pathol 2011;48(1):147-155.
[PubMed] - 5.
Sabattini S, Scarpa F, Berlato D, Bettini G. Histologic Grading of Canine Mast Cell Tumor: Is 2 Better Than 3? Vet Pathol 2014. doi:10.1177/0300985814521638.
[PubMed] - 6.
Reagan JK, Selmic LE, Fallon C, Driskell EA, Garrett LD. Evaluation of information presented within mast cell tumour histopathology reports in the United States: 2012-2015. Vet Med Sci. 2018;4(3):252-262.
[PubMed] - 7.
Meuten DJ, Moore FM, George JW. Mitotic Count and the Field of View Area: Time to Standardize. Vet Pathol 2016;53(1):7-9.
[PubMed] - 8.
Romansik EM, Reilly CM, Kass PH, Moore PF, London CA. Mitotic Index Is Predictive for Survival for Canine Cutaneous Mast Cell Tumors. Vet Pathol. 2007;44(3):335-341.
[PubMed] - 9.
Sledge DG, Webster J, Kiupel M. Canine cutaneous mast cell tumors: A combined clinical and pathologic approach to diagnosis, prognosis, and treatment selection. Vet J. 2016;215:43-54.
[PubMed] - 10.
Berlato D, Murphy S, Monti P, et al. Comparison of mitotic index and Ki67 index in the prognostication of canine cutaneous mast cell tumours. Vet and Comp Oncol. 2015;13(2):143-150.
[PubMed] - 11.
Kamstock DA, Ehrhart EJ, Getzy DM, et al. Recommended Guidelines for Submission, Trimming, Margin Evaluation, and Reporting of Tumor Biopsy Specimens in Veterinary Surgical Pathology. Vet Pathol. 2011;48(1):19-31.
[PubMed] - 12.
London CA, Galli SJ, Yuuki T, Hu Z, Helfand SC, Geissler EN. Spontaneous canine mast cell tumors express tandem duplications in the proto-oncogene c-kit. Exp Hematol. 1999;27:689-697.
[PubMed] - 13.
Downing S, Chien MB, Kass PH, Moore PE, London CA. Prevalence and importance of internal tandem duplications in exons 11 and 12 of c-kit in mast cell tumors of dogs. Am J of Vet Res. 2002;63(12):1718-1723.
[PubMed] - 14.
Reguera MJ, Ferrer L, Rabanal RM. Evaluation of an intron deletion in the c-kit gene of canine mast cell tumors. Am J of Vet Res. 2002;63(9):1257-1261.
[PubMed] - 15.
London CA, Hannah AL, Zadovoskaya R, et al. Phase I dose-escalating study of SU11654, a small molecule receptor tyrosine kinase inhibitor, in dogs with spontaneous malignancies. Clin Cancer Res. 2003;9(July):2755-2768.
[PubMed] - 16.
Hahn KA, Ogilvie G, Oglivie G, et al. Masitinib is safe and effective for the treatment of canine mast cell tumors. J Vet Intern Med. 2008;22(6):1301-1309.
[PubMed] - 17.
Morini M, Bettini G, Preziosi R, Mandrioli L. C-kit gene product (CD117) immunoreactivity in canine and feline paraffin sections. J Histochem Cytochem. 2004;52(5):705-708.
[PubMed] - 18.
Preziosi R, Morini M, Sarli G. Expression of the KIT protein (CD117) in primary cutaneous mast cell tumors of the dog. J of Vet Diagnos Investigation.2004;16(6):554-561.
[PubMed] - 19.
Gil da Costa RM, Matos E, Rema A, Lopes C, Pires MA, Gärtner F. CD117 immunoexpression in canine mast cell tumours: correlations with pathological variables and proliferation markers. BMC Vet Res. 2007;3(1):19.
[PubMed] - 20.
Sailasuta A, Ketpun D, Piyaviriyakul P, Theerawatanasirikul S, Theewasutrakul P, Rungsipipat A. The Relevance of CD117-Immunocytochemistry Staining Patterns to Mutational Exon-11 in c-kit Detected by PCR from Fine-Needle Aspirated Canine Mast Cell Tumor Cells. Vet Med Int. 2014;2014(5):787498-787498.
[PubMed] - 21.
Thompson JJ, Morrison JA, Pearl DL, et al. Receptor Tyrosine Kinase Expression Profiles in Canine Cutaneous and Subcutaneous Mast Cell Tumors. Vet Pathol 2016;53(3):545-558.
[PubMed] - 22.
Halsey CHC, Thamm DH, Weishaar KM, et al. Expression of Phosphorylated KIT in Canine Mast Cell Tumor. Vet Pathol. 2017;54(3):387-394.
[PubMed] - 23.
Simpson AM, Ludwig LL, Newman SJ, Bergman PJ, Hottinger HA, Patnaik AK. Evaluation of surgical margins required for complete excision of cutaneous mast cell tumors in dogs. J Am Vet Med Assoc. 2004;224(2):236-240.
[PubMed] - 24.
Fulcher RP, Ludwig LL, Bergman PJ, Newman SJ, Simpson AM, Patnaik AK. Evaluation of a two-centimeter lateral surgical margin for excision of grade I and grade II cutaneous mast cell tumors in dogs. J Am Vet Med Assoc. 2006;228(2):210-215.
[PubMed] - 25.
Pratschke KM, Atherton MJ, Sillito JA, Lamm CG. Evaluation of a modified proportional margins approach for surgical resection of mast cell tumors in dogs: 40 cases (2008-2012). J Am Vet Med Assoc. 2013;243(10):1436-1441.
[PubMed] - 26.
Donnelly L, Mullin C, Balko J, et al. Evaluation of histological grade and histologically tumour-free margins as predictors of local recurrence in completely excised canine mast cell tumours. Vet and Comp Oncol. 2015;13(1):70-76.
[PubMed] - 27.
Mochizuki H, Motsinger-Reif A, Bettini C, Moroff S, Breen M. Association of breed and histopathological grade in canine mast cell tumours. Vet and Comp Oncol. 2017;15(3):829-839.
[PubMed] - 28.
Śmiech A, Ślaska B, Łopuszyński W, Jasik A, Bochyńska D, Dąbrowski R. Epidemiological assessment of the risk of canine mast cell tumours based on the Kiupel two-grade malignancy classification. Acta Vet Scandin. 2018;60(1):70.
[PMC] - 29.
Warland J, Amores-Fuster I, Newbury W, Brearley M, Dobson J. The utility of staging in canine mast cell tumours. Vet and Comp Oncol. 2014;12(4):287-298.
[PubMed] - 30.
Gieger TL, Théon AP, Werner JA, McEntee MC, Rassnick KM, DeCock HEV. Biologic behavior and prognostic factors for mast cell tumors of the canine muzzle: 24 cases (1990-2001). J Vet Intern Med. 2003;17(5):687-692.
[PubMed] - 31.
Stefanello D, Buracco P, Sabattini S, et al. Comparison of 2- and 3-category histologic grading systems for predicting the presence of metastasis at the time of initial evaluation in dogs with cutaneous mast cell tumors: 386 cases (2009-2014). J Am Vet Med Assoc. 2015;246(7):765-769.
[PubMed] - 32.
Pizzoni S, Sabattini S, Stefanello D, et al. Features and prognostic impact of distant metastases in 45 dogs with de novo stage IV cutaneous mast cell tumours: A prospective study. Vet and Comp Oncol. 2018;16(1):28-36.
[PubMed] - 33.
Book AP, Fidel J, Wills T, Bryan J, Sellon R, Mattoon J. Correlation of ultrasound findings, liver and spleen cytology, and prognosis in the clinical staging of high metastatic risk canine mast cell tumors. Vet Radiol & Ultrasound. 2011;52(5):548-554.
[PubMed] - 34.
London CA, Malpas PB, Wood-Follis SL, et al. Multi-center, Placebo-controlled, Double-blind, Randomized Study of Oral Toceranib Phosphate (SU11654), a Receptor Tyrosine Kinase Inhibitor, for the Treatment of Dogs with Recurrent (Either Local or Distant) Mast Cell Tumor Following Surgical Excision. Clin Cancer Res. 2009;15(11):3856-3865.
[PubMed] - 35.
Horta RDS, Giuliano A, Lavalle GE, et al. Clinical, histological, immunohistochemical and genetic factors associated with measurable response of high-risk canine mast cell tumours to tyrosine kinase inhibitors. Oncol Lett. 2018;15(1):129-136.
[PubMed] - 36.
Weishaar KM, Ehrhart EJ, Avery AC, et al. c-Kit Mutation and Localization Status as Response Predictors in Mast Cell Tumors in Dogs Treated with Prednisone and Toceranib or Vinblastine. J Vet Intern Med. 2018;32(1):394-405.
[PubMed]