Caso clínico de Oftalmología
C. Cabo-Álvarez, F. Sanz-Herrera
Contacto: christiancabo@hotmail.com
Historia clínica
Una hembra de Husky Siberiano esterilizada, de 2,5 años de edad y 25 kg de peso fue referida a nuestro centro por presentar afectación ocular bilateral, decaimiento, hiporexia y lesiones dermatológicas que afectaban a la trufa y los belfos. El paciente convive con otro perro de la misma raza que no muestra ninguna sintomatología.
El animal había sido tratado previamente por su veterinario con un colirio con tobramicina y dexametasona (Tobradex®, Alcon Cusí, Masnou, Barcelona) y acetato de metilprednisolona inyectado (Urbason®, Aventis pharma, Alcorcón, Madrid), mostrando una leve mejoría a lo largo de un mes de tratamiento.
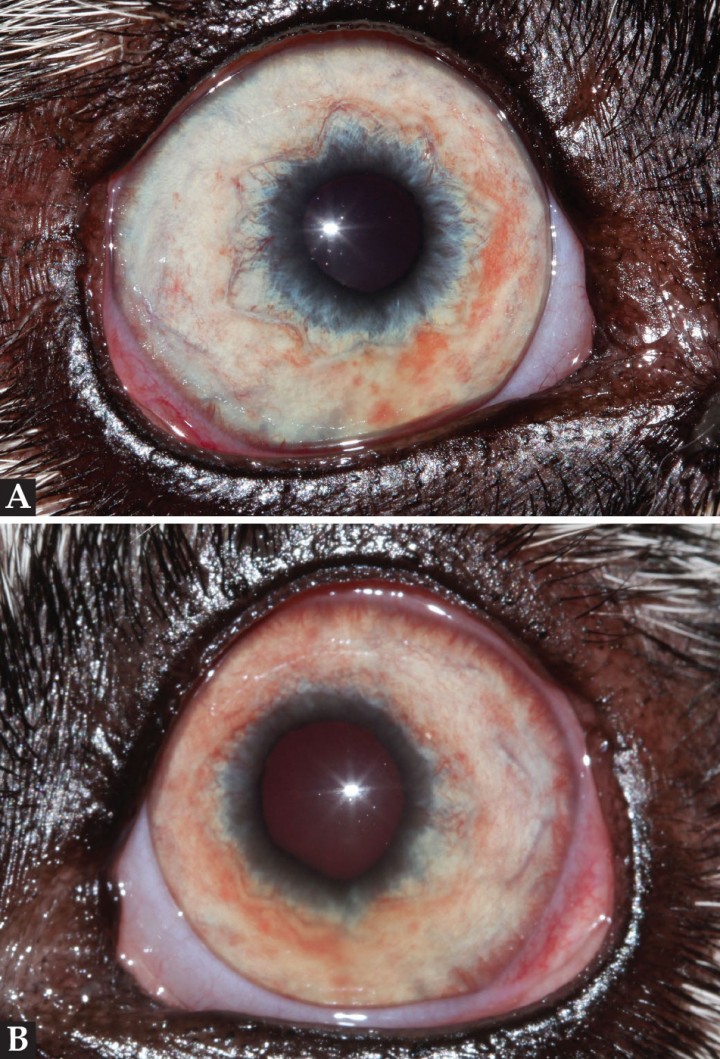
Se procedió a realizar una exploración oftalmológica completa, cuyos resultados fueron los siguientes: respuesta de amenaza positiva bilateral (OU), reflejo de deslumbramiento positivo OU, pupilas con tendencia a miosis con pobres respuestas fotomotoras OU. El test de Schirmer tipo I (Schirmer Tear Test. Schering-Plough Animal Health) era de 20 mm/min en OD y 23 mm/min en OS y en el examen bajo lámpara de hendidura (Kowa® SL 15, Tokio, Japón) se observó hiperemia de la conjuntiva bulbar, Tyndall positivo, rubeosis iridis y anillo vascular periquerático (Fig. 1).
Figura 1
Aspecto del (A) OD y (B) OS el primer día de consulta.
La tonometría de rebote (Tonovet Icare®, Helsinki, Finlandia) era de 11 mm Hg OD y 12 mm Hg OS, y el examen de fondo de ojo mediante oftalmoscopio indirecto monocular (PanOptic®, Welch Allyn Reino Unido) e indirecto binocular (Keeler Vantage Plus®, Reino Unido) mostraba una exploración fisiológica.
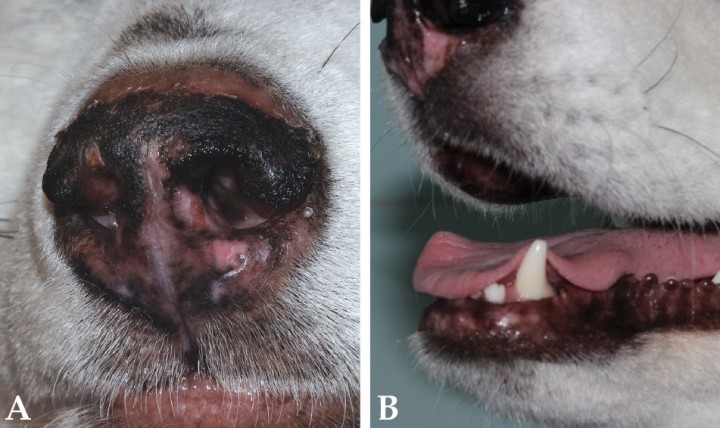
La exploración física, exceptuando las lesiones erosivas de la trufa (Fig. 2A) y belfos (Fig. 2B), y las lesiones oculares que eran consistentes con una uveítis anterior, estaba dentro de la normalidad.
Figura 2
(A). Detalle de la trufa y (B) del belfo, el primer día de la consulta.
Al tratarse de un proceso bilateral acompañado de clínica extraocular se estableció que podía tratarse de una manifestación ocular de una enfermedad sistémica, siendo por tanto necesario realizar pruebas diagnósticas adicionales.
En base a la raza y al cuadro clínico, ¿qué causa es la más probable?
En base a la raza, la edad y el cuadro clínico se estableció como causa más probable un síndrome uveodermatológico (SUD) o síndrome de Vogt Koyanagi-Harada (VKH). Este síndrome suele afectar a las nórdicas, aunque también puede aparecer en cualquier otra, incluido mestizos. Las más afectadas son: Samoyedo, Bobtail, Husky Siberiano, Malamute de Alaska, San Bernardo, Akita Inu, Setter Irlandés, Chow Chow, Pastor Escocés, Golden Retriever y Pastor Australiano.1 También se ha descrito de forma aislada en Caniche, Fila brasileño y Jack Russell Terrier.
¿Qué pruebas diagnósticas propondrías al propietario?
Al vivir el animal en una zona endémica de Leishmania se recomendó efectuar un análisis de detección para dicha enfermedad, además de realizar hemograma, bioquímica general y biopsia cutánea (prueba diagnóstica de elección para el SUD).
Los propietarios accedieron a realizar un test rápido para Leishmania (IDEXX SNAP® Leishmania Test), que resultó negativo, y la analítica sanguínea, donde solo se puso de manifiesto una ligera leucocitosis con neutrofilia, pero rechazaron la biopsia cutánea, por lo que con los signos clínicos y los hallazgos laboratoriales se estableció un diagnóstico presuntivo de SUD como causa más probable, aunque se deben considerar también otras enfermedades en nuestro diagnóstico diferencial como: linfoma cutáneo, lupus eritematoso discoide y pénfigo foliáceo.
¿Qué tratamiento se propondría y cuál es el pronóstico a largo plazo?
El tratamiento debe ser tópico y sistémico, dirigido a controlar la inflamación intraocular y a evitar la aparición de complicaciones derivadas de la uveítis (glaucoma, cataratas, luxación de cristalino, ptisis bulbi, desprendimiento de retina, etc.).
En este caso se inició tratamiento tópico con ciclopentolato (Colircusí Ciclopléjico®, Alcon Cusí, Masnou, Barcelona), 1 gota cada 12 horas, para dilatar la pupila y evitar formación de sinequias posteriores que dieran lugar a un iris bombé y glaucoma secundario. Además, se pautó tratamiento antiinflamatorio con acetato de prednisolona 1% (Pred Forte®, Allergan SA, Westport, Irlanda) 1 gota cada 8 horas y un colirio de bromfenaco (Yellox® 0,9 mg/ml, Bausch Lomb, Berlín) 1 gota cada 12 horas.
Se prescribió por vía oral prednisona a una dosis inicial de 0,5 mg/kg/12 h (Dacortin® 30 mg, Laboratorios Merck, Mollet del Vallès, Barcelona) que luego se fue disminuyendo cada dos semanas coincidiendo con las revisiones.
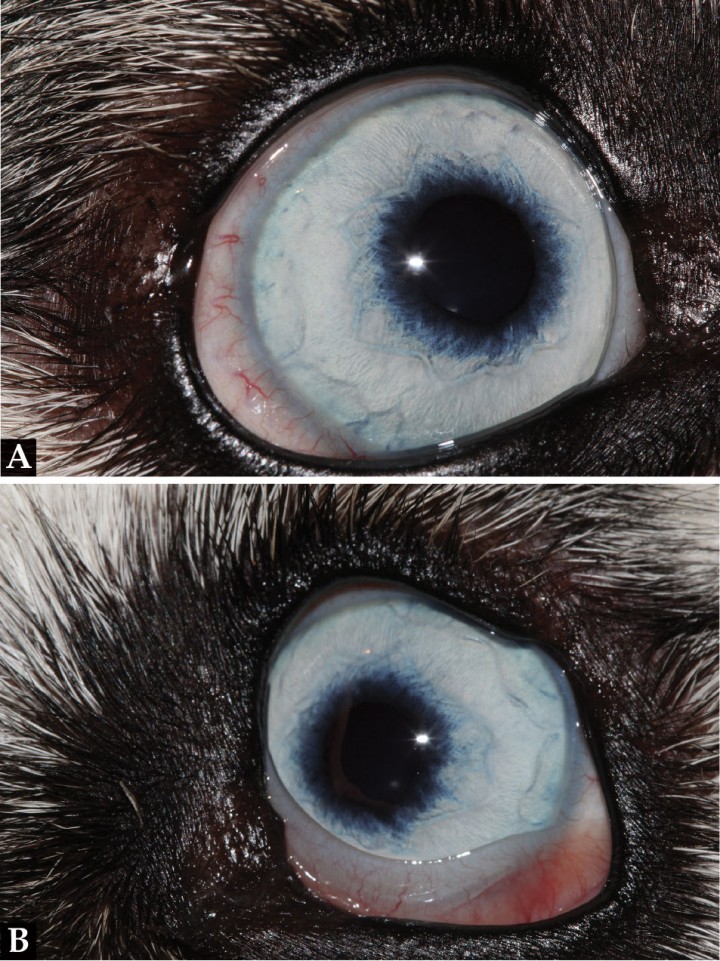
Desde la primera revisión se apreció una mejoría clínica evidente (Figs. 3 y 4), pero al mes comenzó a mostrar poliuria, polidipsia, jadeos y mucha fatiga, por lo que se intentó reducir el corticoide, aunque rápidamente el animal volvió a empeorar y fue necesario combinar la prednisona con un inmunomodulador sistémico. En este caso se eligió la azatioprina (Imurel® 50 mg, Excella GmbH, Feucht, Alemania) a una dosis de 2 mg/kg/día, manteniendo la prednisona a una dosis de 0,25 mg/kg/12 h hasta la siguiente revisión.
Figura 3
Aspecto al mes de tratamiento.
Figura 4
Aspecto del (A) OD y (B) OS al mes de tratamiento.
A las 2 semanas de iniciar la terapia con azatioprina (6 semanas desde el inicio del tratamiento) el animal estaba mejor, lo que permitió ir reduciendo cada dos semanas la prednisona hasta una dosis mínima de 7,5 mg cada 3 días (una dosis menor no controlaba los signos clínicos) y, posteriormente, la de azatioprina a una dosis de 1 mg/kg/día (dosis actual).
La terapia tópica se fue disminuyendo en función de la respuesta clínica hasta poder mantener al animal únicamente con el acetato de prednisolona una vez al día.
Se realizaron varias analíticas sanguíneas a lo largo del tratamiento con el objetivo de comprobar que el paciente no desarrollaba efectos secundarios al inmunomodulador (hepatotoxicidad, supresión de la médula ósea, pancreatitis o alteraciones gastrointestinales).
El pronóstico de estos pacientes a largo plazo es desfavorable, ya que suelen recidivar y evolucionar hacia un glaucoma o desprendimiento de retina.
Discusión
El SDU o síndrome de VKH ha sido descrito en humanos y en varias razas de perro (anteriormente mencionadas). La edad media de presentación son los 3 años de edad y los signos oculares (uveítis anterior, glaucoma, desprendimiento de retina y queratoconjuntivitis seca) suelen aparecer antes que los dermatológicos (poliosis y vitíligo que frecuentemente afectan al plano nasal, párpados, escroto, vulva, almohadillas y belfos).1
En humana este síndrome comienza con signos neurológicos derivados de una meningoencefalitis y, después, aparecen los signos oculares. En veterinaria los signos oculares se presentan de forma aguda y pueden preceder o no a los signos cutáneos, que son secundarios a una reacción inmunomediada de tipo humoral dirigida de forma específica frente a los melanocitos de la úvea (anterior y posterior) y de la piel.
Las lesiones de la piel son secundarias a células T y macrófagos (inmunidad Th1) y las oculares a células de tipo B y macrófagos (inmunidad Th2).2
Estudios recientes han descrito que la inmunización de linfocitos con péptidos derivados de la proteína tirosinasa 1 humana inducían en 2 perros de la raza Akita Inu signos oculares y extraoculares similares al síndrome VKH a las 3-4 semanas de la primera inmunización, por lo que esta enzima se relaciona con el desarrollo de la enfermedad en la raza Akita Inu y en humanos.3 También se ha establecido una posible causa genética en los Akita Inu, ya que se ha observado que perros de esta raza en América presentaban una falta de diversidad genética para ciertos alelos del gen DLA de clase II.4
El diagnóstico es principalmente clínico y se apoya en el estudio histopatológico de las lesiones cutáneas, donde se observa una dermatosis liquenoide con infiltración dérmica por histiocitos, linfocitos y células gigantes con disminución de la melanina en dermis y folículos pilosos.1
Al tratarse de una enfermedad autoinmune, el tratamiento debe basarse en el uso de antiinflamatorios esteroideos a dosis inmunosupresoras combinados o no con inmunomoduladores que nos ayuden a disminuir la dosis de los primeros y evitar, en la medida de lo posible, los efectos indeseables de estos. En nuestro caso, al contrario de lo descrito en la literatura, comenzamos con una dosis antiinflamatoria de prednisona, ya que el animal había mostrado una respuesta positiva a dosis bajas de corticosteroide inyectado, en un intento de evitar efectos adversos que posteriormente surgieron a dosis más bajas aún, aunque a nivel ocular y dermatológico evolucionara favorablemente.
Como inmunomodulador sistémico se seleccionó la azatioprina. Se trata de un fármaco que actúa preferentemente en la función de los linfocitos T, inhibiendo la inmunidad mediada por células y la síntesis de anticuerpos por los linfocitos T dependientes.1 Se recomienda realizar analíticas de control mientras se emplea este medicamento dado el potencial de supresión de la médula ósea que presenta.
Si hubiera una respuesta positiva a la terapia combinada con prednisona, esta última debe ir reduciéndose al tiempo que se mantiene la de azatioprina, si esta no está causando efectos adversos. En algunas ocasiones es posible retirar la prednisona, pero manteniendo una dosis mínima de azatioprina de 2 mg/kg en días alternos.4 También se ha descrito el uso de otros inmunomoduladores sistémicos como la ciclosporina A, el clorambucilo y el micofenolato de mofetilo.
El micofenolato de mofetilo es una opción muy interesante, ya que presenta menor toxicidad que la ciclosporina y la azatioprina. Actúa inhibiendo de forma selectiva la iosina monofosfato deshidrogenasa, enzima necesaria para la proliferación de linfocitos T y B. En medicina humana se ha usado para prevenir el rechazo de trasplantes en pacientes con psoriasis y como tratamiento en varias enfermedades inmunomediadas, ya que la respuesta clínica es más rápida que con la azatioprina y el metrotrexato.5
Cuando este fármaco se empleó en pacientes con problemas oftalmológicos, se logró controlar la inflamación intraocular en el 53% en los 6 primeros meses de tratamiento y en el 73% al año.5 En medicina veterinaria este fármaco se ha utilizado en el tratamiento refractario a corticoides de enfermedades inmunomediadas como miastenia gravis, anemia hemolítica inmunomediada, pénfigo vulgar y en queratoplastias lamelares y penetrantes para prevenir el rechazo del injerto.
El tratamiento para esta enfermedad es paliativo; se asume que habrá empeoramiento del paciente con el paso del tiempo y es muy frecuente la pérdida de la visión en el futuro, por lo que se debe exponer esta situación a los propietarios, ya que generalmente suele darse en animales jóvenes.
En medicina humana es relativamente frecuente que pacientes con síndrome de VKH sufran también otras enfermedades inmunomediadas de forma concomitante (tiroiditis de Hasimoto, artritis reumatoide, síndrome poliglandular tipo 1, colitis ulcerativa, queratoconjuntivitis seca y síndrome de Sjögren).6 En veterinaria se han observado pacientes con queratoconjuntivitis seca de origen inmunomediado7 y polimiositis junto con SUD,6 por lo que debemos tener en cuenta que el cuadro clínico puede incluir más signos clínicos que los clásicos descritos en la literatura y que estas enfermedades pueden aparecer de forma concomitante, complicando su diagnóstico y manejo terapéutico.
Dada la necesidad de tratar a estos pacientes durante largos periodos de tiempo con antiinflamatorios esteroideos con el consecuente riesgo de desarrollar reacciones adversas y complicaciones sistémicas, como el síndrome de hiperadrenocorticismo, es necesario combinar estos fármacos con inmunomoduladores sistémicos que nos permitan reducir o incluso suprimir los primeros, siendo el micofenolato de mofetilo una alternativa interesante a la ciclosporina y la azatioprina.
El caso aquí presentado muestra el cuadro clínico típico que se describe en la literatura sobre esta enfermedad y su evolución a lo largo de un año de tratamiento. Podemos concluir que se trata de una enfermedad infrecuente, de difícil manejo, con un diagnóstico principalmente clínico y relativamente sencillo cuando se presenta en las razas nórdicas, que requiere de un seguimiento exhaustivo dada la alta tasa de recidivas y su mal pronóstico en relación con la visión.
Fuente de financiación: este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Maggs DJ, Miller PE, Ofri R. Manifestaciones oculares de enfermedades sistémicas. En Slatter: Fundamentos de oftalmología veterinaria (4ª edición), Barcelona, Elsevier, 2009; 405-406.
- 2.
Carter WJ, Crispin SM, Gould DJ, Day MJ. An inmunohistochemical study of uveodermatologic syndrome in two Japanese Akita dogs. Vet Ophthalmol 2005; 8:17-24.
[PubMed] - 3.
Yamaki K, Takiyama N, Itho N et al. Experimentally induced Vogt Koyanagi Harada disease in two Akita dogs. Exp Eye Res. 2005; 2:273-280.
[PubMed] - 4.
Angles JM, Famula TR, Pedersen NC.Uveodermatologic (VKH-like) syndrome in American Akita dogs is associated with an increased frequency of DQA1*00201. Tissue Agents.2005; 66:656-665.
[PubMed] - 5.
Daniel E, Thorne JE, Newcomb CW et al. Mycophenolate mofetil for ocular inflamation. Am J Ophthalmol 2010; 149:423-432.
[PubMed] - 6.
Baiker K, Scurrell E, Wagner T et al. Polymyositis following Vogt Koyanagi Harada like syndrome in a Jack Rusell Terrier. J Comp Pathol 2011; 144:317-323.
[PubMed] - 7.
Kang MH, Lim CH, Park HM. Uveodermatologic syndrome concurrent with keratoconjuntivitis sicca in a miniature poddle dog. Can Vet J 2014; 55(6):585-588.
[PubMed]