Primera descripción in vivo de miasis traqueobronquial en la especie canina secundaria a Oestrus sp.
First in vivo description of tracheobronchial miasis in the canine species secondary to Oestrus sp.
D.L. Casas-García, M. Quintana-Román, P. Pérez-Lorenzo, I. Montenegro-Martínez
Contacto: info@cvmic.es
Resumen
La participación de la especie canina como hospedador accidental de Oestrus sp. ha sido descrita tanto in vivo como tras la necropsia de pacientes que sufrían de un cuadro de rinitis de etiología desconocida. Oestrus sp., como agente causal de miasis nasales en pequeños rumiantes domésticos y salvajes, también es responsable de cuadros zoonóticos, especialmente en individuos inmunodeprimidos, caracterizándose por la existencia de estornudo crónico asociado o no a estornudo inverso, descarga nasal de naturaleza serosa y prurito nasal refractario al manejo médico. En el presente caso, la localización ectópica de la miasis derivó en el desarrollo de una sintomatología caracterizada por un cuadro sobreagudo de toses y disnea. Esto conllevó su remisión urgente para la exploración endoscópica de la vía respiratoria baja, ante la sospecha de una posible inhalación de cuerpo extraño no radiodenso en este paciente canino. Dicha etiología fue descartada durante la traqueobroncoscopia, confirmándose la existencia de una laringotraqueobronquitis parasitaria secundaria a Oestrus sp.
Palabras clave: endoscopia, traqueítis, miasis, Oestrus, perro.
Clin Vet Peq Anim 2020, 40 (2): 89-92
Summary
The contribution of the canine species as an accidental host of Oestrus sp. has been described in vivo but also after the necropsy of patients that suffered from rhinitis of unknown origin. Oestrus sp. as a causal agent of nasal myasis in small domestic and wild ruminants, is also responsible for zoonotic signs, especially in immunocompromised patients, and is characterized by chronic sneezing, associated or not with reverse sneezing, serous nasal discharge and nasal pruritus, which are usually refractory to medical treatment. In the case presented here, the ectopic location of the myasis led to the development of coughing and respiratory distress, so the patient was referred urgently for an exploratory endoscopy of the lower respiratory airway. Inhalation of a radiolucent foreign was suspected in this patient, but this was ruled out during tracheal bronchoscopy. Parasitic laryngotracheobronchitis secondary to Oestrus sp. was confirmed.
Keywords: endoscopy, tracheitis, miasis, Oestrus, dog.
Clin Vet Peq Anim 2020, 40 (2): 89-92

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
Oestrus sp. es un díptero oéstrido responsable de miasis nasales, especialmente en pequeños rumiantes, describiéndose una mayor prevalencia en ovinos respecto a caprinos,1-3 especialmente en aquellas áreas con condiciones climáticas favorables que permitan el desarrollo de los adultos durante todo el año.4
Las larvas L1 son liberadas por parte de una hembra grávida a nivel de las narinas del hospedador y estas migran al interior de la cavidad nasal. Posteriormente, las larvas continúan su migración hacia los senos frontal, maxilar y palatino, donde llevan a cabo su desarrollo a L2 y a L3. Finalmente, abandonan el hospedador a través de las narinas, generalmente estornudadas, y proceden a completar su desarrollo a pupa en los siguientes días y, así, completar su forma adulta.4,5 Cabe destacar que existen descripciones en las que se hace referencia a que este último paso puede llevarse a cabo incluso en el interior del hospedador y no en el medio.6 Cuando la hembra grávida no encuentra a su hospedador específico, ésta puede depositar sus huevos en las narinas de otras especies, que actúan entonces como hospedadores accidentales. Se han descrito casos tanto en la especie canina como en la especie felina e, incluso, en humanos, aunque sin describirse casos a nivel traqueobronquial.6-13
Es por ello que el objetivo del presente trabajo es demostrar tanto la necesidad de incluir la etiología parasitaria en el diagnóstico diferencial de las traqueobronquitis inespecíficas en pequeños animales, como el potencial de la endoscopia como método de diagnóstico.
Caso clínico
Se remite de urgencia una hembra entera de raza Bulldog Francés y de 1 año de edad proveniente de la zona sureste de la isla de Gran Canaria (Islas Canarias) y de hábitat doméstico para su valoración endoscópica de las vías respiratorias bajas por cuadro de tos improductiva de curso sobreagudo (aproximadamente 36 horas de evolución) y disnea, con sospecha de inhalación de cuerpo extraño radiolúcido a nivel traqueal, ante la ausencia de respuesta al manejo médico para su estabilización clínica en el centro veterinario remitente.
La exploración física demostró la existencia de reflejo tusígeno positivo asociado a disnea, taquipnea (37 rpm) y normotermia, pero con ausencia de un patrón respiratorio obstructivo. Además, se descartó la existencia de alteraciones a la auscultación cardiopulmonar, especialmente sibilancias y/o estridor, así como cianosis y linfadenopatías.
El estudio radiográfico del tórax en el centro veterinario remitente descartó la existencia de alteraciones a nivel de la vía respiratoria, incluyendo compresiones o desplazamientos extramurales, así como del parénquima pulmonar.
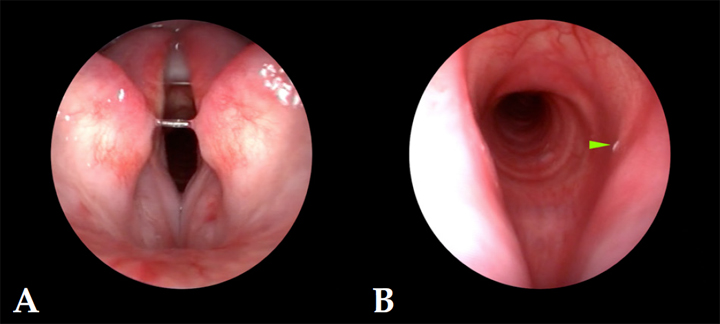
Tras la premedicación de la paciente mediante la combinación de clorhidrato de medetomidina (Domtor, Ecuphar Veterinaria, SLU, Barcelona), a 7 μg/kg por vía intramuscular y de tartrato de butorfanol (Torphasol, Ecuphar Veterinaria, SLU, Barcelona), a 0,4 mg/kg también vía intramuscular, y previamente a su inducción con propofol (Propofol Lipuro 1% , B. Braun Vetcare, SA, Barcelona) a 2,5 mg/kg vía intravenosa, se procedió a la exploración endoscópica de la laringe y primer tercio de la tráquea mediante el empleo de una óptica rígida de 0º, 5 mm de diámetro y 8,5 cm de longitud, con el fin de valorar su estructura y función dinámica. Se descartó tanto la existencia de alteraciones en la dinámica laríngea (parálisis o paresia laríngea), así como en su estructura (colapso laríngeo), pero se demostró la presencia de moderado eritema de la mucosa laríngea asociado a la existencia de una forma larvaria compatible con L1 de Oestrus sp. a nivel del vestíbulo laríngeo (Fig. 1).
Figura 1
Imágenes endoscópicas de la laringe. (A) Presencia de congestión focal laringitis. (B) Presencia de L1 de Oestrus sp. en vestíbulo laríngeo (punta de flecha verde).
Una vez se garantizó un plano anestésico estable de la paciente mediante anestesia general inhalatoria tras su inducción anestésica, se procedió a la exploración endoscópica reglada de la vía aérea baja,14 mediante el empleo de una óptica rígida de 0º, 5 mm de diámetro y 35 cm de longitud. La membrana dorsal de la tráquea se situó en la zona superior de la imagen y se realizó un recorrido constante a lo largo de toda la longitud de la tráquea hasta la carina, valorando la morfología y el aspecto de la mucosa del lumen traqueal, mientras se determinaba la existencia o no de alteraciones dinámicas asociadas a los ciclos respiratorios. Tras la carina, la broncoscopia se llevó a cabo respetando el mismo procedimiento descrito para la tráquea e identificando cada uno de los bronquios principales.
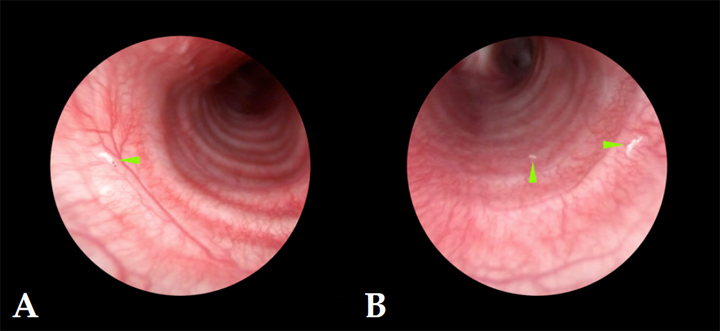
El estudio traqueobroncoscópico, aunque reveló la ausencia de alteraciones obstructivas (colapso bronquial, hipoplasia traqueal, estenosis traqueal o cuerpo extraño traqueal) que formaban parte del diagnóstico diferencial del motivo de la exploración endoscópica de la paciente, demostró la existencia de otras 8 formas larvarias compatibles con Oestrus sp. a nivel de la tráquea cervical (Fig. 2A), tráquea torácica (Fig. 2B) y bronquios principales (Fig. 3), asociada a la presencia de signos leves de eritema a nivel de la mucosa de la tráquea y de la carina. Además, se descartó la existencia de contenido mucoso, así como edema asociado a la presencia de Oestrus sp.
Figura 2
Presencia de L1 de Oestrus sp. (puntas de flecha verdes). (A) Tráquea cervical. (B) Tráquea torácica.
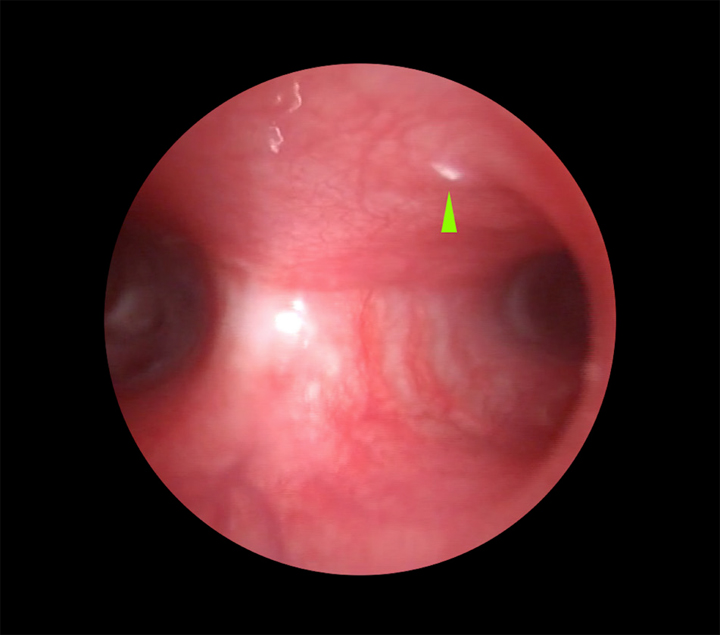
Figura 3
Imagen endoscópica de la carina, comprobándose la existencia de L1 de Oestrus sp. en el bronquio principal izquierdo (punta de flecha verde).
Se procedió a la realización de un lavado traqueal con el fin de obtener alguna de las formas larvarias y su identificación, consiguiendo recuperar 2 de ellas. Microscópicamente se confirmó la presencia de L1 de Oestrus sp., la cual se caracteriza por su color blanco, su pequeño tamaño (de entre 1 y 3 mm), así como por la presencia de grandes ganchos bucales quitinosos que conectan a un esqueleto cefalofaríngeo interno, en forma de garfios y alrededor de 20 espinas terminales, distribuidas en dos grupos.15
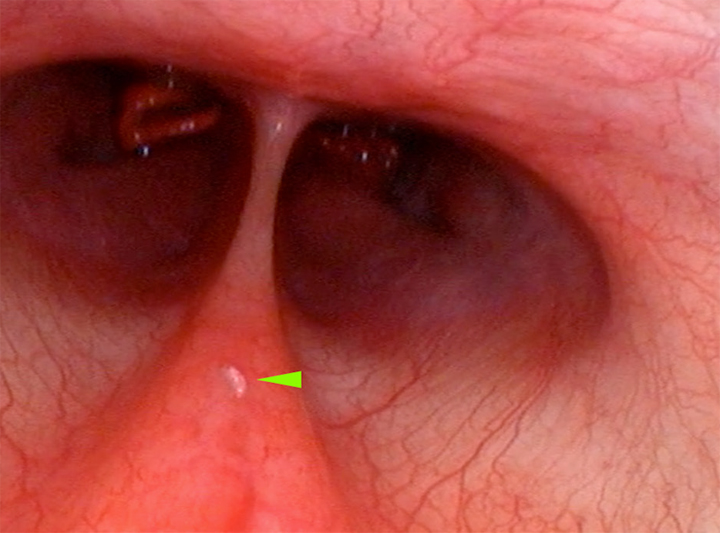
Como ya se ha especificado anteriormente, Oestrus sp. es un parásito que afecta principalmente a la vía aérea alta, por lo que se completó la exploración endoscópica de la paciente con la realización de una exploración endoscópica reglada de vías aéreas altas, en la que se confirmó la existencia de una única forma larvaria a nivel de la nasofaringe (Fig. 4). El estudio rinoscópico rostral descartó la existencia de formas parasitarias a nivel de ambas cavidades nasales.
Figura 4
Confirmación endoscópica de la existencia a nivel nasofaríngeo de L1 de Oestrus sp. en el mismo paciente (punta de flecha verde).
Una vez determinada la etiología, se prescribió un tratamiento antitusígeno a base de tartrato de butorfanol (Torphasol, Ecuphar Veterinaria, SLU, Barcelona), a 0,1 mg/kg cada 12 horas por vía subcutánea durante 7 días, junto con la combinación antiparasitaria de ivermectina (Ivertotal, SP Veterinaria, SA, Tarragona) en 2 dosis de 200 μg/kg por vía subcutánea con 15 días de separación entre una y otra.
Los posteriores controles en el veterinario remitente demostraron la completa resolución de los signos clínicos, sin recidiva de la sintomatología que fue motivo de consulta hasta el día de hoy, 1 año después.
Discusión
En base a la bibliografía consultada, este es el primer caso descrito a nivel mundial del diagnóstico in vivo de miasis secundaria a Oestrus sp. en vías respiratorias bajas en la especie canina, aunque ya existan descripciones post mortem de localizaciones ectópicas de Oestrus sp. en pequeños rumiantes (esófago, tráquea y bronquios) en casos de infestaciones elevadas.11,16
Con mayor probabilidad, la localización ectópica sea debida a una broncoaspiración de origen nasofaríngeo, lo cual justificaría la presencia de formas larvarias en el vestíbulo laríngeo, tráquea y carina. La ausencia de formas larvarias a nivel intranasal en el presente caso, localización frecuente de Oestrus sp.,4-7,11,12,16 no permite descartar la presencia de otras formas parasitarias a nivel de los senos nasales, donde finalmente tiene lugar el desarrollo de L2 a L3.17,18 En el caso que se describe, ninguno de los senos nasales fue explorado, al requerir ello de la trepanación de los mismos para su completa exploración endoscópica. A criterio de los autores, la aspiración de dichas formas larvarias vía oral parece menos probable, ya que su presencia a nivel nasofaríngeo puede justificar el contagio vía nasal. Además, su diagnóstico in vivo permitió su manejo médico y posterior resolución clínica tras la segunda dosis de ivermectina.
Es de sobra conocido el potencial zoonótico de Oestrus sp. con especial incidencia en los países del norte de África, Oriente Medio e incluso en las Islas Canarias,12 describiéndose como causa primaria de miasis nasal y de oftalmomiasis,11,12 y estando documentado el desarrollo hasta L3 tanto en la especie humana12,19 como en la canina.8
La etiopatogenia de los cuadros de inflamación catarral de las mucosas respiratorias se debe principalmente al daño mecánico ejercido por los ganchos bucales y las espinas terminales que poseen las larvas de Oestrus sp. a lo largo de su cuerpo. Éstos les permiten fijarse fuertemente a la mucosa respiratoria y soportar incluso la presión ejercida en la vía aérea, como, por ejemplo, cuando tienen lugar los cuadros tusígenos de la paciente del presente caso clínico.11 Cabe destacar que este edema y secreción catarral puede evolucionar a hemorrágica, especialmente cuando se produce el desarrollo hasta L3, e incluso mucopurulenta en aquellos casos en los que se produzca contaminación bacteriana o fúngica. También se ha demostrado el papel que juega en la patogenia de Oestrus sp. la actividad proteolítica de los productos excretados por sus larvas, junto con un fenómeno de hipersensibilidad del propio hospedador,2,11 por lo que dicha acción mecánica de las larvas durante su migración, producida tanto por los ganchos bucales como por las espinas terminales, no debe ser considerada como la única responsable de la sintomatología secundaria a Oestrus sp.
Se han descrito pocos casos de rinitis parasitaria secundaria a Oestrus sp. en la especie canina, incluso in vivo,7,13 habiendo sido demostrado el desarrollo del Oestrus. sp. a L3 en la especie canina. Esto contradice la creencia de que el desarrollo de las distintas formas larvarias de Oestrus sp. fracasa en los hospedadores accidentales.6,8 Es por ello que las miasis secundarias a Oestrus sp. deben ser incluidas dentro del diagnóstico diferencial, especialmente cuando se informa de la proximidad a granjas de pequeños rumiantes en la anamnesis y los pacientes son refractarios al manejo con antibióticos y/o antiinflamatorios.7,13 Esta consideración debe tenerse en cuenta, incluso ante la posible localización ectópica de Oestrus sp. como se ha descrito en el presente caso clínico.
Fuente de financiación: este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: ninguno de los autores de este artículo tiene una relación financiera o personal con otras personas u organizaciones que pudieran inapropiadamente influir o sesgar el contenido de este artículo.
Bibliografía
- 1.
Alcaide M, Reina D, Frontera E, Navarrete I. Epidemiology of Oestrus ovis (Linneo, 1761) infestation in goats in Spain. Vet Parasitol 2005; 130:277-284.
[PubMed] - 2.
Dorchies P, Bergeaud JP, Tabouret G, Duranton C, Prevot F et al. Prevalence and larval burden of Oestrus ovis (Linné 1761) in sheep and goats in northern Mediterranean region of France. Vet Parasitol 2000; 88:269-273.
[PubMed] - 3.
Papadopoulos E, Prevot F, Diakou A, Dorchies P. Comparison of infection rates of Oestrus ovis between sheep and goats kept in mixed flocks. Vet Parasitol 2006; 138:382-385.
[PubMed] - 4.
Sotirakia S, Hall MJR: A review of comparative aspects of myiasis in goats and sheep in Europe. Small Rumin Res 2012; 103(1):75-83.
- 5.
Hall M, Wall R. Myiasis of human and domestic animals. Adv Parasitol 1995; 35: 257-334.
[PubMed] - 6.
McGarry J, Penrose F, Collins C: Oestrus ovis infestation of a dog in the UK. J Small Anim Pract 2012; 53:192-193.
[PubMed] - 7.
Casas García DL, González León FJ, Díaz Cepedano B, Montenegro Martínez I. Miasis nasal (O. ovis) canina: a propósito de un caso clínico. Clin Vet Peq Anim 2017; 37(4): 253-255.
- 8.
Luján L, Vázquez J, Lucientes J, Panero JA, Varea R. Nasal myiasis due to Oestrus ovis infestation in a dog. Vet Rec 1998; 142: 282-283.
[PubMed] - 9.
Lucientes J, Ferrer-Dufol, Andres MJ, Peribanez MA, Gracia-Salinas MJ et al.. Canine Myiasis by Sheep Bot Fly (Diptera: Oestridae). J Med Entomol 1997; 34(2):242-243.
[PubMed] - 10.
Webb SM, Grillo VL: Nasal myiasis in a cat caused by larvae of the nasal boty Oestrus ovis. Aust Vet J 2010; 88(11): 455-457.
- 11.
Angulo-Valadez CE, Scholl PJ, Cepeda-Palacios R, Jacquiet P, Dorchies P: Nasal bots. A fascinating world! Vet Parasitol 2010; 174:19-25.
[PubMed] - 12.
Fernández LS, Hernández-Porto M, Tinguaro V, Fernández ML. Oftalmomiasis y miasis nasal por Oestrus ovis en paciente residente en las Islas Canarias con características epidemiológicas poco frecuentes. Enferm Infecc Microbiol Clin 2017; 35(7): 461-462.
- 13.
Zanzani SA, Cozzi L, Olivieri E, Gazzonis AL, Manfredi MT. Oestrus ovis L. (Diptera: Oestridae) Induced Nasal Myiasis in a Dog from Northern Italy. Case Rep Vet Med 2016. 1-4.
[PubMed] - 14.
Casas García DL, Brandão F. Traqueobroncoscopia. En: Casas García DL, Santana González AJ (eds): Técnicas de Mínima Invasión en Pequeños Animales. Multimédica Ediciones Veterinarias, 2018; 211-220.
- 15.
Silva BF, Bassetto CC, Amarante, AE. Immune responses in sheep naturally infected with Oestrus ovis (Diptera: Oestridae) and gastrointestinal nematodes. Vet Parasitol 2012; 190(1):120-126.
[PubMed] - 16.
Gunalan S, Kamaliah G, WAN S, Rozita AR, Rugayah M et al. Sheep Oestrosis (Oestrus Ovis, Diptera: Oestridae) In Damara Crossbred Sheep. Malasyan Journal of Veterinary Research 2011; 2(2): 41-49.
[PubMed] - 17.
Allaie IM, Wani ZA, Malik AH, Shahardar RA, Zulhuma M. Oestrus ovis larvae in nasal cavity of sheep: a case report. J Parasit Dis. 2016;40(4):1221-1222.
[PubMed] - 18.
Jacquiet P, Dorchies P. Towards a lower prevalence of Oestrus ovis infections in sheep in a temperate climate (south west France).Vet Res. 2002; 33(5): 449-453.
[PubMed] - 19.
Beristain X, Alkorta M, Egana L, Lacasta A, Cilla G: Nasopharyngeal myasis by third stage larvae of Oestrus ovis. Enferm Infecc Microbiol Clin 2011; 19:86-87.
[PubMed]