Biomarcadores de daño y remodelación cardíaca, inflamación y estrés oxidativo en perros con cardiopatías. Parte I
Injury and Cardiac Remodeling, Inflammation and Oxidative Stress Biomarkers in Dogs with Cardiac Diseases. Part I
I. Miralles-Plaza, M. J. Fernández-del-Palacio
Contacto: mirallesivan.vet@hotmail.com
Resumen
El objetivo de esta revisión es resumir la evidencia actual sobre el uso de biomarcadores cardíacos circulantes en pacientes con enfermedades cardíacas, identificando cuáles de los más utilizados en medicina humana se han investigado en perros. Asimismo, se analizarán los biomarcadores existentes, clasificados en los siguientes grupos: daño de cardiomiocitos, estrés de cardiomiocitos, remodelado de la matriz extracelular, inflamación y estrés oxidativo, activación neurohormonal y disfunción endotelial. Nos centramos en las ventajas y desventajas del uso de biomarcadores en el diagnóstico, el pronóstico y la monitorización de la terapia de los pacientes con cardiopatías. Además, incluimos las direcciones futuras para mejorar la capacidad predictiva y la reproducibilidad de múltiples modelos de biomarcadores con el fin de avanzar en las nuevas evaluaciones relacionadas con la genómica, transcriptómica, proteómica y metabolómica de las enfermedades cardíacas.
Palabras clave: biomarcadores cardíacos, fibrosis miocárdica, insuficiencia cardíaca, daño miocárdico, perros.
Clin Vet Peq Anim 2025, 45 (1): 9-18
Summary
The objective of this review is to summarize the current evidence on the use of circulating cardiac biomarkers in patients with heart diseases, identifying which of the most commonly used in human medicine have been investigated in dogs. Furthermore, the existing biomarkers will be analyzed, classified into the following groups: cardiomyocyte damage, cardiomyocyte stress, extracellular matrix remodeling, inflammation and oxidative stress, neurohormonal activation, and endothelial dysfunction. We focus on the advantages and disadvantages of using biomarkers in the diagnosis, prognosis, and therapy monitoring of patients with heart diseases. Additionally, we include future directions aimed at improving the predictive capacity and reproducibility of multiple biomarker models in order to advance new assessments related to the genomics, transcriptomics, proteomics, and metabolomics of heart diseases.
Keywords: cardiac biomarkers, myocardial fibrosis, heart failure, myocardial damage, dogs.
Clin Vet Peq Anim 2025, 45 (1): 9-18

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Abreviaturas incluidas en el artículo
ANP, péptido atrial natriurético; BNP, péptido cerebral natriurético; CAP, conducto arterioso persistente; C-NPR, receptor del péptido natriurético carboxilo-terminal; CMD, cardiomiopatía dilatada; CMH, cardiomiopatía hipertrófica; CT-proANP, carboxilo-terminal propéptido atrial natriurético; CT-proBNP, carboxilo-terminal propéptido atrial natriurético; cTn, troponinas; cTnI, troponina sérica inhibitoria; cTnC, troponina dependiente del calcio; cTnT, tropomiosina; DSA, defecto de septo interatrial; DSV, defecto de septo interventricular; EMDC, enfermedad mitral degenerativa crónica; ESA, estenosis subaórtica; ET-1, endotelina-1; EP, estenosis pulmonar; Gal-3, galectina-3; Hp, haptoglobina; ICC, insuficiencia cardíaca congestiva; IL, interleuquina; MMP, metaloproteinasas de la matriz extracelular; NT-proANP, amino-terminal propéptido atrial natriurético; NT-proBNP, amino-terminal propéptido cerebral natriurético; RAAS, sistema renina-angiotensina-aldosterona; SAA, amiloide A sérica; sST2, porción soluble del factor supresor de tumorognesis de tipo 2; TNF, factor de necrosis tumoral; PICP, propéptido carboxi-terminal del procolágeno de tipo I; PIIIP, propéptido amino-terminal del procolágeno de tipo III.
Introducción
El término “marcador biológico” apareció por primera vez a finales de la década de los sesenta, aunque con relativa ambigüedad.1 Fue en 2001, cuando los Grupos de Trabajo de los Institutos Nacionales de Salud de los Estados Unidos (National Institutes of Health Biomarkers Definitions Working Group, NIH) definieron oficialmente el término “biomarcador” como “una característica que puede ser objetivamente medida y evaluada como un indicador de un proceso biológico normal, de un proceso patológico o de una respuesta farmacológica a una intervención terapéutica”.2
Desde esta primera definición,2 elaborada por líderes relacionados con el mundo académico y con la industria (U.S Food and Drug Administration, FDA),3 la Organización Mundial de la Salud (OMS) junto con las Naciones Unidas y la Organización Internacional del Trabajo desarrollaron un Programa Internacional de Seguridad Química4 en el que se refinó el concepto de biomarcador por “cualquier sustancia, estructura o proceso que pueda medirse en el cuerpo o en sus productos y que influya o prediga la incidencia de un resultado o enfermedad”.4 En esta definición más amplia, no solo se tuvo en cuenta la incidencia y el resultado de una enfermedad, sino que además se consideró el efecto de tratamientos, intervenciones e incluso la exposición ambiental involuntaria a agentes químicos y nutrientes.
Por esta razón, tras la validación del término con relación a la evaluación del riesgo medioambiental,4 la OMS estableció que la verdadera definición de biomarcador debe incluir “casi cualquier medida que refleje una interacción entre un sistema biológico y un riesgo potencial, el cual puede ser químico, físico o biológico”.3
En el ámbito clínico, un buen biomarcador será aquel específico de un órgano o de un proceso patológico que pueda cuantificarse, reproducirse y cuyos cambios en magnitud sean proporcionales a la gravedad de la enfermedad.5 Por ello, incluso los hallazgos del examen físico, como la frecuencia cardíaca, han sido tradicionalmente considerados biomarcadores.1 En el laboratorio, en cambio, aquellos medibles a partir de muestras biológicas están todavía en desarrollo, sobre todo por la dificultad en determinar una relación entre sus niveles cuantificables con los criterios de valoración o punto final (del inglés endpoints),6 es decir, con las variables clínicas que reflejan cómo los individuos de un estudio se sienten, funcionan, o sobreviven.
En veterinaria, de todas las anteriores, la definición que más aplicabilidad tiene7 es la establecida por la Biomarkers Definition Working Group2 que los clasifica en dos grandes categorías:2,3 1) según sus características en: molecular (ácidos nucleicos, proteínas, metabolitos), histológico, de imagen, o fisiológico; y 2) según su utilidad en: biomarcadores de riesgo/susceptibilidad, diagnósticos, pronósticos o predictivos, de monitorización, de farmacodinámica o de seguridad.2,3
Cuando se emplean para evaluar resultados en estudios clínicos, los biomarcadores pueden ser considerados sustitutos del punto final siempre y cuando hayan sido bien caracterizados a partir de una base de evidencia científica sólida que permita conocer el resultado clínico, ya sea beneficioso o perjudicial.6,7
Para identificar biomarcadores como sustitutos de los criterios de valoración o del punto final, se requiere determinar su relevancia y ser validados.6 Relevancia se refiere a la capacidad del biomarcador para proveer de información clínica relevante, mientras que la validación se refiere a la necesidad de caracterizar la efectividad o la utilidad del biomarcador como un sustituto de un criterio de valoración (p. ej., la supervivencia).6 Estos conceptos son claves para comprender el proceso de descubrimiento de un determinado biomarcador y la importancia de mantener el objetivo de la investigación sobre la población en estudio.8
El primer paso, previo a la selección de un determinado parámetro como biomarcador, consiste en identificarlo con tal potencial.8,9 Posteriormente, los investigadores deben documentarse sobre las publicaciones realizadas hasta la actualidad,7 y determinar qué tecnología de cribado debe emplearse para detectarlo y cuantificarlo de manera objetiva y reproducible.9 A continuación, se evaluará el proceso para su validación en términos de sensibilidad, especificidad y precisión,7 antes de pasar a su validación clínica.8 Esta última es crucial para la determinación de intervalos de referencia y puntos de corte en una población concreta,8 teniendo en cuenta aspectos demográficos como la raza,7 la edad o el sexo.8,9 Finalmente, el proceso culmina con la confirmación de su utilidad clínica,8 incluyendo aspectos como la estratificación del riesgo o su valor predictivo.3,7-9
A pesar de la dedicación y las dificultades técnicas que entrañan estas investigaciones, el descubrimiento de biomarcadores en veterinaria está acelerándose en los últimos años debido a una mayor especialización profesional y una mayor calidad asistencial. En una edición especial del Veterinary Journal,10 publicado tras una conferencia internacional titulada “Biomarcadores en Medicina Veterinaria”,11 el mayor progreso en los últimos diez años se ha producido en las áreas de la genómica de resistencia o susceptibilidad a enfermedades, y en el diagnóstico, pronóstico y tratamiento de enfermedades renales, cardiovasculares, cáncer y células madre.9 Sin embargo, la inversión económica que supone poder realizar estudios a gran escala y la necesidad de una estrecha colaboración entre clínicos e investigadores limitan este proceso de desarrollo en materia de biomarcadores que permitan predecir aspectos tan importantes como la supervivencia o evaluar la respuesta a ciertos tratamientos.9
En enfermedades cardiovasculares, tradicionalmente se ha empleado la ecocardiografía como biomarcador de imagen para respaldar los juicios clínicos y llevar a cabo la monitorización de los pacientes, tanto humanos8 como veterinarios.5 Sin embargo, las limitaciones de la ecocardiografía no solo están sujetas a una larga curva de aprendizaje y dificultad técnica, sino también a la dependencia del operador y las particularidades de cada individuo.11 Además, la relativa inaccesibilidad a los servicios especializados de cardiología, restringidos normalmente a unos pocos centros y hospitales de referencia, ha motivado la búsqueda de biomarcadores cardíacos circulantes en los últimos años, con el fin de mejorar la actividad asistencial también en clínica generalista y aminorar la morbimortalidad de las cardiopatías.12,13
Este artículo de revisión tiene como objetivo principal resumir el estado actual de conocimiento sobre los biomarcadores más utilizados en el ámbito de la cardiología veterinaria, estableciendo similitudes y diferencias entre las especies canina y humana que puedan influir en la práctica clínica. Secundariamente, se pretende exponer una clasificación de biomarcadores cardíacos y las dificultades para su validación, además de una breve revisión fisiopatológica en relación con el proceso de remodelado cardíaco y la respuesta inflamatoria asociada al desarrollo de las cardiopatías.
Búsqueda de datos
Para llevar a cabo esta revisión e identificar la información relevante, se realizó una búsqueda exhaustiva de la literatura en las siguientes bases de datos: PubMed, Google Scholar y Web of Science. Se utilizaron palabras clave como “biomarkers”, "cardiac biomarkers", "heart failure biomarkers", "myocardial fibrosis", “inflammation and oxidative stress biomarkers”, a menudo en combinación con los términos “humans”, “dogs” o “animals”. Para la búsqueda de información de biomarcadores específicos, se introdujo el nombre del biomarcador en cuestión en idioma inglés. La última búsqueda se actualizó el día 6 de enero de 2025. Los estudios incluidos en esta revisión fueron seleccionados en base a su relevancia clínica y calidad metodológica, incluyendo también comunicaciones científicas y abstracts presentados en congresos nacionales e internacionales. Los datos fueron analizados y comparados para identificar similitudes y diferencias en el uso de biomarcadores cardíacos en pacientes humanos y en perros.
Biomarcadores cardíacos: definición, utilidad y clasificación
Un biomarcador cardíaco es una sustancia biológica12 liberada a la circulación con características inherentes al concepto oficial de biomarcador,2,3 pero con la particularidad de que se asocia concretamente al estrés hemodinámico y/o cardíaco por cualquier causa.12,13
En 2012, la European Cardiology Society Task Force14 estableció que el diagnóstico de las cardiopatías debe realizarse en base a: 1) presencia de signos clínicos sugestivos, en reposo o en ejercicio; 2) evidencia objetiva de alteración estructural o funcional cardíaca (diastólica, sistólica o ambas) mediante pruebas complementarias; y 3) en casos donde el diagnóstico es dudoso, una respuesta positiva al tratamiento.
Aunque la evaluación ecocardiográfica es el método no invasivo más empleado para la valoración de distintas afecciones cardíacas,15-18 el desarrollo de otras técnicas como la medición de biomarcadores cardíacos circulantes en sangre periférica tiene un futuro prometedor en la evaluación de los pacientes con cardiopatías.7-11,15,18 En la actualidad, las principales indicaciones del uso de biomarcadores cardíacos incluyen:12
- detección de enfermedades subclínicas;
- diagnóstico de síndromes cardiovasculares agudos y crónicos;
- estratificación del riesgo cardiovascular;
- monitorización de la progresión de enfermedades cardiovasculares;
- evaluación de la respuesta a los tratamientos o indicación de la necesidad de ciertos tratamientos.
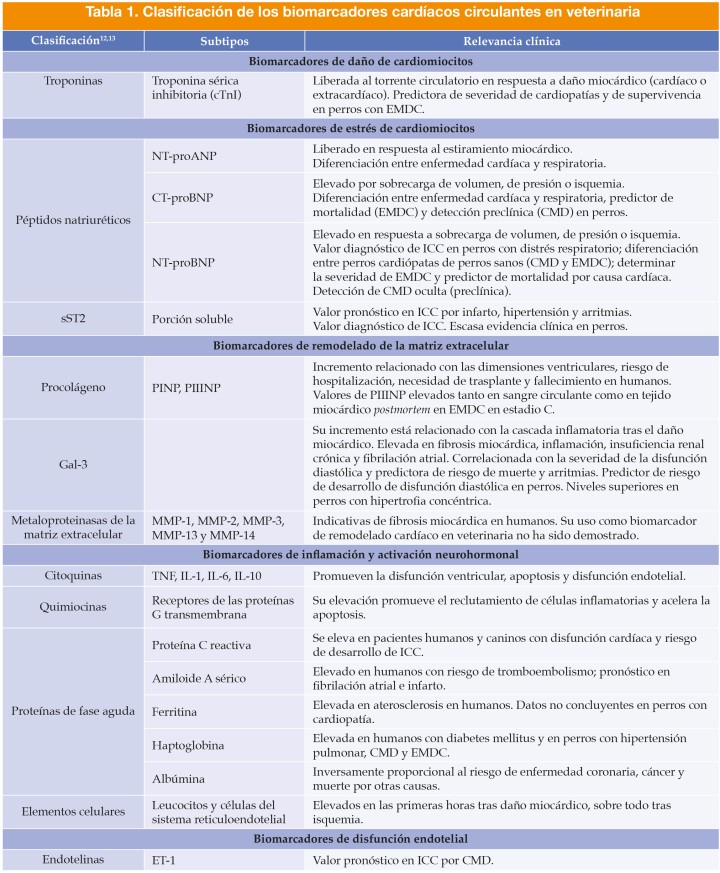
En medicina humana,13 los biomarcadores cardíacos medibles en sangre pueden ser clasificados según el mecanismo fisiopatológico determinante de sus concentraciones circulantes en:
- Biomarcadores de daño de cardiomiocitos: troponinas.
- Biomarcadores de estrés de cardiomiocitos: péptidos natriuréticos, porción soluble del factor de tumorogénesis de tipo 2.
- Biomarcadores de remodelado de la matriz extracelular: procolágeno tipos I y III, galectina-3, metaloproteinasas de la matriz extracelular, inhibidores tisulares de las metaloproteinasas.
- Biomarcadores de inflamación y estrés oxidativo: citoquinas (TNF-α e interleuquinas IL-1, IL-6 y IL-10), quimiocinas, proteínas de fase aguda (proteína C reactiva, haptoglobina, amiloide A sérico, ferritina, albúmina) y células inflamatorias (leucocitos y sistema mononuclear fagocítico).
- Biomarcadores de activación neurohormonal: endotelina-1.
Posteriormente, en veterinaria,12 además de los biomarcadores mencionados, se propuso además la categoría de biomarcadores de disfunción endotelial: selectinas, adhesinas, SDMA (dimetilarginina simétrica), factor de Von Willebrand, óxido nítrico.
No obstante, la clasificación de algunos de estos biomarcadores se solapa porque su liberación puede ser estimulada por diferentes mecanismos al mismo tiempo (p. ej., estrés de cardiomiocitos y activación neurohormonal en los péptidos natriuréticos), aunque en este artículo, se ha empleado la clasificación mencionada12,13 para su descripción (Tabla 1).
CMD, cardiomiopatía dilatada; CT-proBNP, carboxilo-terminal propéptido atrial natriurético; cTnI, troponina sérica inhibitoria; EMDC, enfermedad mitral degenerativa crónica; ET-1, endotelina-1; Gal-3, galectina-3; ICC, insuficiencia cardíaca congestiva; MMP, metaloproteinasas de la matriz extracelular; NT-proANP, amino-terminal propéptido atrial natriurético; NT-proBNP, amino-terminal propéptido cerebral natriurético; PIIINP, procolágeno tipo III; PINP, procolágeno tipo I; sST2, porción soluble del factor supresor de tumorogénesis de tipo 2; TNF, factor de necrosis tumoral.
Biomarcadores de daño de cardiomiocitos
Troponinas cardíacas
Las troponinas cardíacas (cTn) son proteínas que conforman el aparato contráctil de los cardiomiocitos y median la interacción entre la actina y la miosina,19 utilizándose como marcadores de daño miocárdico.19
Durante la contracción de los cardiomiocitos, la actina interactúa con la miosina para acortar el sarcómero, mientras que durante la relajación esta interacción se bloquea.19 Para que esto se produzca, el complejo de las cTn cuenta con tres subunidades moleculares: cTnT (tropomiosina), cTnC (dependiente del calcio) y cTnI (inhibitoria).19 Las subunidades cTnC y cTnI son las responsables de promover o inhibir, respectivamente, la contracción mediada por calcio y energía en forma de ATP.19 La cTnT está permanentemente unida a los filamentos finos con los que interacciona en el momento en que recibe la señal de la cTnC, que es la subunidad que activa el complejo en presencia del calcio. El proceso comienza con la salida de este desde el retículo sarcoplasmático al sarcoplasma y su unión al sitio de acción de la cTnC. Esto produce un cambio conformacional en la cTnC, de manera que la cTnI se separa de la actina. En consecuencia, los centros de unión a la actina quedan liberados e interaccionan con la miosina, posibilitando la contracción del sarcómero. Por tanto, la cTnI está unida a la actina en estado de relajación y recibe la denominación de inhibitoria tanto por bloquear la interacción actina-miosina como por bloquear la bomba ATPasa de la miosina (inhibiendo la hidrólisis del ATP requerida para que se produzca dicha interacción).19
Las subunidades cTnT y cTnI tienen isoformas específicas del músculo cardíaco y del músculo esquelético, mientras que la isoforma cardíaca de la cTnC es completamente homóloga a la que se encuentra en el músculo esquelético.19 Por ello, esta última no se puede considerar un biomarcador cardíaco clínicamente útil.5 La cTnT comparte más de un 50 % de isoformas homólogas al músculo esquelético, aunque se pueden identificar.5,19 La cTnI, además de que tiene un peso molecular bastante inferior a las anteriores (24 kDa), comparte menos del 50 % de homología con las isoformas musculoesqueléticas y contiene un péptido N-terminal que la caracteriza.19
Por tanto, la cTnI es más sensible como indicador de daño cardíaco, ya que se libera más fácilmente, tanto por su menor peso molecular como porque su unión al aparato contráctil es más débil que la de cTnT.20 Asimismo, concentraciones circulantes elevadas de ambas subunidades están asociadas a daño cardíaco más severo.20
Como todas las cTn son proteínas puramente intracelulares, su presencia en la circulación refleja su liberación después de un daño en los cardiomiocitos.19 La mayoría de las cTn están estructuralmente unidas al aparato contráctil19 y en mucha menor proporción libres en el sarcoplasma (o citosol): en torno a un 8 % en humanos y a un 2 % en perros para la cTnT.19 Inicialmente, la liberación rápida se produce desde el sarcoplasma, mientras que la liberación lenta y sostenida es originada por la rotura del aparato contráctil.19 En el ámbito clínico, las mediciones disponibles no permiten distinguir si su origen es citosólico o tanto citosólico como estructural (del aparato contráctil).19 Sin embargo, se puede aproximar su origen teniendo en cuenta que, cuando la elevación es citosólica, la vida media de este biomarcador es de aproximadamente 1,85 horas en el perro y de 2 horas en humanos.19
La magnitud de su elevación es variable según los mecanismos por los que se esté produciendo el daño y, a menudo, las elevaciones citosólicas y estructurales pueden coexistir.19 En daños graves o irreversibles, su liberación se produce fundamentalmente por necrosis y apoptosis celular. En cardiomiocitos viables con daños reversibles, los mecanismos principales que explican su liberación son: aumento de permeabilidad de membrana; formación de vesículas intracitoplasmáticas que contienen troponina libre en el citosol y su exocitosis; o por liberación de productos de degradación tras su proteólisis.19
En la práctica, en este artículo nos centraremos en el valor de la cTnI como biomarcador debido a que es la subunidad más investigada y ampliamente utilizada tanto en medicina veterinaria10-12,19,20 como humana.8,13
Los niveles circulantes de cTnI aumentan a las 2-7 horas después de un evento de daño miocárdico, alcanzan valores pico a las 18-48 horas y descienden a lo largo de varios días o semanas.19,20 Su eliminación se produce mediante proteólisis por el sistema reticuloendotelial y excreción renal.20
Se han comercializado alrededor de 15 análisis, todos ellos con anticuerpos dirigidos a epítopos diferentes, de modo que no pueden realizarse comparaciones entre ellos. La mayoría están diseñados para detectar cTnI humana, pero la secuenciación genética de la cTnI en perros, gatos y humanos ha demostrado un 96 % de homología.5,19 Se han validado dos análisis convencionales en perros21,22 y uno en gatos22 que ofrecen resultados cualitativos.
Los tipos de análisis más recientes tienen alta sensibilidad5 y pueden detectar cTnI de forma cuantitativa;5,23 por tanto, son los más recomendados porque, como se expone a continuación, la utilidad clínica de la cTnI en perros está principalmente asociada a determinar la severidad de la enfermedad cardíaca.24-29
Un estudio prospectivo recientemente publicado,24 que incluyó tanto a perros (n=80) como gatos (n=20) con enfermedades cardíacas y extracardíacas de distinta naturaleza, comparó la correlación entre resultados obtenidos mediante test rápido de inmunocromatografía para uso humano (Biosynex Troponin I, Byosinex SA, Illkirch-Graffenstaden, France) con un límite de detección >1 ng/ml, y los obtenidos con un análisis cuantitativo convencional de quimioluminiscencia inmunométrica (Immulite 2000 XPi troponin I test; Siemens Healthcare Diagnostics Inc., Tarrytown, NY) previamente validado23 en perros y en gatos con un rango de detección de 0,2-180 ng/ml.
La prueba convencional, con un coeficiente de variabilidad intra e interanálisis del 3,7 % al 4,7 % y del 5,9 % al 6,6 %,23 respectivamente, mostró una fuerte a moderada correlación con la prueba rápida, especialmente en aquellos pacientes con enfermedades que requerían tratamiento urgente por la severidad de la enfermedad cardiovascular (arritmias ventriculares complejas, endocarditis e insuficiencia cardíaca congestiva aguda).24
El test rápido mostró una sensibilidad del 97,3 % para identificar pacientes con cTnI >1 ng/ml y una especificidad del 88,9 % para identificar a aquellos con cTnI <1 ng/ml.24 Además, en esta publicación,24 se sugirió que la evaluación semicuantitativa del test rápido podría permitir estimar la magnitud de la elevación en función de la intensidad de tinción de la banda positiva. Este hallazgo apoya la necesidad de validar la utilidad clínica potencial del análisis semicuantitativo24 en estudios futuros con una mayor población de animales.
La elevación de este biomarcador no se debe utilizar de forma aislada para determinar una etiología específica de daño miocárdico, sino que los diagnósticos diferenciales se deben considerar abiertos y realizar los exámenes complementarios adecuados en cada paciente para determinar la causa del mismo.26 Además, las cardiopatías leves no siempre resultan en daño miocárdico, por lo que la exclusión de la enfermedad no debe realizarse únicamente en base a una medición.5,19
La liberación de cTnI puede estar asociada a tres grandes grupos de patologías:5,19
1. Afecciones cardíacas, que incluyen:
a.Cardiopatías estructurales adquiridas [enfermedad mitral degenerativa crónica (EMDC); fenotipo dilatado de cardiomiopatía (CMD); cardiomiopatía arritmogénica (ARVC); fenotipo hipertrófico de cardiomiopatía (CMH); miocarditis; dirofilariosis; tumores cardíacos] y potencialmente congénitas [estenosis subaórtica (ESA); estenosis pulmonar (EP); conducto arterioso persistente (CAP); defecto de septo interventricular (DSV) e interatrial (DSA)].
b. Traumatismos cardíacos.
c. Infarto de miocardio.
2. Afecciones pericárdicas: como la pericarditis constrictiva y la efusión pericárdica idiopática y neoplásica.
3. Afecciones extracardíacas: pancreatitis, sepsis, síndrome de respuesta inflamatoria sistémica (SIRS), síndrome dilatación-vólvulo gástrico, enfermedades infecciosas, respiratorias, tóxicas y metabólicas.
Cuando se evalúa al paciente en su conjunto, existen diferentes escenarios clínicos que pueden influir en la elevación de los niveles circulantes de cTnI:5,19
- Enfermedad renal concomitante.
- Enfermedades sistémicas: anemia, anemia hemolítica inmunomediada, dilatación-torsión gástrica, SIRS, hipertiroidismo, hipertensión arterial sistémica.
- Edad avanzada.
- Razas galgo y bóxer.
- Plasmas lipémicos o hemolíticos.
- Almacenamiento prolongado a temperatura ambiente.
- Ejercicio extenuante.
Como se muestra a continuación, la mayoría de los estudios en humanos se han focalizado en evaluar la utilidad de las cTnI en pacientes con fallo cardíaco por cualquier causa, diferenciando entre aquel con fracción de eyección preservada o reducida; mientras que, en animales, las investigaciones se han centrado sobre todo en la evaluación por enfermedades o entidades clínicas.
Estudios longitudinales evidencian que tanto humanos30 como animales5,19,29,31-33 con cardiopatías tienen aumentos crónicos de las concentraciones circulantes de cTnI. Aun así, las cardiopatías primarias crónicas causan elevaciones leves en el perro (<1 ng/ml), incluso cuando ya se ha instaurado la insuficiencia cardíaca congestiva (ICC), con valores <2 ng/ml,27 especialmente en EMDC.32 Por esta razón, la cTnI se emplea excepcionalmente con fines diagnósticos, salvo en infarto agudo de miocardio en humanos33 y ciertas situaciones concretas en el perro que se exponen a continuación.
En el perro, se ha evaluado la utilidad diagnóstica de la cTnI para diferenciar causas cardíacas de causas respiratorias en pacientes con distrés respiratorio,20,34 empleando un test rápido cuantitativo que ofrece resultados en 10 minutos [i-STAT® Cardiac Troponin I (cTnI), Abbott Point of Care, Princeton (NJ)].34 Sin embargo, aunque los valores de cTnI resultaron superiores en perros con cardiopatía, muchos casos respiratorios puros se solaparon debido probablemente a la hipoxia miocárdica, lo que significa que la especificidad de esta prueba es muy baja.
En EMDC,35 que es la cardiopatía primaria más frecuente en el perro,15 se han detectado concentraciones superiores en aquellos perros descompensados por ICC con hipertensión pulmonar (HP) postcapilar (n=48, cTnI 0,21 ng/ml), sin diferencias estadísticas respecto a aquellos con HP precapilar por otras causas (n=17, cTnI 0,25 ng/ml).35 Esto sugiere la capacidad diagnóstica de la cTnI para detectar ICC en perros con signos compatibles, pero no para discernir si presentan o no HP de cualquier origen.
En la interpretación de estos resultados,35 cabría tener en cuenta que, en condiciones normales, la masa del ventrículo derecho es inferior a la del ventrículo izquierdo. A pesar de que el número de pacientes incluidos en el grupo con HP precapilar era significativamente menor, los resultados de este trabajo estuvieron probablemente sesgados tanto por: 1) los distintos grados de severidad de la HP entre grupos (gradiente de presión 40 ± 12 mmHg en el grupo con HP postcapilar vs. 60 ± 30 mmHg en el grupo HP precapilar); como por: 2) el grado de hipertrofia ventricular derecha asociada al grupo con HP crónica precapilar.
Por esta razón, también en otras causas de HP, como el tromboembolismo pulmonar (TEP) agudo, determinar las concentraciones de cTnI ha demostrado hasta la fecha utilidad diagnóstica limitada. En HP pulmonar aguda por TEP, detectarlas o no dependerá del tiempo transcurrido desde el comienzo de los signos clínicos y de los desequilibrios del gradiente ventilación-perfusión pulmonar; mientras que, en la HP crónica por enfermedad respiratoria, el mecanismo por el que se produce su leve elevación está probablemente asociado a la disminución de la perfusión coronaria y al aumento de la masa ventricular derecha, en respuesta a los aumentos crónicos de poscarga.36
En el contexto de enfermedad tromboembólica,36 un parámetro con potencial utilidad en el cribado es el dímero-D, especialmente en perros con sospecha de esta, pero sin evidencia de trombos formados visibles en ecocardiografía. La prueba de aglutinación látex en el perro con valores de corte >500 ng/ml ha demostrado elevada sensibilidad (100 %), pero baja especificidad (70 %).37 Sin embargo, la necesidad de ser determinada en laboratorios externos limita su utilidad en situaciones de urgencia.37 De esto, se puede concluir que la combinación de biomarcadores para el diagnóstico de HP por TEP requiere de más estudios con grupos homogéneos clasificados según la severidad de la HP que permitan valorar si existen realmente diferencias o correlaciones y, así, abogar por estandarizar su uso.
En CMD,25 en la evaluación prospectiva de 118 pacientes de razas bóxer, dóberman y gran danés, las concentraciones de cTnI demostraron un bajo valor predictivo para la detección de la fase oculta de la enfermedad; mientras que otro artículo publicado más tarde,38 con una población de 336 perros dóberman, estableció que valores de corte >0,22 ng/ml tenían una sensibilidad del 79,5 % y una especificidad del 84,4 %. Este avance, relativamente reciente, apoyó el uso clínico de biomarcadores en veterinaria, incluyendo la cTnI, en las guías internacionales de la European Society of Veterinary Cardiology (ESVC)39 como una herramienta de cribado útil para la detección precoz de la CMD en esta raza, sobre todo cuando la ecocardiografía y los estudios Holter son inaccesibles, aunque un resultado de cTnI negativo no descarta la forma oculta de la enfermedad.
En cardiopatías congénitas en el perro (CAP, EA, EP, DSV) los niveles de cTnI no han demostrado ser diferentes respecto al grupo control (mediana cTnI 0,05 ng/ml, p=0,39).26 Estos hallazgos van en línea con lo observado también en niños, con la excepción de aquellos pediátricos con DSA y DSV por desvíos sanguíneos derecha-izquierda, donde sí que se han detectado elevaciones de cTnI en correlación con el ratio pQ:pS.40
Sin embargo, en una publicación41 con 30 perros de 3 años de edad de media (mediana 2,8 años) diagnosticados de formas leves, moderadas y severas de estenosis subaórtica (velocidad pico media en tracto de salida del ventrículo izquierdo 3,39 m/s; rango 2,78-5,02), se detectaron elevaciones de cTnI en 8/30 (27 %) de los pacientes (mediana 0,08 ng/ml; rango 0,01-0,94). Estas elevaciones mostraron una modesta, pero significativa, correlación positiva con ambos grosores diastólicos septal (p=0,042) y parietal (p=0,004) y dimensiones de atrio izquierdo (p=0,006), pero no con el gradiente de presión máximo a través de la obstrucción determinada mediante ecocardiografía (p=0,412).41
La diferencia de estos resultados podría explicarse por varios motivos. Por un lado, en el primer estudio26 se empleó un análisis de quimioluminiscencia inmunométrica (Immulite Troponin I, Diagnostic Products Corporation, Los Angeles, California) cuyo límite de detección es superior (0,05 ng/ml) al que se empleó en el estudio realizado con perros con ESA (Access AccuTnI, Beckman Coulter, Inc., Fullerton, CA; límite de detección de 0,02 ng/ml). Por otro lado, en el primer estudio, se incluyeron tan solo 15 perros, los cuales tenían diferentes patrones de hipertrofia y se agruparon junto a otros con cardiopatías adquiridas, diferenciándolos únicamente según la clase funcional del International Small Animal Cardiac Heart Council (ISACHC). En este sentido, de acuerdo con los resultados descritos por Oyama y Sisson (2004),41 las indicaciones futuras podrían considerar si el cribado mediante cTnI es capaz de identificar daño miocárdico por sobrecarga de presión al menos en pacientes con antecedentes familiares de ESA, o incluso relacionar sus concentraciones con la supervivencia, los cambios histológicos y el grado de hipertrofia observable en ecocardiografía.
Los niveles de cTnI en afecciones cardíacas secundarias, como el traumatismo cardíaco, la contusión miocárdica y las miocarditis, han sido también evaluados con fines diagnósticos y valor predictivo.42-50
En traumatismo cardíaco por cualquier causa, establecer el diagnóstico es importante por el riesgo de desarrollo de shock cardiogénico asociado a daños estructurales cardíacos, así como por la aparición de arritmias.42 En pacientes humanos con traumatismo cerrado, elevaciones de cTnI al ingreso predicen el desarrollo de arritmias ventriculares complejas en las primeras 24 horas del evento traumático,43 al igual que se ha demostrado recientemente en perros44 debido a la contusión miocárdica secundaria al trauma. Asimismo, se ha reportado elevación significativa de las concentraciones de cTnI y taquicardia ventricular en un perro con traumatismo cardíaco por disparo, con normalización de estas tras estabilización médica.45
Las miocarditis son otra entidad clínica donde las concentraciones de cTnI han sido evaluadas, aunque su diagnóstico en la práctica puede ser realmente complicado, ya que los diferenciales deben incluir la cardiopatía isquémica y la CMD.46
Las miocarditis pueden resultar tanto de afecciones primarias en el miocardio como de la extensión de procesos de endocarditis infecciosa en el 25 % de los casos en el perro y, más infrecuentemente, asociadas a pericarditis o epicarditis.47 Clínicamente pueden debutar en formas tanto agudas como crónicas,46 y el diagnóstico antemortem es comúnmente presuntivo dada la necesidad de obtener biopsia endomiocárdica como prueba confirmatoria.46,47
Las causas de miocarditis descritas en el perro son similares a las referidas en humanos, y estas pueden ser clasificadas en infecciosas y no infecciosas.46 Entre las causas infecciosas, se han publicado en el perro miocarditis víricas (parvovirus, virus del Nilo Oeste), protozoarias (Tripanosoma cruzi, Toxoplasma, Hepatozoon, Babesia, Leishmania), bacterianas (Staphilococcus, Streptococcus, Citrobacter, Bartonella, Borrelia, Ehrlichia), fúngicas (Coccidioides, Cryptococcus, Aspergillus) y helmínticas (Toxocara, Dirofilaria).46 Las inflamatorias no infecciosas,48 por su lado, incluyen las reacciones autoinmunes, la exposición a toxinas (aflatoxinas), la termoplejia (golpe de calor) y los traumatismos severos.46-48
La sospecha de esta entidad clínica se establece antemortem mediante la combinación de los hallazgos de la historia y el examen físico, junto con la detección de agentes infecciosos potencialmente implicados, elevaciones de cTnI >0,06 ng/ml (y comúnmente >0,2 a 1 ng/ml o más),46 arritmias ventriculares (aproximadamente 50 % de los casos)47,48 y evidencia ecocardiográfica de disfunción sistólica ventricular.46,47
En casos de miocarditis presuntiva por Bartonella confirmada postmortem mediante histopatología,46 se han detectado concentraciones de cTnI = 3,74 ng/ml, mientras que en casos de miocarditis de Chagas por Tripanosoma cruzi49 se han reportado elevaciones variables, de entre 0,33 y >50 ng/ml. Esta variación en los niveles circulantes del biomarcador puede ocurrir según el momento en que se realiza la medición, por lo que la determinación al inicio y durante el curso de la enfermedad puede arrojar información no solo para apoyar el diagnóstico, sino también para orientar sobre la severidad del daño, que a menudo es irreversible por la muerte progresiva de cardiomiocitos.46
Muy recientemente, se ha publicado una revisión sistemática de más de 80 años de historia sobre daño miocárdico asociado a Leishmania infantum, evidenciando elevaciones leves a moderadas de cTnI en perros con cuadros de leishmaniosis visceral, los cuales mostraron infiltrados linfoplasmocitarios e histiocíticos postmortem sugestivos de miocarditis especialmente en las cavidades derechas. Estos hallazgos deben alertar sobre la necesidad de cribar a los pacientes positivos a la enfermedad para la estratificación del riesgo de complicaciones cardiovasculares a corto-medio plazo mediante la determinación de cTnI y ecocardiografía.50
En afecciones pericárdicas, se han detectado elevaciones de cTnI en perros con efusión pericárdica,51-53 siendo además significativamente mayor (p <0,001) en aquellos con efusión neoplásica por hemangiosarcoma, HSA (2,77 ng/dl; rango 0,09-47,18 ng/dl) que en perros con efusión pericárdica idiopática (0,05 ng/dl; rango 0,03-0,09 ng/dl).51 Por ello, la cTnI es de utilidad diagnóstica para distinguir perros con efusión pericárdica causada por HSA.51 Chun y col. (2010)53 establecieron que valores de corte >0,25 ng/ml pueden ser utilizados para identificar perros con enfermedad sincrónica por HSA tanto cardíaco como en otras localizaciones, en comparación con las concentraciones de cTnI en perros con HSA extracardíaco, otras neoplasias o efusión pericárdica no neoplásica, con una sensibilidad del 78 % y una especificidad del 71 %. Además, cuando los pacientes se presentaban con efusión pericárdica, la concentración de cTnI >0,25 ng/ml mejoraba su capacidad de detección para el diagnóstico de HSA cardíaco, con una sensibilidad (81 %) y especificidad (100 %) excelentes. No se han encontrado datos referentes a la cTnI en pericarditis idiopática canina, aunque por extrapolación de la información disponible en medicina humana,54 es probable que las elevaciones de cTnI ocurran también en el perro debidas al daño inflamatorio del epicardio y, por extensión, al miocardio secundariamente a la constricción pericárdica.19
La utilidad pronóstica de la cTnI ha sido también evaluada y, generalmente, sus niveles se correlacionan positivamente con la severidad de la enfermedad cardíaca en el perro.27,29,38,41,55,56
Las curvas de supervivencia de un estudio realizado por Oyama y Sisson41 en CMD revelaron que aquellos perros con concentraciones circulantes <0,20 ng/ml tenían tiempos de supervivencia más largos, respaldando su utilidad en la estratificación del riesgo como predictor de muerte por causa cardíaca en CMD. En dóbermans, niveles de cTnI >0,34 ng/ml son predictivos de riesgo de muerte súbita.38
En CMH primaria, un estudio retrospectivo reciente57 con 10 perros en su mayoría sintomáticos (70 % de los casos con síncopes y/o distrés respiratorio por ICC) puso de manifiesto un aumento significativo de cTnI (mediana 3,94 ng/ml) en el momento del diagnóstico. Además, se correlacionaron positivamente los niveles circulantes de cTnI con el grosor del septo interventricular (p=0,01). En todos los casos se realizó estudio histopatológico postmortem donde se evidenciaron cambios consistentes con hipertrofia y desorganización de fibras musculares (70 %), fibrosis intersticial (80 %) y arteriosclerosis intramural (100 %), observando que aquellos pacientes con mayores elevaciones de cTnI (rango 17,05-28,93 ng/ml) presentaban isquemia y necrosis miocárdica severas asociadas a la exacerbación aguda de la ICC, mientras que en aquellos con niveles más bajos (rango 0,12-4,31 ng/ml), las elevaciones se atribuyeron a daño miocárdico por la sobrecarga crónica de presión, más que a la muerte de cardiomiocitos.57
En perros con EMDC en estadio C, valores indetectables de cTnI (por debajo del límite de detección de 0,1 ng/ml) han evidenciado tiempos de supervivencia más largos (mediana 390 días; rango 20-912), mientras que aquellos con valores detectables (mediana 0,24 ng/ml; rango 0,12-0,31 ng/ml) tenían tiempos de supervivencia más cortos (mediana 67,5 días; rango 1-390).58 De acuerdo con estos resultados, otra publicación posterior59 con 202 perros en distintas fases de la enfermedad determinó que valores >0,025 ng/ml, independientemente de su concentración exacta, se asociaron a un mayor riesgo de mortalidad por EMDC (tiempo de supervivencia mediano 475 días; rango 409,7-540,3).59 Fonfara y col.60 evaluaron perros con varias cardiopatías, tanto congénitas como adquiridas, y hallaron que valores <0,15 ng/ml tenían mayor supervivencia que los perros con valores entre 0,15 y 1 ng/ml. En este último estudio,60 los perros con valores cTnI >1 ng/ml en el momento del diagnóstico y con elevaciones persistentes dos meses después tenían tiempos de supervivencia significativamente más cortos (3 meses). De ello, se puede extraer que la medición de cTnI a lo largo de la enfermedad tiene gran interés pronóstico,60 por lo que es útil obtener un valor basal y realizar un seguimiento de la tendencia de cada individuo como predictor de supervivencia.5,60
Se ha propuesto también que, en perros candidatos a la implantación de marcapasos, elevaciones de cTnI quíntuplas del valor de referencia laboratorial sugieren necrosis miocárdica muy grave, asociándose a un mayor riesgo de mortalidad postanestésica.56 Esta evidencia puede justificar la necesidad de intensificar el tratamiento médico antes de la intervención, especialmente en bloqueos atrioventriculares completos por miocarditis.56
En perros con dirofilariosis,61 la cTnI ha demostrado utilidad para diferenciar aquellos con cargas parasitarias altas en ecocardiografía (mediana cTnI 3,62 ± 4,78 ng/ml) respecto a los diagnosticados con cargas leves, cuyos valores fueron similares a los del grupo control (0,78 ± 0,22 ng/ml).61 Además, los perros clasificados con cargas elevadas mostraron disminuciones interesantes a lo largo del tratamiento médico adulticida, aunque persistieron levemente elevadas (0,95 ± 0,35 ng/ml) al día 120 desde el inicio del tratamiento a pesar de la curación de la enfermedad.61 En otro estudio,62 la detección de cTnI con valores 0,99 ± 0,39 junto con elevaciones de dímero D (0,34 ± 0,07 µg/ml) se correlacionó con la severidad clínica y sintomática, alcanzando valores de 1,99 ng/ml ± 0,33 en el grupo de perros con síndrome de vena cava y riesgo elevado de desarrollo de enfermedad tromboembólica y coagulación intravascular diseminada (dímero D 0,81 ± 0,46 µg/ml). En este sentido, la determinación de cTnI junto con otros biomarcadores puede potencialmente diferenciar entre pacientes candidatos a la cirugía (extracción de los vermes) de aquellos que pueden ser manejados médicamente en función de su carga parasitaria.62
La utilidad de la cTnI en la monitorización terapéutica ha sido escasamente investigada en veterinaria. Se han descrito cambios en los niveles séricos de cTnI en 46 perros con EMDC dos semanas después de iniciar el tratamiento,28 correlacionando esta reducción con la mejoría clínica. Una investigación preliminar, presentada en un congreso,63 documentó que los niveles de cTnI solo se mantenían elevados durante la fase aguda de la ICC por EMDC (0,8-1,3 ng/ml) y que, a los 30 días postratamiento, cuando los pacientes estaban asintomáticos, los valores eran similares a los del grupo control, manteniéndose estables 180 días después de la primera medición.63
En pacientes oncológicos, tanto en humanos como en el perro, se ha investigado la utilidad de la cTnI en la monitorización terapéutica y como predictor del desarrollo de cardiotoxicidad asociada al uso de antraciclinas (como la doxorrubicina y la epirrubicina) y agentes alquilantes (como la ciclofosfamida).64 El efecto cardioacumulativo puede inducir cardiotoxicidad tanto subaguda como crónica debida a la muerte celular y a la liberación de radicales libres, y tanto humanos como perros muestran cambios histológicos y ecocardiográficos similares asociados a la medicación que, además, son irreversibles.64
El porcentaje de complicaciones cardíacas (como el desarrollo de arritmias ventriculares, disfunción sistólica y fenotipos dilatados de cardiomiopatía) es variable según la dosis acumulada: del 5 al 30 % en humanos (dosis total de doxorrubicina 550 a 700 mg/m2) y del 3 al 18 % en perros (dosis 180-240 mg/m2).64
En un estudio retrospectivo realizado con 44 perros con linfoma y osteosarcoma recibiendo tratamiento con doxorrubicina,64 se determinaron las concentraciones de cTnI antes, durante y después del tratamiento, observando elevaciones significativas al finalizar el protocolo (p=0,0083) e incluso antes de que se desarrollaran signos clínicos y/o ecocardiográficos de cardiomiopatía inducida por el fármaco. Esta se puede manifestar con distrés respiratorio e intolerancia al ejercicio y muerte súbita atribuibles al desarrollo de ICC y arritmias complejas, respectivamente. Por ello, la evaluación no invasiva de daño cardíaco con cTnI, en combinación con distintas modalidades de ecocardiografía y la electrocardiografía o incluso la monitorización Holter, puede permitir al clínico identificar a aquellos pacientes con mayor riesgo de desarrollo de cardiotoxicidad durante el tratamiento y modificar, si es necesario, el protocolo quimioterápico. Aunque faltan estudios en animales que permitan predecir el riesgo de desarrollo de cardiomiopatía en este sentido, los resultados de la monitorización de cTnI pueden plantear la necesidad de terapia cardioprotectora antes de que el daño instaurado afecte negativamente a la condición clínica general de los pacientes.
Aun en ausencia de afección cardíaca previa, la medición de cTn también puede ser de utilidad en ciertas patologías extracardíacas,5,19 tal y como se menciona anteriormente. Por ejemplo, en perros con SIRS, se ha evidenciado que concentraciones de cTnI <0,24 ng/ml tienen valor pronóstico por ser un excelente predictor de supervivencia a corto plazo.19 La determinación de cTn en patologías extracardíacas (p. ej., SIRS, síndrome dilatación-vólvulo gástrico, pancreatitis) va más allá del objetivo principal de esta revisión, por lo que los autores referencian algunos de los estudios donde pueden ser consultadas.5,19
Teniendo en cuenta lo anterior, la cTnI tiene características que la convierten en un biomarcador ideal: es específica del corazón, sus concentraciones circulantes en individuos sanos son despreciables, tienen una liberación dinámica, persisten en la circulación días o incluso semanas, y se correlacionan con la severidad del daño miocárdico. Sin embargo, aunque son específicas del corazón, no son específicas de la etiología, por lo que no reemplazan a otras técnicas diagnósticas y, posiblemente, su combinación junto con otros biomarcadores puede potenciar su utilidad tanto pronóstica como en la toma de decisiones terapéuticas.
Nota
Este artículo de revisión se ha dividido en tres partes y se publicará en tres números consecutivos de Clínica veterinaria de pequeños animales.
Fuente de financiación: este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Puedes descargarla en el enlace:
[http://bit.ly/42j]