Evisceración intestinal transcloacal en Trachemys scripta. A propósito de un caso clínico
Transcloacal intestinal evisceration in Trachemys scripta. A case report
Contacto: aglvet@hotmail.com
Resumen
La patología cloacal se observa con cierta frecuencia en la clínica de reptiles y está representada mayoritariamente por el prolapso de dicha estructura cuya etiología es multifactorial. El presente artículo muestra el caso de una evisceración intestinal transcloacal en una hembra de Trachemys scripta. El animal presentaba una masa exteriorizada por la cloaca que se identificó como asa intestinal eviscerada a través de la misma; se practicó una plastrotomía para la reducción del tejido exteriorizado y una enterectomía debido a los daños tisulares que presentaba. La recuperación postquirúrgica y evolución fueron satisfactorias. Hasta el momento de la elaboración de este artículo no se ha encontrado ningún reporte bibliográfico sobre dicha patología; el presente trabajo tiene por objetivo dar a conocerla y exponer los hallazgos clínicos observados, aportando un nuevo diagnóstico diferencial en tortugas que se presenten en consulta con exteriorización de tejidos a través de la cloaca. Del mismo modo se expone el tratamiento aplicado para su resolución. Finalmente, se trata de buscar una explicación a dicho proceso encontrando como posible causa un manejo deficiente durante la época de puesta que podría favorecer la aparición de cuadros distócicos repetidos en el tiempo.
Palabras clave: pseudoprolapso de cloaca, evisceración, tortuga, cirugía, enterectomía, distocia.
Clin Vet Peq Anim 2025, 45 (2): 103-109
Summary
Cloacal pathology is commonly observed in reptiles and is most frequently represented by cloacal prolapse, which has a multifactorial etiology. This article presents a case of transcloacal intestinal evisceration in a female Trachemys scripta. The animal was presented with a mass protruding through the cloaca, which was identified as an eviscerated intestinal loop. A plastrotomy was performed to allow reduction of the exteriorized tissue, along with an enterectomy due to the extent of tissue damage. Postoperative recovery and progression were satisfactory. At the time of writing, no prior bibliographic reports of this specific pathology were found. The aim of this report is to document the case, describe the associated clinical findings, and provide a new differential diagnosis for turtles presenting with cloacal tissue protrusion. Additionally, the surgical treatment applied is described. A possible underlying cause identified was poor husbandry during the oviposition period, which may contribute to recurrent dystocia and predispose to this condition.
Keywords: cloacal pseudoprolapse, evisceration, turtle, surgery, enterectomy, dystocia.
Clin Vet Peq Anim 2025, 45 (2): 103-109

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
La cloaca es una estructura presente en determinadas especies de animales vertebrados; aves, reptiles, anfibios y algunos grupos de peces y mamíferos la poseen. Anatómicamente es un órgano cavitado donde confluyen el tracto digestivo, urinario y reproductor para abrirse al exterior.1-3
El órgano se divide en tres regiones (Fig. 1), delimitadas por pliegues:
– Coprodeo: el segmento anterior, continuación del colon distal.1,2
– Urodeo: la sección media, donde desembocan los uréteres, la vejiga de la orina en aquellas especies que la tienen y los conductos del tracto genital. En algunas especies la desembocadura del uréter y del tracto genital están fusionadas y lo hacen a través de la papila urogenital.1,2
– Proctodeo: es la parte final de la cloaca antes de abrirse al exterior. En los machos se encuentra el pene (en aquellas especies que lo poseen) y es donde se produce la cópula en el caso de las hembras.1,2
Dada la complejidad de esta zona anatómica podemos ver cómo enfermedades procedentes de distintos sistemas orgánicos pueden manifestarse con una sintomatología similar.
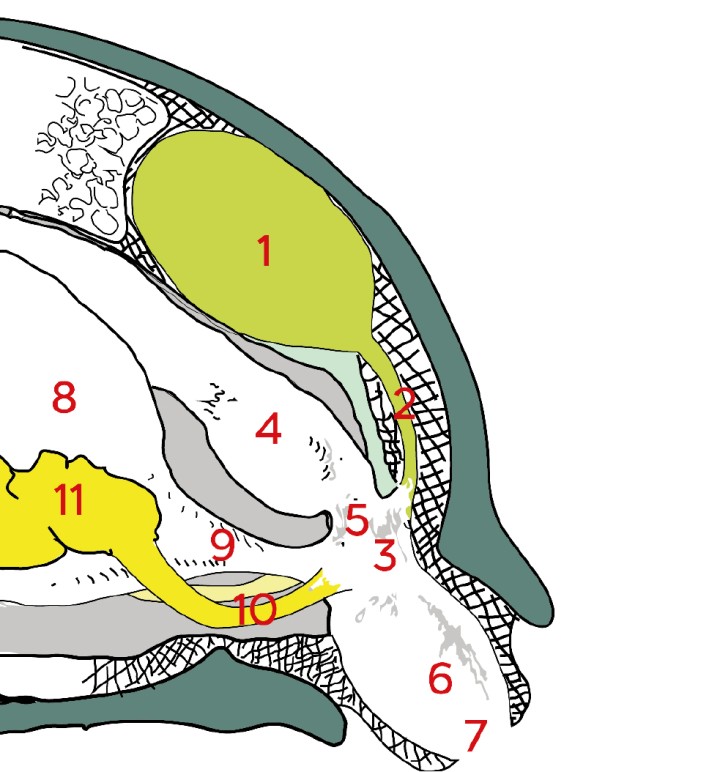
Figura 1
Esquema de la anatomía del celoma caudal en un quelonio. Modificado de Medicine and surgery of tortoises and turtles.3 1: riñón; 2: uréter; 3: urodeo; 4: recto; 5: coprodeo; 6: proctodeo; 7: abertura cloacal; 8: vejiga; 9: uretra; 10: ductos genitales; 11: gónada.
Caso clínico
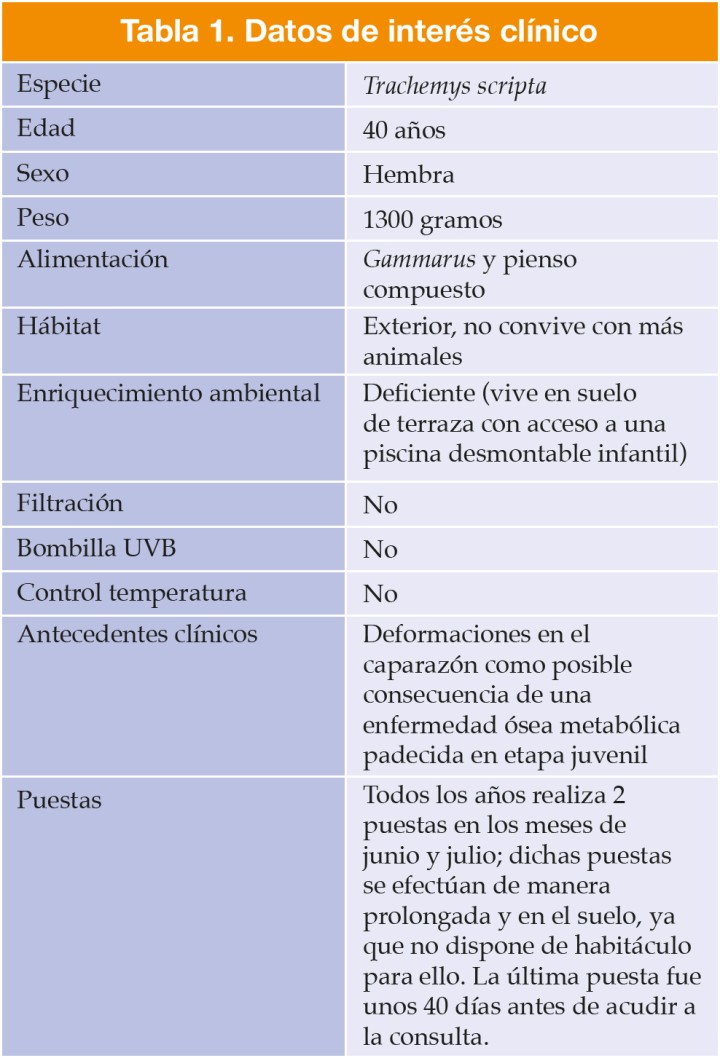
Un ejemplar de Trachemys scripta acude a consulta para valorar un prolapso de cloaca diagnosticado en otro centro (Tabla 1).
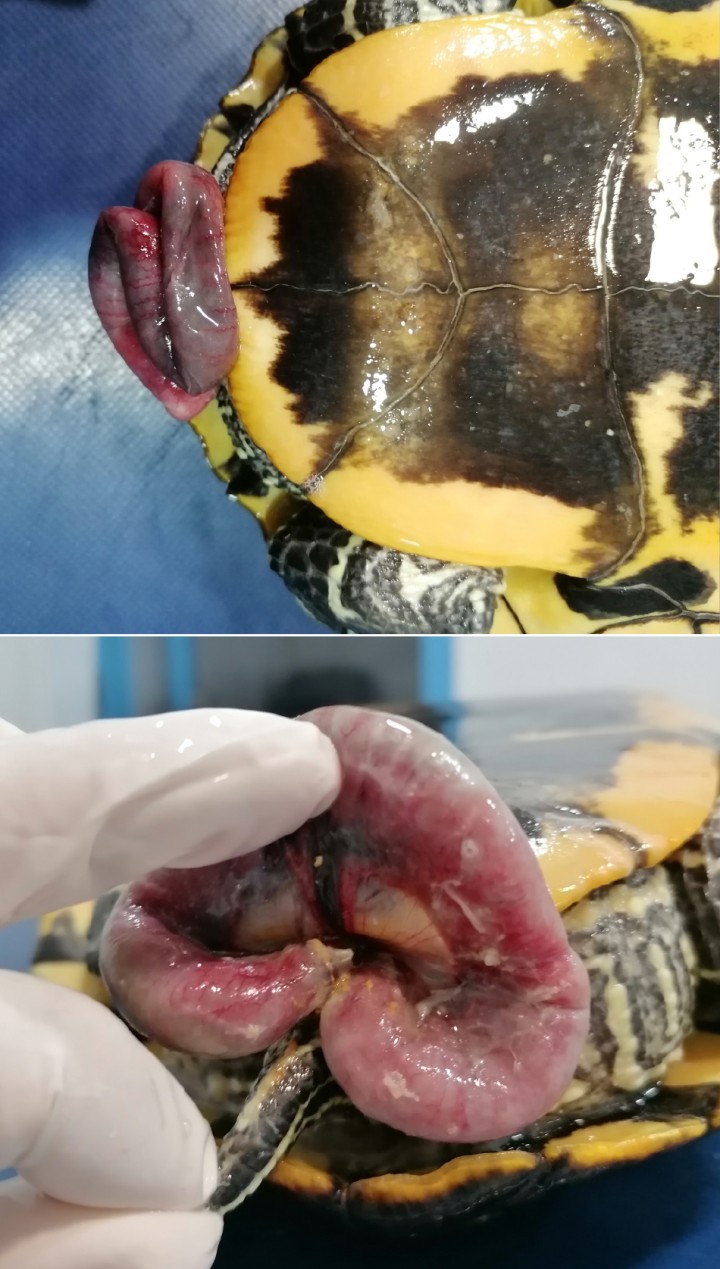
En el momento de la exploración está activo y con cierta agresividad. Presenta buen estado de hidratación, correcta condición corporal y mucosas normales. En la zona cloacal se aprecia una estructura tubular en forma de “C” compatible con un asa intestinal con su mesenterio correspondiente (Fig. 2); el hecho de no presentarse como una estructura en forma anular o tubular con orificio central hacía poco probable que se tratara de un prolapso cloacal, uterino o de colon. Estos hallazgos indicarían una evisceración intestinal a través de la cloaca.
Figura 2
Detalle de asa intestinal exteriorizada a través de la cloaca.
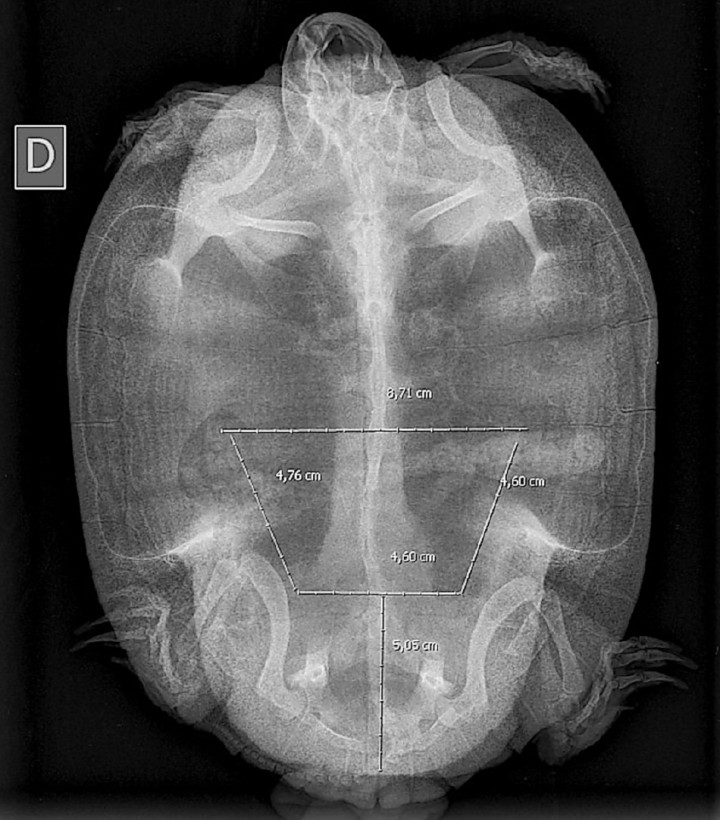
Dada la gravedad de la lesión se propone la realización de una celiotomía exploratoria. Para la planificación quirúrgica se obtiene una radiografía en la que no se detectan signos de obstrucción digestiva, distocia, ni otras anormalidades. Sobre la imagen radiológica se simula una ventana lo más caudal y amplia posible que permitirá la exploración de la cavidad celómica (Fig. 3). Asimismo, se realizan un microhematocrito y bioquímica sérica cuyos resultados no muestran anormalidades (Tabla 24).
Figura 3
Simulación de la osteotomía sobre imagen radiológica.
BUN: nitrógeno ureico sanguíneo. AST: Aspartato aminotransferasa. CK: Creatina quinasa.
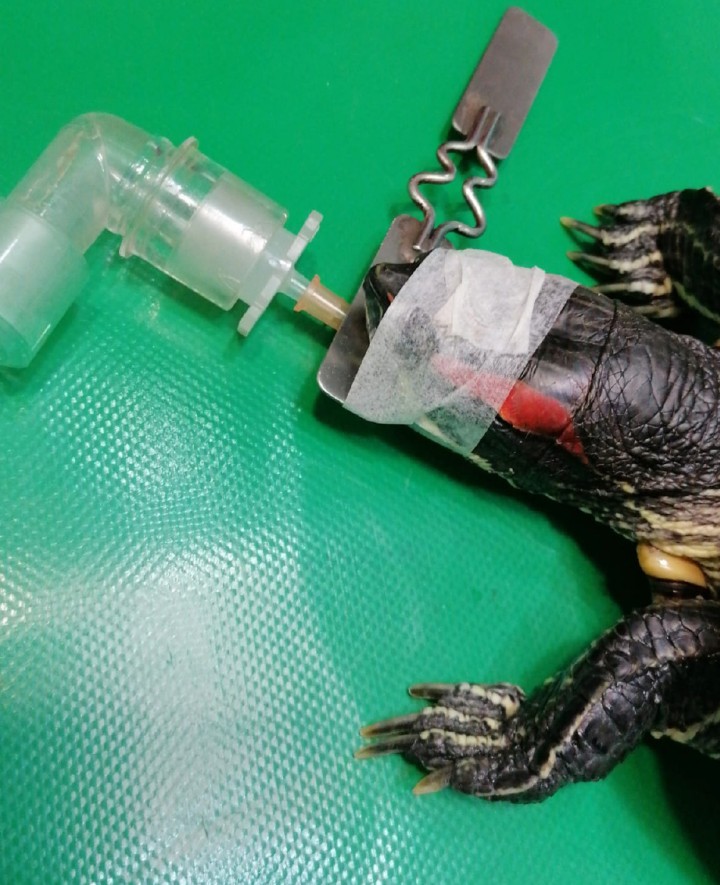
Tras la inducción anestésica (Tabla 35-8) se procede a la intubación traqueal con un catéter endovenoso de 14 G que se conecta a un circuito T de Ayre (Fig. 4) con un flujo de oxígeno de 2 l/min junto al gas anestésico (Tabla 35,6,8) . Cada 30 segundos se realizaron ventilaciones manuales.
Figura 4
El animal intubado tras la inducción anestésica.
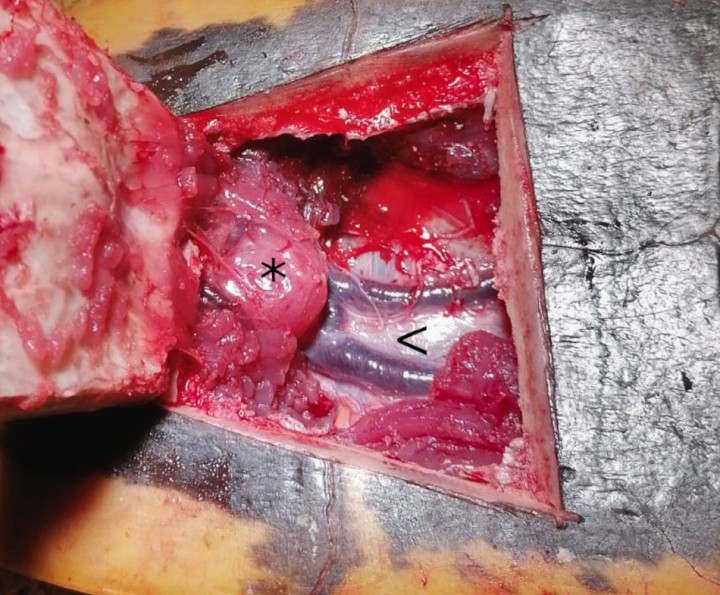
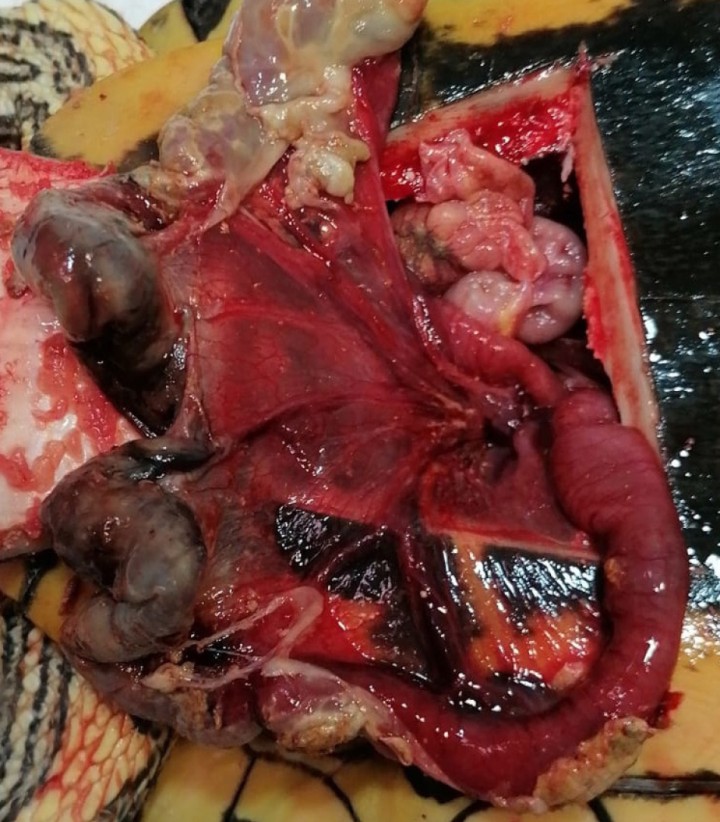
Con sierra oscilante (Aesculap®, B. Braun, Tuttlingen) se practican las osteotomías en el plastrón, con una inclinación de 45 º. Los cortes engloban todo el espesor óseo, salvo en el lado caudal donde se pretende crear una bisagra. Una vez elevado el colgajo óseo se procede a la disección roma de la musculatura, quedando expuestas las venas abdominales ventrales (Fig. 5). Se accedió a la cavidad celómica entre dichas venas incidiendo el pleuroperitoneo.9-16
Figura 5
Venas abdominales ventrales (<) y borde craneal del pubis (*) al elevar el colgajo óseo.
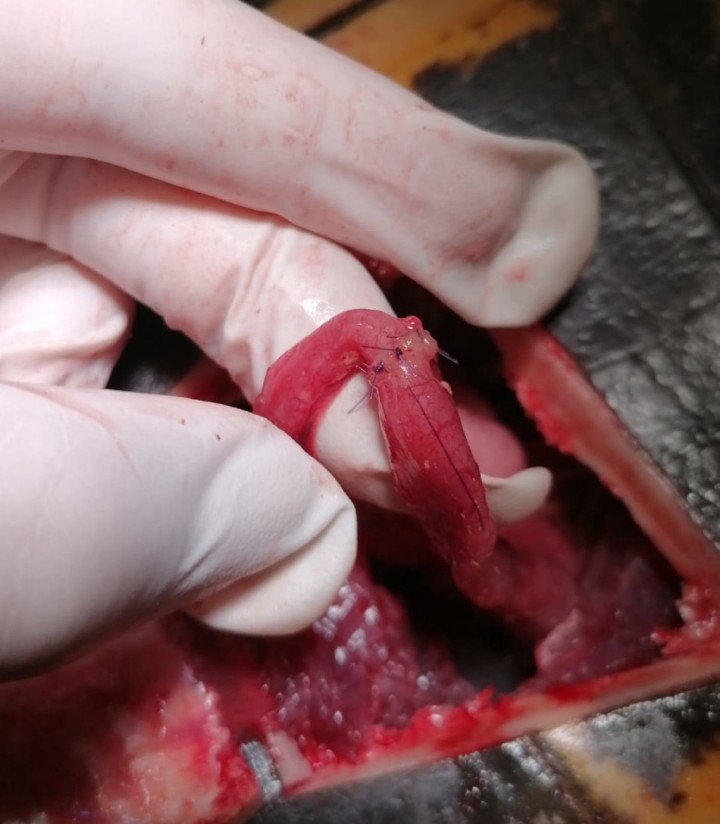
La exploración del celoma era en apariencia normal, sin actividad ovárica. Se procedió a traccionar cuidadosamente de las asas intestinales de manera que el asa exteriorizada se introdujo hasta el punto en que existía cierta resistencia. Seguidamente, ejerciendo cierta presión digitalmente (con un dedo enguantado) vía cloacal se logró reducir un tramo de intestino largo de 12 centímetros. Dicho tramo estaba cubierto de placas diftérico-fibrinosas, edematoso, hemorrágico y friable; por ello se decidió realizar una enterectomía (Fig. 6). La técnica quirúrgica se llevó a cabo de la misma forma en la que se realiza en mamíferos, con la salvedad que no se omentalizó, ya que los reptiles carecen de omento. La anastomosis terminoterminal, dado que el diámetro de ambos extremos entéricos no coincidía en tamaño, se efectuó realizando un corte oblicuo en el de menor calibre.17 La sutura utilizada fue monofilamento reabsorbible de 5/0 (PGC), aguja atraumática en patrón de puntos simples (Fig. 7). Posteriormente, se comprobó la estanqueidad de la sutura inyectado 1 ml de SSF. Tras la enterectomía se volvió a explorar digitalmente la cloaca ejerciendo presión, observándose varios defectos en la serosa que dejaban ver el guante del asistente. Con cierta dificultad se procedió a su cierre con puntos simples, usando el mismo patrón de sutura. Tras esto, se realizó una pexia del tramo intestinal con dos puntos simples a la musculatura abdominal. Después del lavado de la cavidad celómica se procedió al cierre del pleuroperitoneo con el mismo material de sutura y un patrón simple continuo; el colgajo óseo se recolocó y se aseguró con tres cerclajes de acero quirúrgico de 0,8 mm que se habían colocado previamente a través de túneles óseos perforados con taladro. Las líneas de osteotomía se cubrieron con pomada de sulfadiacina argéntica (Silvederma®, Laboratorio Aldo-Unión SL, Barcelona) y todo se selló con resina epóxica (Poxilina®, Fenedur SA, Montevideo) (Fig. 8).9,16 A continuación, se realizó una sutura en bolsa de tabaco en la cloaca que se retiró a los 3 días.
Figura 6
Tramo intestinal una vez reducido y exteriorizado con aspecto necrótico.
Figura 7
Anastomosis terminoterminal entérica.
Figura 8
Cierre de la osteotomía.
La recuperación anestésica completa duró 3 horas. Se indicó antibioterapia sistémica (Tabla 37,8) y baños dos veces al día cubriendo la abertura cloacal; el resto del tiempo permanecía en seco. Una semana después de la intervención quirúrgica se preparó un recipiente con agua donde se le ofreció pescado congelado, el cual fue aceptado sin problemas y empezó a defecar a diario. Dos semanas más tarde el paciente fue trasladado a su tanque habitual, protegiendo la zona quirúrgica con apósitos impermeables (Fixomull® transparente, BSN Medical, Barcelona). En ese momento dimos el alta médica.
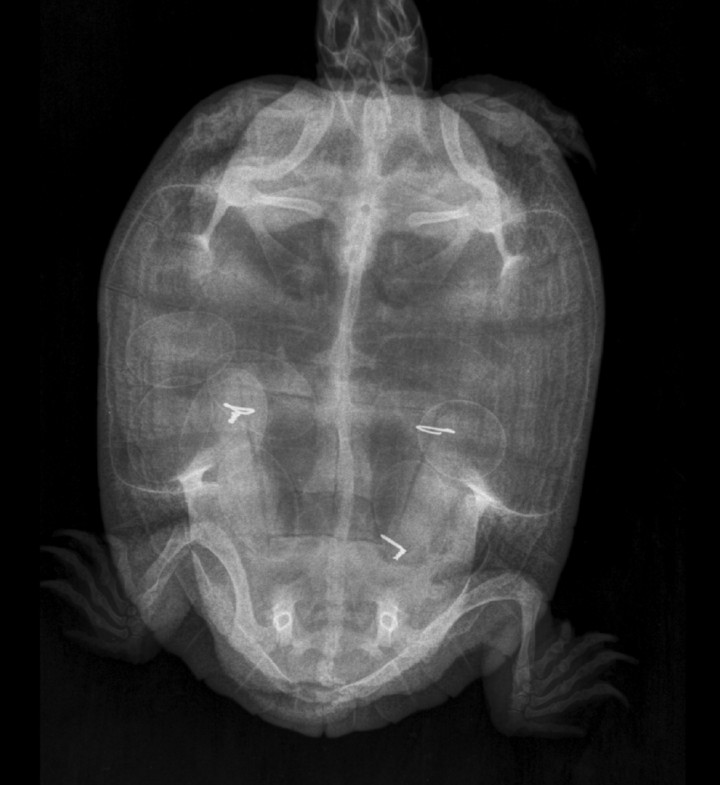
Se pautaron medidas de enriquecimiento ambiental para facilitar puestas futuras (instalar un receptáculo de fácil acceso con una mezcla de arena y turba) y, además, se ofreció la opción de esterilizar al animal como medida de supresión de la puesta una vez su recuperación fuera completa. Ocho meses después de la intervención, el propietario advirtió comportamiento de puesta pero ésta no llegó a efectuarse; tras realizar una radiografía y confirmar la presencia de huevos (Fig. 9) se instauró un tratamiento médico para inducir la puesta (Tabla 37,8), que resultó exitoso a las pocas horas.
Figura 9
Radiografía dorsoventral a los 8 meses de la cirugía con presencia de estructuras ovoides con radiodensidad mineral compatibles con huevos.
Discusión
Las patologías cloacales en reptiles se observan con frecuencia en la clínica de animales exóticos, teniendo una etiología multifactorial, ya que parasitosis, cuerpos extraños digestivos, distocias, urolitos o incluso la enfermedad ósea metabólica (EOM) pueden producirla.18 En cuanto a los métodos de diagnóstico, además de la información obtenida durante la exploración, suele ser necesaria la realización de pruebas de imagen, cobrando especial interés la radiografía simple y/o con contraste y la cloacoscopia; la ecografía por fosa inguinal o técnicas de imagen avanzadas podrían resultar también de utilidad; análisis de sangre y heces completarían la batería de pruebas diagnósticas.19
El tratamiento consiste en recolocar siempre que sea posible los tejidos exteriorizados, fijarlos con una pexia y realizar una sutura temporal en bolsa de tabaco en la abertura cloacal disminuyendo su luz. En aquellos casos en los que la reducción de los tejidos no sea posible o que estos presenten signos de necrosis, deberán ser resecados.13,15 En el presente caso, la cloacoscopia habría ayudado a localizar el defecto, pero no se realizaron otras pruebas y se optó directamente por la cirugía. En tortugas el abordaje a la cavidad celómica puede efectuarse a través de la fosa inguinal (abordaje prefemoral), osteotomía del plastrón o una combinación de ambos;9-13 la elección de dicha técnica dependerá de la patología a resolver e incluso de la especie con la que estemos tratando. La osteotomía se puede realizar con sierra oscilante para un corte más controlado y menor trauma en tejidos blandos, aunque también se pueden usar herramientas rotatorias tipo Dremel®; en neonatos o individuos jóvenes se puede hacer con hoja de bisturí.11 Durante la osteotomía es importante respetar el periostio y la musculatura adyacente para mantener un correcto aporte sanguíneo hacia el hueso, los cortes deben angularse para que en el momento del cierre el colgajo no “caiga” hacia la cavidad celómica y asegurar un correcto contacto de los fragmentos óseos para la posterior cicatrización.11 En el momento del cierre si se utilizan resinas epóxicas u otros pegamentos, estos no deben entrar en la línea de corte, ya que pueden interferir en la cicatrización; dicho proceso normalmente ocurre en 12 semanas, aunque puede demorarse hasta doce meses.11 La radiografía no es útil para monitorizar la cicatri-zación, ya que las líneas radiolúcidas de la osteotomía pueden persistir años.11 El material de fijación, salvo en animales en crecimiento, no es necesario retirarlo; en cambio en individuos jóvenes se recomienda retirar a partir de las ocho semanas de la intervención.11-16,19,20 Como complicación más frecuente de esta intervención se incluye el fracaso de la osteotomía, con necrosis del colgajo por daños vasculares. Si esto ocurre se debe retirar el tejido desvitalizado y promover un cierre por segunda intención.11
Tras realizar una búsqueda bibliográfica, no se han encontrado referencias sobre defectos en la pared cloacal con la evisceración de órganos celómicos tal y como ocurrió en este caso. Como posible explicación a lo ocurrido se baraja la hipótesis de un cuadro distócico, ya que según el propietario todos los años la tortuga pasaba varios días buscando un lugar de puesta hasta que finalmente la realizaba en el suelo o en el agua, durando este proceso en torno a un mes. Este hecho pudo ir debilitando las paredes de la cloaca hasta el punto de crearse el defecto (no se puede descartar que, además, durante la cirugía se produjeran nuevos defectos consecuencia de la manipulación para reducir el tejido eviscerado).
Fuente de financiación: este trabajo se ha realizado sin financiación comercial, ni del sector público, ni de organismos privados.
Conflicto de intereses: los autores declaran que no existen conflictos de intereses.
Bibliografía
- 1.
Boyer T, Innis C: Chelonial Taxonomy, Anatomy and Physiology. En Mader´s Reptile and Amphibian Medicine and Surgery (third ed), St Louis, Saunders Elsevier, 2019; 43-46.
- 2.
Hnizdo J: Turtle anatomy and physiology. En Medical care of turtles and tortoises, Frankfurt, Edition Chimaira, 2011; 16-19.
- 3.
Mc Arthur S, Meyer J, Innis C: Anatomy and Physiology. En Medicine and surgery of tortoises and turtles, Oxford, Blackwell Publishing, 2004; 54.
- 4.
Carpenter JW, Harms CA: En Carpenter´s exotic animal formulary (sixth edition), St Louis, Elsevier, 2023; 172-174.
- 5.
Hnizdo J: Anaesthesia and surgery. En Medical care of turtles and tortoises, Frankfurt, Edition Chimaira, 2011; 284-288.
- 6.
Mc Arthur S: Anaesthesia, analgesia and euthanasia. En Medicine and Surgery of Tortoises and Turtles, Oxford, Blackwell Publishing 2004; 390-398.
- 7.
Montesinos A, Ardiaca M: Guía terapéutica en animales exóticos. Barcelona, Multimédica ediciones veterinarias, 2017; 17, 54, 179.
- 8.
Carpenter J, Klaphake E, Gibbons P, Sladky K: Reptile formulary. En Mader´s Reptile and Amphibian Medicine and Surgery (third ed), St Louis, Saunders Elsevier, 2019; 1192-1193, 1198, 1200, 1205-1206.
- 9.
Pye GW, Bennett RA: Surgical approaches to the reptiles coelom. En Surgery of exotic animals Hoboken (USA), Wiley Blackwell, 2022: 86-92.
- 10.
Mc Arthur S, Hernandez Divers S: Surgery. En Medicine and Surgery of Tortoises and Turtles , Oxford, Blackwell Publising 2004; 414-429.
- 11.
Divers S, Wüst E: Chelonian Transplastron Coeliotomy. En Mader´s Reptile and Amphibian Medicine and Surgery (third ed), St Louis, Saunders Elsevier, 2019;1057-1061
- 12.
Knotek Z, Wilkinson SL: Surgery. En Reptile Medicine and Surgery in Clinical Practice, Oxford, Wiley Blackwell, 2018; 388-391.
- 13.
Divers SJ: Surgery: Principles and Techniques. En: BSAVA Manual of Reptiles (third ed.), England, British Small Animal Veterinary Association, 2019; 221-223 y 311-313.
- 14.
Chitty J, Raftery A: Surgery. En Essentials of Tortoise Medicine and Surgery, Oxford, Wiley Blackwell, 2013; 135-139 y 143-148.
- 15.
Mehler SJ, Bennett RA: Reptiles soft tissue surgery. En Surgery of exotic animals. Hoboken (USA), Wiley Blackwell, 2022; 108-110.
- 16.
Mc Arthur S, Wilkinson R, Barrows M: Tortugas terrestres y acuáticas. En Manual de animales exóticos, cuarta edición, Barcelona, Ed. S 2007; 311-313.
- 17.
De Voe R: Gastrointestinal tract. En Mader´s Reptile and Amphibian Medicine and Surgery (third ed), St Louis, Saunders Elsevier, 2019; 1069.
- 18.
Mc Arthur S, Machin R: Gastroenterolgy-Cloaca. En Mader´s Reptile and Amphibian Medicine and Surgery (third ed), St Louis, Saunders Elsevier, 2019; 775-777.
- 19.
Martínez Silvestre A: Técnicas de diagnóstico y tratamiento en reptiles. En Manual clínico de animales exóticos, Barcelona, Multimédica ediciones veterinarias, 2009; 298-302.
- 20.
Valls X, Verges J: Casos clínicos de animales exóticos, Zaragoza, Servet ed., 2012; 155-170.