Utilidad del hemocultivo en el diagnóstico y el tratamiento antimicrobiano de la septicemia en quelonios
Usefulness of blood culture in the diagnosis and antimicrobial treatment of sepsis in chelonians
O. Miñana-Morant, A. Moya-Vázquez
Contacto: oscarvet68@gmail.com
Resumen
La septicemia en quelonios constituye un proceso grave y relativamente frecuente. Los signos son inespecíficos en la mayoría de los casos y resulta fundamental la realización de pruebas diagnósticas complementarias, incluyendo hemocultivo. Se seleccionaron 31 casos clínicos de quelonios (terrestres y semiacuáticos) sospechosos de padecer septicemia y se realizó hemocultivo en todos ellos, obteniendo los resultados de sensibilidad antimicrobiana de las bacterias aisladas. Dichos resultados permitieron establecer las bacterias aisladas con más frecuencia en ambos grupos de quelonios y los antibióticos más efectivos frente a las mismas
Palabras clave: hemocultivo, septicemia, quelonios, antibióticos.
Clin Vet Peq Anim 2025, 45 (4): 265-276
Summary
Sepsis in chelonians is a serious and relatively common condition. The signs are nonspecific in most cases, and it is essential to perform complementary diagnostic tests, including blood cultures. Thirty-one clinical cases of chelonians (terrestrial and semi-aquatic) suspected of having sepsis were selected, and blood cultures were performed on all of them, obtaining the antimicrobial susceptibility results of the isolated bacteria. These results allowed the identification of the most frequently isolated bacteria in both groups of chelonians, as well as the most effective antibiotics against them.
Keywords: blood culture, sepsis, chelonians, antibiotics.
Clin Vet Peq Anim 2025, 45 (4): 265-276

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
El sistema inmunitario de los reptiles se caracteriza por una respuesta innata fuerte y amplia, y una respuesta adaptativa moderada. Al tratarse de animales ectotermos, esta última respuesta se ve afectada enormemente por factores externos, principalmente la temperatura. El estado inmunitario de los reptiles en cautividad presenta una elevada dependencia de las condiciones de mantenimiento, tales como luz, temperatura, humedad, alimentación o higiene. Por ello, condiciones deficientes se relacionan con alteraciones del sistema inmunitario que pueden desembocar en la aparición de procesos patológicos diversos.1
La septicemia es un proceso ampliamente documentado en reptiles y constituye una causa común de muerte. La afectación sistémica suele darse como resultado de situaciones como traumatismos, abscesos, parasitosis intensas o condiciones ambientales desfavorables, relacionadas con inmunosupresión. Los signos clínicos son, por lo general, inespecíficos y en muchas ocasiones se observa el fallecimiento repentino del animal. Los reptiles con septicemia pueden desarrollar petequias, equimosis y hematomas en piel y mucosas, así como enrojecimiento del plastrón (quelonios).2-4
En el presente artículo se realiza un estudio retrospectivo de casos clínicos en quelonios (terrestres y semiacuáticos) sospechosos de padecer septicemia, en los cuales se realizó hemocultivo y antibiograma (en caso de proceder).
Material y métodos
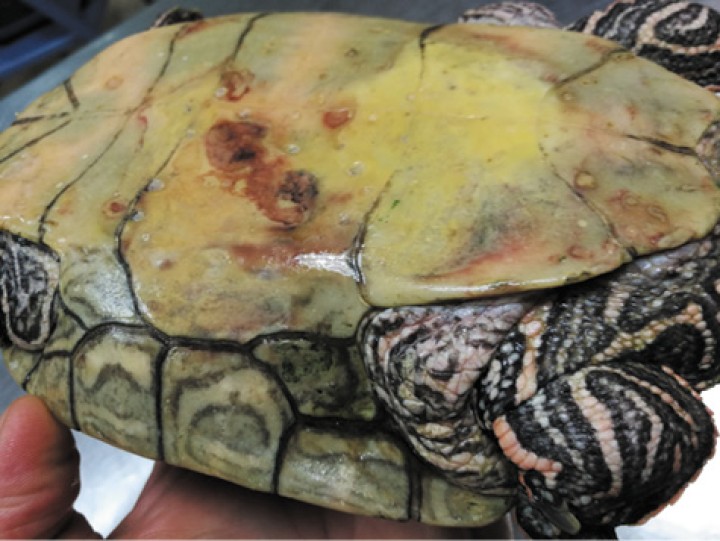
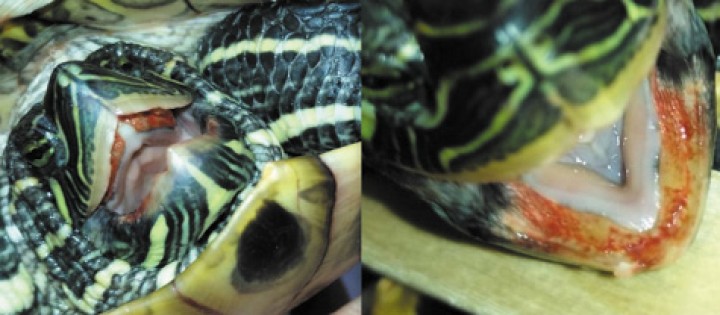
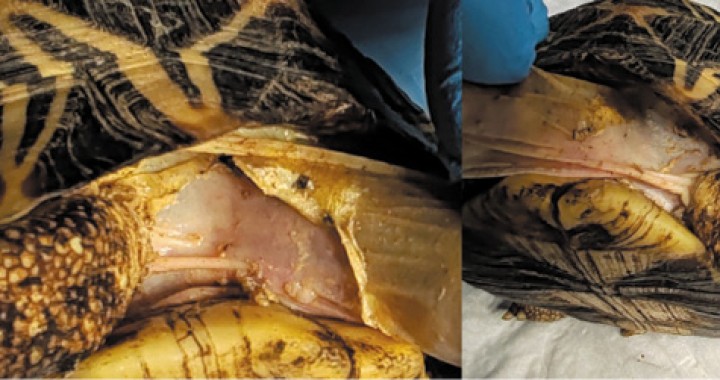
Se evaluaron quelonios (distintas especies, edades y sexos), tanto terrestres como semiacuáticos, atendidos en consulta en la práctica clínica diaria con síntomas compatibles con septicemia. Se consideraron sospechosos aquellos animales que presentaban inactividad, letargo y/o anorexia/hiporexia y, además, alguna de las siguientes condiciones: úlceras o heridas en la piel o plastrón, eritema y/o petequias (Figs. 1-7); heterofilia y/o monocitosis o signos de toxicidad en leucocitos; o presencia de un gran número de bacterias en la citología de las lesiones de la piel. También se tuvieron en cuenta los casos donde se produjo la muerte súbita de algún compañero de habitáculo.
Figura 1
Eritema y úlceras en plastrón causadas por Delftia acidovorans en Graptemys pseudogeographica.
Figura 2
Úlceras en plastrón y osteomielitis causadas por Aeromonas hydrophila en Trachemys scripta.
Figura 3
Petequias en mucosa oral causadas por Pseudomonas fluorescens en Trachemys scripta.
Figura 4
Petequias en piel causadas por Moraxella osloensis en Emydura subglobosa.
Figura 5
Úlceras en piel causadas por Aeromonas caviae en Graptemys pseudogeographica.
Figura 6
Eritema y desprendimiento de piel causados por Micrococcus sp. en Astrochelys radiata.
Figura 7
Eritema de piel causado por Klebsiella oxytoca y Citrobacter braakii en Trachemys scripta.
Se realizaron las pruebas complementarias consideradas necesarias en cada caso en concreto, y en todos ellos se realizó hemocultivo para comprobar la presencia de bacteriemia.
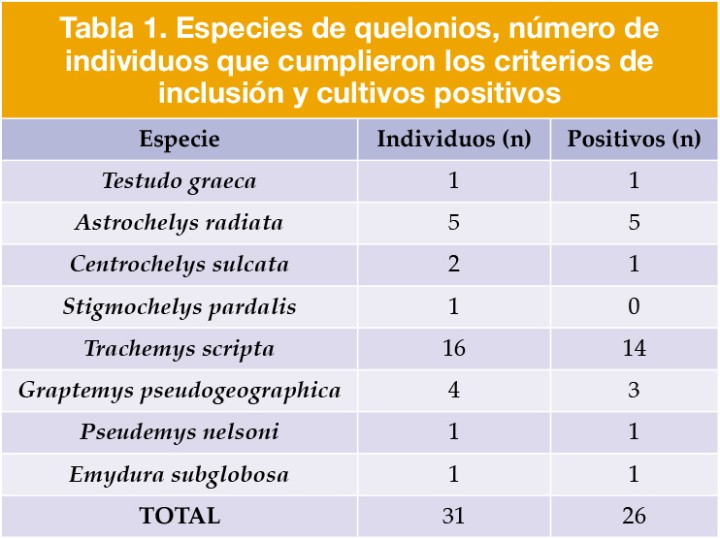
Los casos que cumplieron los criterios de inclusión se reflejan en la Tabla 1.
La extracción de sangre, previa desinfección de la piel con clorhexidina, solución yodada o alcohol al 70 %, se realizó preferentemente de vena yugular, siempre que lo permitiera el tamaño y el carácter del animal. En su defecto se emplearon la vena coccígea dorsal y el seno subcaparacial. En ningún caso fue necesario el uso de sedación o anestesia.
El hemocultivo se realizó mediante inoculación del volumen de sangre extraído (de 1 a 2 ml) en el medio líquido Bact/alert PF Plus® (Fig. 8). Para ello fue necesario una asepsia estricta antes de proceder a la toma de la sangre, retirando la cobertura más externa de la botella sin desenroscar el tapón y desinfectando el tapón de goma con solución yodada o alcohol al 70 %. Se dejó secar 2 minutos para posteriormente inocular el volumen de sangre extraído. Este medio líquido se conservó en refrigeración hasta su envío al laboratorio de referencia para que, en los casos en que los sensores de emulsión de líquidos especializados en la parte inferior de cada frasco de cultivo cambiaban visiblemente de color (por cambio del pH al aumentar el CO2 producido por los microorganismos), se realizara la siembra posterior en agar sangre aerobios, agar sangre anaerobios y agar chocolate.
Figura 8
Medio líquido utilizado para realizar los hemocultivos.
Resultados
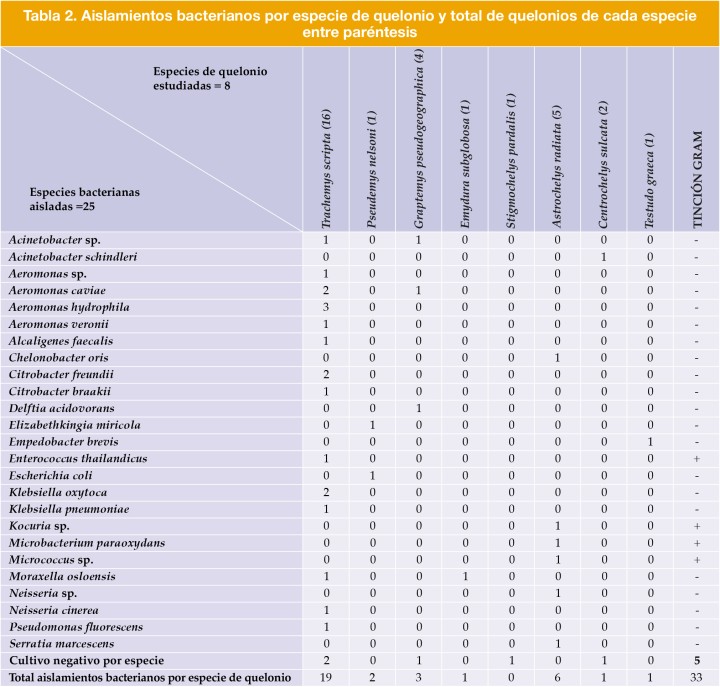
Se realizaron 31 hemocultivos de los cuales 26 fueron positivos. Se identificaron 18 géneros de bacterias con 25 especies distintas, siendo del total el 84,84 % bacterias gramnegativas y el 15,15 % grampositivas (Tabla 2). Cinco cultivos resultaron negativos en distintas especies de tortugas, tanto terrestres como semiacuáticas.
Por lo que respecta al grupo de tortugas según su hábitat, se aislaron el 50 % de bacterias gramnegativas y el 50 % de grampositivas en las tortugas terrestres, mientras que en las tortugas semiacuáticas, el 96 % fueron bacterias gramnegativas frente a un 4 % de grampositivas (Fig. 9).
Figura 9
Porcentaje de bacterias (clasificación Gram) según grupo de tortugas.
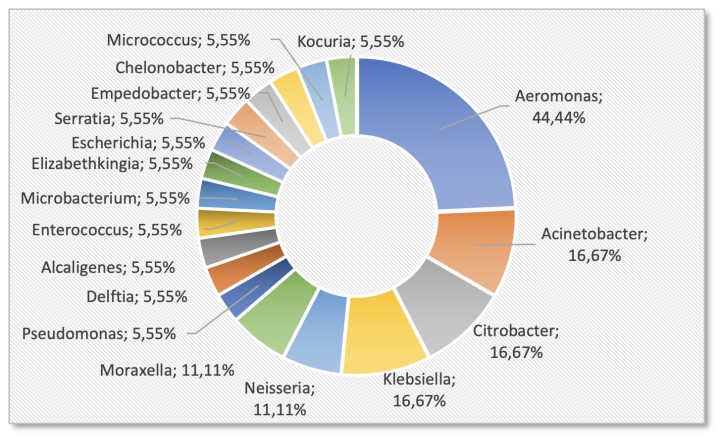
Los géneros de bacterias aislados por orden de frecuencia fueron Aeromonas (8), Acinetobacter (3), Citrobacter (3), Klebsiella (3), Neisseria (2), Moraxella (2) y un único aislamiento de los géneros Pseudomonas, Delftia, Alcaligenes, Enterococcus, Microbacterium, Elizabethkingia, Escherichia, Serratia, Empedobacter, Chelonobacter, Micrococcus y Kocuria (Fig. 10).
Figura 10
Porcentaje de géneros de bacterias aislados.
De los 26 hemocultivos positivos, 19 de ellos incluyeron una única especie de bacteria. En los 7 restantes se identificaron asociaciones mixtas de 2 especies de bacterias: Citrobacter freundii + Enterococcus thailandicus; Citrobacter braakii + Klebsiella oxytoca; Klebsiella oxytoca + Aeromonas hydrophila; Klebsiella pneumoniae + Aeromonas hydrophila; Neisseria cinerea + Moraxella osloensis; Neisseria sp. + Chelonobacter oris y Elizabethkingia miricola + Escherichia coli.
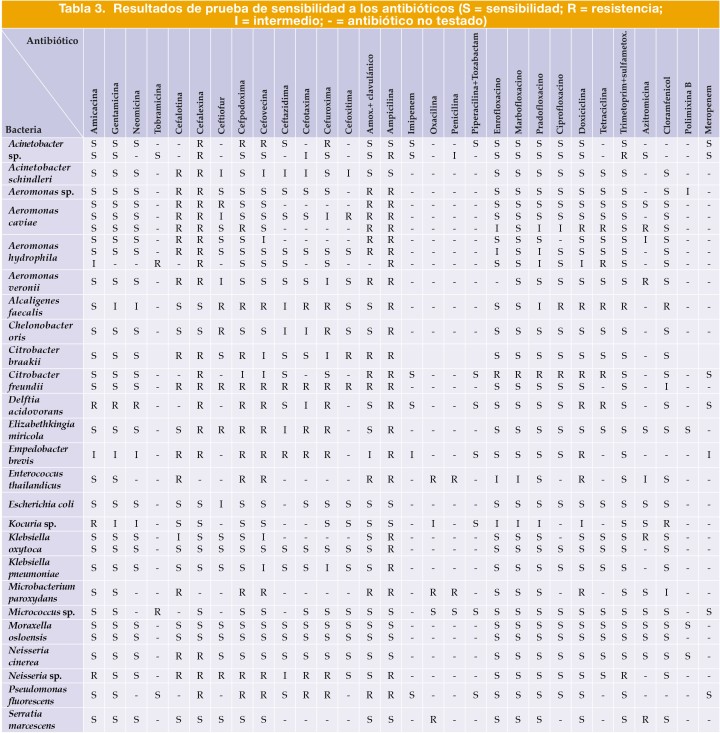
Tras el aislamiento bacteriano se realizaron las pruebas de sensibilidad a los antibióticos, con los resultados que se muestran en la Tabla 3.
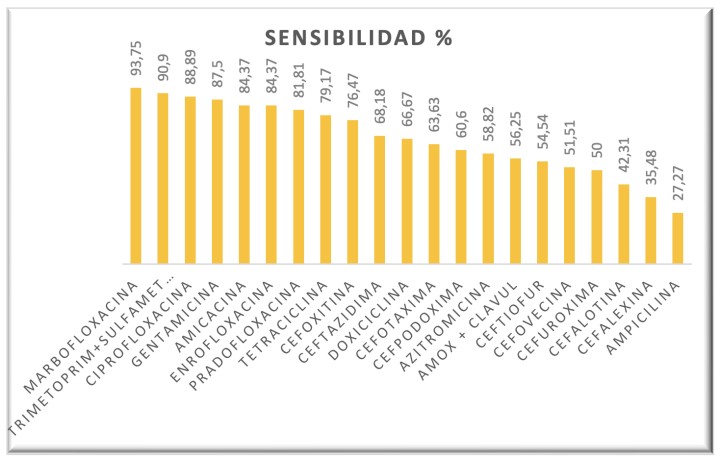
Se comprobó que, en general, la familia de las fluoroquinolonas, seguida de las sulfamidas potenciadas y aminoglucósidos, fueron los que mayor eficacia demostraron in vitro en este estudio (Fig. 11).
Figura 11
Porcentaje de sensibilidad de las bacterias a los antibióticos en el total de quelonios.
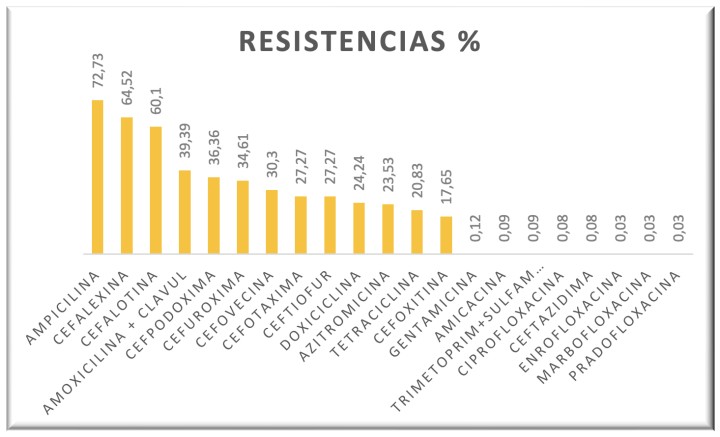
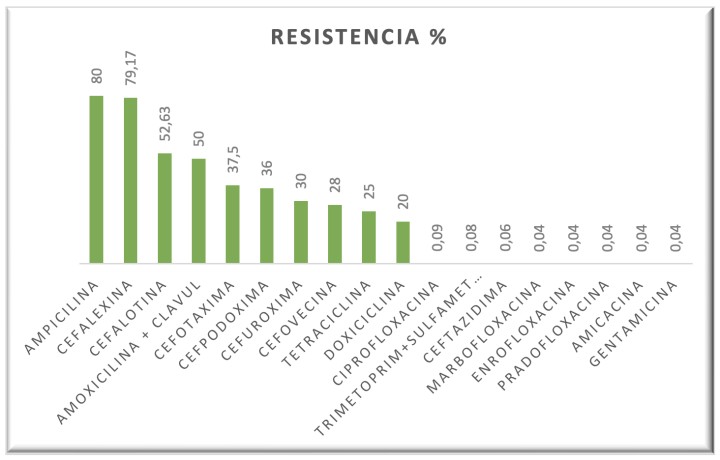
Las bacterias mostraron, en general, mayor resistencia a las penicilinas y cefalosporinas (excepto ceftazidima), tetraciclinas y macrólidos, habiendo muy pocas resistencias a fluoroquinolonas, aminoglucósidos y ceftazidima (Fig. 12).
Figura 12
Porcentaje de resistencia de las bacterias a los antibióticos en el total de quelonios.
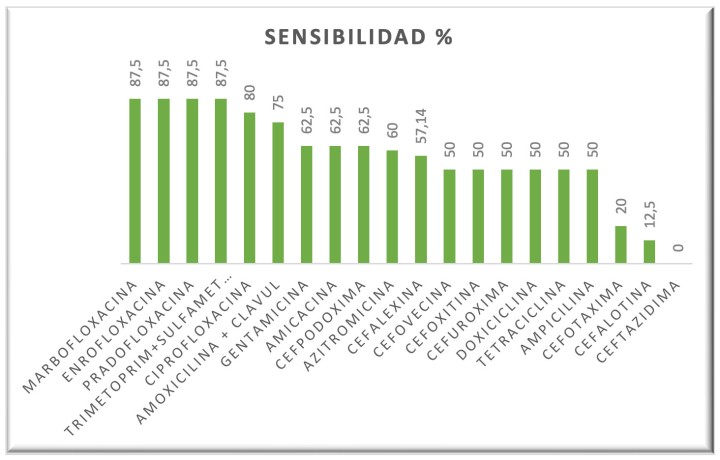
Los antibióticos más eficaces in vitro en tortugas terrestres (Fig. 13) fueron quinolonas y sulfametoxazol/trimetoprim, seguido de la combinación amoxicilina/ácido clavulánico. Los aminoglucósidos y cefalosporinas resultaron ser poco efectivos. Ninguna cepa bacteriana fue sensible a ceftazidima, si bien esta se testó en muy pocos casos en este grupo. En este mismo grupo de tortugas, las bacterias mostraron mayor resistencia a las cefalosporinas y ampicilina, habiendo pocas resistencias a sulfametoxazol/trimetoprim, amoxicilina/clavulánico y fluoroquinolonas (Fig. 14).
Figura 13
Porcentaje de sensibilidad de las bacterias a los antibióticos en quelonios terrestres.
Figura 14
Porcentaje de resistencia de las bacterias a los antibióticos en quelonios terrestres.
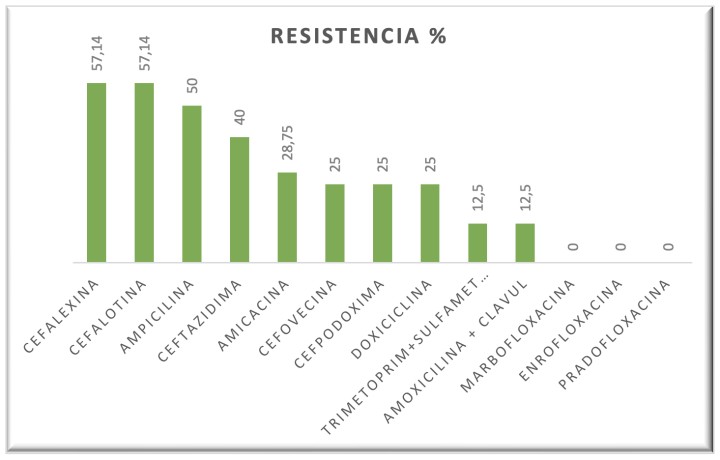
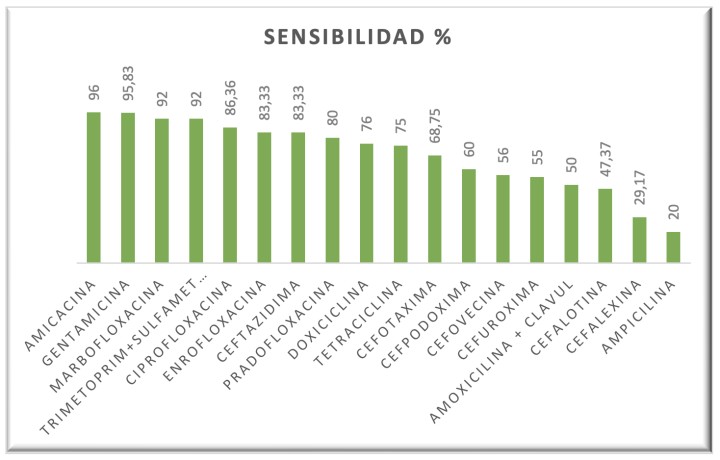
En tortugas semiacuáticas, los antibióticos más eficaces fueron aminoglucósidos, sulfametoxazol/trimetoprim y fluoroquinolonas (Fig. 15). Las cefalosporinas resultaron menos eficaces, con la excepción de la ceftazidima. Las tetraciclinas demostraron una eficacia bastante significativa. En este grupo de tortugas, los resultados demostraron mayor resistencia a penicilinas y cefalosporinas (excepto ceftazidima) y prácticamente ninguna a sulfametoxazol/trimetoprim, ceftazidima, fluoroquinolonas y aminoglucósidos (Fig. 16).
Figura 15
Porcentaje de sensibilidad de las bacterias a los antibióticos en quelonios semiacuáticos.
Figura 16
Porcentaje de resistencia de las bacterias a los antibióticos en quelonios semiacuáticos.
Tres aislamientos bacterianos del estudio cumplieron los criterios de categorización de bacterias multirresistentes (MDR), según la terminología internacional estandarizada de multirresistencia (MDR, multidrug-resistant), resistencia extendida (EDR, extensively drug-resistant) y panrresistencia (PDR, pandrug-resistant),5 y aplicando las tablas publicadas por el Clinical and Laboratory Standards Institute (CLSI).6 Dichas cepas son las dos correspondientes a Citrobacter freundii y la cepa de Citrobacter braakii.
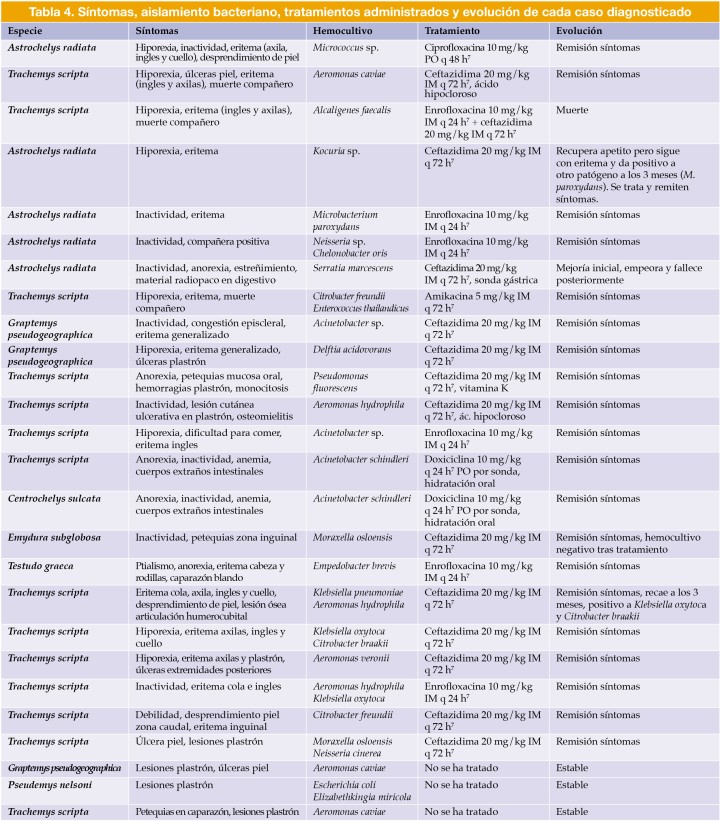
La tasa de supervivencia obtenida en el presente estudio fue del 90,9 % (Tabla 4).7
Discusión
Aunque la bacteriemia, la septicemia y el shock séptico son entidades distintas, pueden considerarse fases de un mismo proceso patológico. La bacteriemia, en sentido estricto, se refiere a la presencia de bacterias viables en la sangre; en la mayoría de ocasiones no suele asociarse a signos clínicos y el sistema inmune es capaz de eliminar dichas bacterias. Sin embargo, cuando los mecanismos de respuesta inmunitaria fallan o se ven superados, la bacteriemia se convierte en una infección del torrente sanguíneo que puede evolucionar hacia muchos espectros clínicos y se diferencia como septicemia.8,9 Con frecuencia la reacción inflamatoria que se produce causa anormalidades circulatorias, celulares y metabólicas graves, que afectan a órganos como riñones, corazón y pulmones (shock séptico), lo que da lugar a un síndrome de disfunción multiorgánica (MODS). Este shock se asocia con una mayor tasa de mortalidad que una septicemia por sí sola.
La septicemia es un fenómeno común en cualquier quelonio inmunocomprometido. Son especialmente susceptibles las tortugas semiacuáticas mantenidas en condiciones subóptimas (agua de mala calidad, higiene deficiente, por debajo de la temperatura zonal óptima) o con heridas abiertas y lesiones no tratadas. Las infecciones víricas también pueden causar inmunosupresión. Las bacterias pueden alcanzar el torrente sanguíneo por lesiones en piel, translocación desde el sistema digestivo, focos sépticos (p. ej., artritis, nefritis, neumonía) o a partir de catéteres intravenosos o intraóseos.10 Las bacterias involucradas son a menudo gramnegativas,2,11,12 aunque como podemos observar en este estudio, se ha identificado un porcentaje significativo de bacterias grampositivas en tortugas terrestres.
La pared celular de las bacterias gramnegativas contiene lipopolisacáridos (LPS), potentes endotoxinas que constituyen el principal estímulo para la respuesta inflamatoria del huésped y la aparición de septicemia.13 La activación de la cascada inflamatoria por bacterias grampositivas también puede ocurrir en respuesta a los componentes de la pared celular o al ADN bacteriano, aunque en menor medida. La estimulación del sistema inmunitario innato por parte de antígenos da como resultado la producción de citoquinas inflamatorias, que causan un daño tisular extenso de forma secundaria a la liberación de especies reactivas de oxígeno (ROS) y proteasas, entre otros.13 La aparición de depresión cardiovascular, hipertensión pulmonar e hipoxemia arterial son las responsables de la aparición de MODS y muerte. En quelonios, la septicemia y embolismos bacterianos pueden provocar petequias y acúmulo de fluidos debajo de las placas del caparazón.13
Los signos asociados con la septicemia en reptiles son relativamente inespecíficos e incluyen anorexia, debilidad aguda, desprendimiento de la piel, dermatitis ulcerativa cutánea, eritema en piel y plastrón, inyección epiescleral, hemorragias petequiales en las membranas mucosas (sobre todo por bacterias gramnegativas), convulsiones e incluso muerte súbita.2,3,14,15 A pesar de la inespecificidad de los síntomas, se ha constatado que la presencia de petequias en quelonios aparece en el 82 % de los casos de septicemia,16 por lo que se puede considerar un indicativo importante. Estas alteraciones pueden relacionarse tanto con la aparición de desórdenes de la coagulación (CID), como por la invasión directa de la pared vascular por parte de los microorganismos (embolismo).17,18
En este estudio, la presencia de eritema fue uno de los hallazgos más comunes. Conviene subrayar que muchas tortugas juveniles acuáticas de agua dulce poseen coloraciones aposemáticas rojizas del plastrón, que se desvanecen con la edad y que no deben confundirse con eritema.19
El diagnóstico de septicemia en quelonios requiere pruebas diagnósticas complementarias a la realización de hemocultivo, tales como analítica sanguínea (hematología y panel bioquímico). Se deben realizar radiografías ante sospecha de osteomielitis, así como cultivo y antibiograma de cualquier lesión cutánea u oral que lo requiera.3
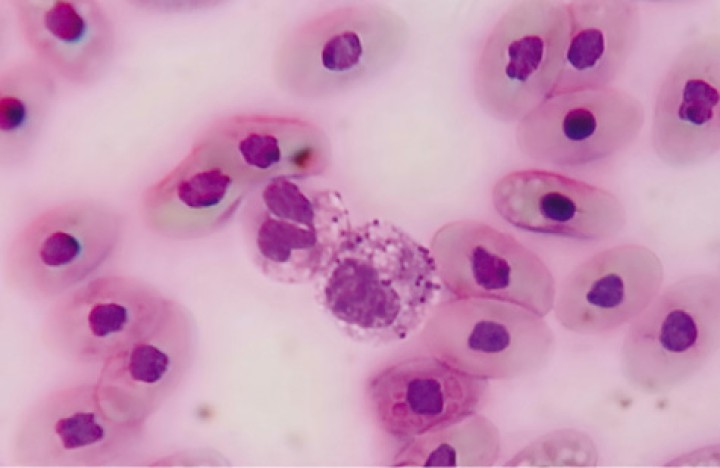
Las citologías de lesiones (en caso de haberlas) pueden ser de gran utilidad en la orientación de casos sospechosos. La presencia de un gran número de bacterias puede ser indicativo de la existencia de septicemia. Resulta interesante realizar tinción de Gram. El frotis sanguíneo puede revelar toxicidad en los leucocitos (Fig. 17), a veces con presencia de bacterias. Tales hallazgos justificarían la administración de una terapia rápida agresiva (antibióticos y tratamiento de soporte).2,14
Figura 17
Frotis sanguíneo de Trachemys scripta con presencia de heterófilos tóxicos. Tinción diff-quick 100 x.
En medicina humana se ha demostrado que el frotis sanguíneo tiene una sensibilidad de entre el 80-90 % y una especificidad de hasta el 96 % para la detección de bacteriemias.15,20 En reptiles, existen muy pocos artículos publicados en los cuales se reporte el uso de esa técnica y, por tanto, resulta complicado determinar la eficacia en la detección de bacteriemia. Un estudio realizado con 28 frotis sanguíneos de Trachemys sp. no permitió evaluar la sensibilidad y la especificidad de la prueba. Por ello, no es posible descartar una bacteriemia basándose únicamente en un frotis sanguíneo.21 En cualquier caso, podría resultar de utilidad el realizar frotis sanguíneos utilizando la capa flogística, si bien la cantidad de muestra necesaria podría ser un factor limitante.21
El hemocultivo es el método que confirma el diagnóstico de septicemia en los casos con historia y signos clínicos compatibles, y siempre debe realizarse previamente a la administración de antibióticos.22 Pese a ello, es una herramienta de diagnóstico probablemente infrautilizada en reptiles.11,16
Se consideró importante utilizar parámetros de inclusión razonables para definir los casos “sospechosos de sepsis”, tanto por la frecuencia con que se pueden dar estos casos como por la baja tasa de supervivencia descrita en algunos textos.16 El reconocimiento precoz de un estado séptico lleva a una administración temprana de antibióticos16 y tratamiento de soporte, lo que conduce a una mayor tasa de supervivencia.
El principal factor limitante para la realización de hemocultivo es la obtención en condiciones asépticas de un volumen suficiente de sangre. Por lo general, se requieren aproximadamente 4 ml de sangre, según el medio que utilicemos. Los ejemplares de pequeño tamaño (Fig. 18) no serán candidatos a la realización de hemocultivo.16
Figura 18
Testudo hermanni con hemorragia subqueratinosa en plastrón. Su peso (15 g) limita la realización del hemocultivo.
Precisamente en estos casos donde se sospecha de septicemia, pero es imposible realizar un hemocultivo, resulta fundamental conocer cuáles suelen ser los antibióticos más efectivos (o la combinación de ellos), para obtener resultados óptimos. Además, administrar el tratamiento más efectivo debería reducir las probabilidades de aparición de resistencias bacterianas.23 En este estudio se ha podido constatar el aislamiento de cepas MDR, lo cual refuerza esta recomendación.
En el presente estudio se describen, con los datos obtenidos, los antibióticos más efectivos en monoterapia, así como las combinaciones más indicadas en los casos donde no se pueda aislar el patógeno o realizar hemocultivo y/o antibiograma.
La bibliografía indica que los antibióticos más utilizados en reptiles son, en general, enrofloxacina, piperacilina y ceftazidima.16 Estos antibióticos son eficaces contra bacterias gramnegativas y grampositivas, y se ha publicado sobre la farmacocinética en algunas especies de reptiles.24-27 Los resultados (in vitro) obtenidos en el presente estudio indican, en el caso de las tortugas semiacuáticas, una mayor sensibilidad a aminoglucósidos, fluoroquinolonas (destacando la marbofloxacina) y trimetoprim/sulfametoxazol (Fig. 15). También se ha comprobado una sensibilidad significativa a las tetraciclinas en este grupo de tortugas. En el caso de las terrestres, teniendo siempre en cuenta que el número de individuos testados ha sido menor, se ha demostrado una mayor sensibilidad a fluoroquinolonas, trimetoprim/sulfametoxazol y betalactamasas (Fig. 13).
Por otra parte, las bacterias aisladas han demostrado una mayor resistencia a penicilinas y cefalosporinas (excepto ceftazidima) en tortugas semiacuáticas (Fig. 16) y a ampicilina y todas las cefalosporinas en tortugas terrestres (Fig. 14).
Según estos resultados, utilizando monoterapia, los antibióticos de elección para tratar la septicemia en quelonios semiacuáticos serían gentamicina, amikacina, trimetoprim/sulfametoxazol, fluoroquinolonas en general (marbofloxacina, enrofloxacina, pradofloxacina, ciprofloxacina) y ceftazidima. En tortugas terrestres, lo serían fluoroquinolonas, trimetoprim/sulfametoxazol y amoxicilina/ácido clavulánico.
Cabe mencionar que el uso de fluoroquinolonas debería restringirse por su clasificación dentro de la categoría B (antibióticos cuyo uso debe restringirse con el objetivo de mitigar el riesgo para la salud humana) por parte de la Agencia Europea de Medicamentos (EMA),28 y utilizarse solo en caso de tener cepas resistentes a los antibióticos de primera elección.
Debe tenerse en cuenta que los reptiles pueden ser portadores asintomáticos de Salmonella enterica,29,30 bacteria con potencial zoonótico y considerada la tercera causa de muerte en humanos a nivel mundial de entre las enfermedades que causan diarrea.31 Debido a la aparición de cepas resistentes a fluoroquinolonas en los seres humanos, así como a la incapacidad de la enrofloxacina para eliminar el microorganismo de forma permanente de los reptiles,16 debería emplearse únicamente en pacientes con hemocultivo cuyo antibiograma justifique su uso. La marbofloxacina es (dentro de las fluoroquinolonas) el antibiótico de elección en este estudio, al haber demostrado mayor sensibilidad. Se describen posibles efectos adversos (vómitos, apatía32) en quelonios acuáticos de los géneros Trachemys y Mauremys, si bien los autores del presente artículo no han observado este hecho.
La combinación trimetoprim/sulfametoxazol es una buena opción antibiótica tanto por la sensibilidad obtenida en los cultivos (87,5 % en tortugas terrestres y 92 % en semiacuáticas), como por su categorización D según la EMA. Sin embargo, deben tenerse en cuenta las limitaciones para administrar el fármaco por vía oral, ya que estudios realizados en Trachemys scripta elegans sugieren una escasa absorción del trimetoprim por esta vía.33 Habría que valorar su uso por vía parenteral.
Los aminoglucósidos también son una buena opción terapéutica en el caso de las tortugas semiacuáticas, por haber demostrado efectividad en un alto porcentaje de casos, por la comodidad de uso (se pueden administrar cada 72-96 horas)7 y por pertenecer a la categoría C. La amikacina es la más utilizada por los autores, por experiencia de uso.
En general, no se han obtenido buenos resultados de sensibilidad con las cefalosporinas, pero habría que considerar positivamente los resultados obtenidos con la ceftazidima en las tortugas semiacuáticas. Las bacterias aisladas en este grupo de quelonios han mostrado sensibilidad en el 83,33 % de los casos. Otros aspectos positivos son la comodidad de uso (puede administrarse cada 3 a 5 días por vía intramuscular), su relativa escasa nefrotoxicidad y un amplio espectro anaeróbico y antipseudomonal específico.3,4,32,34 Como factor negativo cabría mencionar su categorización B (EMA) y, por lo tanto, su uso debería basarse en el resultado de antibiogramas.
Generalmente, no se aconseja combinar antibióticos y es algo que debe evitarse. Siempre debe utilizarse monoterapia si se ha identificado la bacteria, esta es sensible al antibiótico y dicho antibiótico es de eficacia reconocida para la infección en cuestión.35 Por ello, en este estudio solo se ha aplicado monoterapia antibiótica en todos los casos. Aun así, el tratamiento con varios antimicrobianos simultáneamente podría estar indicado en determinadas ocasiones. Entre ellas, deberían considerarse para garantizar una cobertura de amplio espectro donde se desconoce el agente causal, tratar las infecciones polimicrobianas con diferentes sensibilidades (en este estudio se han dado 7 casos positivos con 2 patógenos conjuntos), intentar reducir la toxicidad de un determinado fármaco y/u obtener sinergismo antibacteriano para conseguir mejores respuestas al tratamiento.23,35
En caso de infecciones graves como las causantes de septicemia, el tratamiento antibiótico debe iniciarse lo antes posible y esto ocurre, por lo general, antes de conocer el agente etiológico causal y las posibles sensibilidades del mismo. Esto implica, por tanto, la implementación temprana de una antibioterapia empírica de amplio espectro,23 a la espera de los resultados del hemocultivo y antibiograma. Esta estrategia contribuye a una cobertura inicial adecuada, a la vez que evita el uso de antibióticos innecesarios a largo plazo, lo que minimiza los problemas con las resistencias.36
El uso de un antibiótico de amplio espectro ante la sospecha de septicemia no debería eximir al veterinario de buscar el agente causal; debe recomendarse de forma encarecida la realización sistemática de hemocultivos que permitan asegurar la efectividad de los tratamientos antibióticos establecidos. Además, la legislación vigente (RD 666/2023) obliga a la identificación del agente causal y la realización de pruebas de sensibilidad cuando se emplean antibióticos dentro de la categoría B (EMA). El tratamiento inicial con antibióticos de amplio espectro o combinación de ellos debe ser corto y reajustarse en función de los resultados a un espectro más reducido. Usados de forma errónea, los antibióticos de amplio espectro tienen más probabilidades de fomentar la selección y propagación de resistencias en la flora normal del huésped. Además, el uso de antibióticos de espectro reducido limita el impacto del tratamiento antibiótico sobre las bacterias de la flora normal y actúa sobre las que va dirigido.23
El uso habitual de los antibióticos de amplio espectro se debe probablemente a la percepción de que son más eficaces y, en ocasiones, a la incertidumbre del diagnóstico.37 Sin embargo, no existe un único antibiótico de amplio espectro (o combinación de ellos) que sea eficaz contra todas las bacterias.38
En el presente estudio los antibióticos que han resultado ser más eficaces pertenecen a los considerados de espectro intermedio y de amplio y muy amplio espectro. Estos fueron los aminoglucósidos (considerados de espectro intermedio), la combinación sulfametoxazol + trimetoprim (considerados de amplio espectro) y las fluoroquinolonas y ceftazidima (cefalosporina de tercera generación), consideradas de muy amplio espectro. En la clínica diaria, debido a la dificultad que supone la administración de fármacos en quelonios y a la urgencia de inicio de antibioterapia en casos de septicemia, estaría indicado el tratamiento inicial con ceftazidima (administrable cada 72-120 horas)27,34 o marbofloxacina (cada 24 horas),39 siempre y cuando se realice previamente una toma de muestra para hemocultivo.
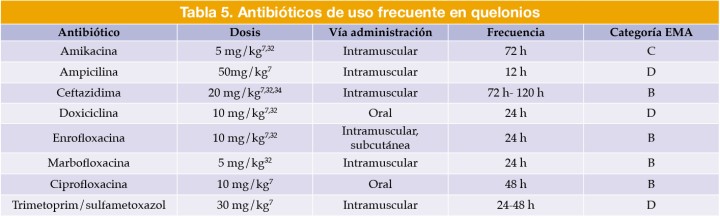
En la Tabla 5 se indican las dosis y la vía de administración de los antibióticos de uso frecuente en quelonios.
Conclusión
Debido a la inespecificidad de los síntomas en la mayoría de los casos de septicemia en quelonios, resulta importante establecer parámetros de inclusión razonables para considerar los casos “sospechosos de sepsis”.
Los hemocultivos deben considerarse una herramienta diagnóstica fundamental en casos de septicemia y de suma importancia a la hora de establecer tratamientos antibióticos adecuados. Por tanto, deberían realizarse de forma sistemática en quelonios sospechosos de septicemia.
En casos de bacteriemia o de septicemia (casos leves), debe considerarse la administración de antibióticos basados en los resultados de hemocultivo previo.
En casos graves, el establecimiento temprano de antibioterapia de amplio espectro a la espera de resultados de sensibilidad (y su posterior modificación en caso necesario) conduce a una mayor tasa de supervivencia y a un uso racional de antimicrobianos.
Usando monoterapia, los antibióticos más efectivos en este estudio según los resultados de los antibiogramas fueron, para las tortugas terrestres, las fluoroquinolonas, sulfametoxazol/trimetoprim y amoxicilina/ác. clavulánico y, para las tortugas semiacuáticas, los aminoglucósidos, la marbofloxacina y sultametoxazol/trimetoprim.
Agradecimientos
Agradecer a la Dra. Cecilia Ishida y a su equipo del Laboratorio de Farmacoepidemiología de la Facultad de Medicina y Ciencias Biomédicas de la Universidad Autónoma de Chihuahua (México) por el asesoramiento sobre los criterios de categorización de las cepas multirresistentes.
Fuente de financiación: este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Martínez A, Marco A, Mateu E. Septicemia por Pseudomonas fluorescens en una iguana común. Clínica Veterinaria de Pequeños Animales 1994; 14 (l): 27-30.
- 2.
McArthur S, Wilkinson R, Meyer J. Medicine and Surgery of Tortoises and Turtles. Blackwell Publishing, Oxford 2004: 91, 366-367.
- 3.
Kumar M, Strunk A. Reptile Critical Care and Common Emergencies. Vet Clin Exot Anim 2016; 19(2): 591-612.
[PubMed] - 4.
Wellehan J. Reptile medicine for the emergency clinician things that slither in the night. Proceedings: The North American Veterinary Conference, Orlando- Florida, 2005: 1310-1311.
- 5.
Magiorakos AP, Srinivasan A, Carey RB et col. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clin Microbiol Infect 2012; 18: 268-281.
[PubMed] - 6.
Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing. 34th ed. CLSI supplement M100S. Lewis, J.S.: CLSI; 2024. Clinical and Laboratory Standards Institute (CLSI): Performance Standards for Antimicrobial Susceptibility Testing. En Lewis JS (ed): CLSI Supplement M100, 34th ed. Wayne, PA, CLSI, 2024.
- 7.
Carpenter JW. Exotic animal formulary. Fifth edition. Elsevier, St Louis, Missouri, 2018: 127-132.
- 8.
Moreno-Torres V, Pintos I, De la Fuente S. Bacteriemia, sepsis y shock séptico. Programa de Formación Médica Continuada Acreditado 2022; 13(49):2864-2872.
- 9.
Hagel S, Pletz MW, Brunkhorst FM y col. Bacteremia and sepsis. Internist (Berl), 2013; 54(4): 399-407.
[PubMed] - 10.
Baldrey V, Witkowska A. Septicemia / bacteremia in reptiles. Vetlexicon ISSN 2398-2985.
- 11.
Glassman AR, Zachariah TT. Baldrey V, Witkowska A. Septicemia / bacteremia in reptiles. Vetlexicon 2017- 2020. Journal of Zoo and Wildlife Medicine 2024; 54(4): 766-775.
- 12.
Glassman AR, Zachariah TT, Patterson JL, et al. Aerobic blood cultures and comparison to clinical findings of free-ranging green turtles (Chelonia mydas) in East Central Florida. J Zoo Wildl Med 2024; 55(3): 665-672.
[PubMed] - 13.
Wang M, Feng J, Zhou D, Wang J. Bacterial lipopolysaccharide-induced endothelial activation and dysfunction: a new predictive and therapeutic paradigm for sepsis. Eur J Med Res 2023; 28(1): 339.
[PubMed] - 14.
Wellehan J. Reptile medicine for the emergency clinician things that slither in the night. Proceedings: The North American Veterinary Conference, Orlando- Florida, 2005: 1310-1311.
- 15.
Kleiman M. Reynolds J. Schreiner R. Smith J. Allen S. Rapid diagnosis of neonatalbacteremia with acridine orange-stained buffy coat smears. J Pediat 1984; 105(3): 419-421.
[PubMed] - 16.
White SD, Bourdeau P, Bruet V, et al. Reptiles with dermatological lesions: a retrospective study of 301 cases at two university veterinary teaching hospitals (1992-2008). Vet Dermatol 2011; 22(2): 150-161.
[PubMed] - 17.
López A. Alteraciones de la coagulación en la sepsis. Medicina intensiva 2005; 29(3): 166-177.
- 18.
Giustozzi M, Ehrlinder H, Bongiovanni D et al. Coagulopathy and sepsis: Pathophysiology, clinical manifestations and treatment. Blood rev 2021; 50: 100864.
[PubMed] - 19.
Thomas H. Boyer. Differential Diagnoses by Clinical Signs Chelonians in: Divers SJ, Stahl SJ. Mader´s Reptile and amphibian Medicine and Surgery, Elsevier, 2019: 1266.
- 20.
Kite P, Dobbins B, Wilcox M, McHanon M. Rapid diagnosis of central-venous-catheter-related bloodstream infection without catheter removal. Lancet 1999; 354(9189): 1504-1507.
[PubMed] - 21.
Vaillard J, Vásquez Peláez C, Ramos Garduño LA. Uso de frotis sanguíneos para la identificación de bacteremias en tortugas del género Trachemys. Journal of Negative and no Positive Results 2018; 3 (8): 582-592.
- 22.
Martinez-Jimenez D, Hernandez-Divers S J. Emergency care of reptiles. Vet Clin North Am Exotic Anim Pract 2007; 10 (2): 557-585.
[PubMed] - 23.
De Lange K, Vandaele E, et al. Guía para el uso racional de los antimicrobianos. Ceva Santé Animale 2016; 326-329.
- 24.
Maxwell LK, Jacobson ER. Allometric basis of enrofloxacin scaling in green iguanas. J Vet Pharmacol Ther 2008; 31: 9-17.
[PubMed] - 25.
James SB, Calle PP, Raphael BL et al. Comparison of injectable versus oral enrofloxacin pharmokinetics in red-eared slider turtles, Trachemys scripta elegans. Journal of Herpetic Medicine and Surgery 2003; 13(1): 5-10.
- 26.
Hilf M, Swanson D, Wagner R et al. Pharmacokinetics of piperacillin in blood pythons (Python curtus) and in vitro evaluation of efficacy against aerobic gram-negative bacteria. Journal of Zoo and Wildlife Medicine 1991; 22: 199-203.
- 27.
Lawrence K, Muggleton PW, Needham JR. Preliminary study on the use of ceftazidime, a broad spectrum cephalosporin antibiotic, in snakes. Res Vet Sci 1984; 36(1): 16-20.
[PubMed] - 28.
https://www.ema.europa.eu/en/documents/report/infographic-categorisation-antibiotics-use-animals-prudent-and-responsible-use_en.pdf. Consultado 20 enero 2025.
- 29.
Pérez Costa E, Molina Gutiérrez MA, Escosa García L. Los riesgos del empleo de reptiles como animales de compañía. Rev Pediatr Aten Primaria 2015; 17(66): e129-e131.
- 30.
Cabañes Rodríguez D. VISAVET- Centro de Vigilancia Veterinaria, Universidad Complutense de Madrid. https://www.visavet.es/sevemur/2015/10/salmonelosis-en-reptiles/.
- 31.
Mkangara M. Prevention and Control of Human Salmonella enterica Infections: An Implication in Food Safety. Int J Food Sci 2023; 11: 8899596.
[PubMed] - 32.
Montesinos Barceló A, Ardiaca García M et al. Guía de terapéutica en animales exóticos. Multimédica Ediciones Veterinarias, Sant Cugat del Vallés, Barcelona 2017; 54: 179-272.
- 33.
Vree, TB, Vree JB, Kolmer EB, et al. N oxidation, O-demethylation, and excretion of trimethoprim by turtle Pseudemys scripta elegans. Vet Q 1989; 11(2): 125-128.
[PubMed] - 34.
Cerreta AJ, Lewbart GA, Dise DR, Papich MG. Population pharmacokinetics of ceftazidime after a single intramuscular injection in wild turtles. J Vet Pharmacol Ther 2018; 41(4): 495-501.
[PubMed] - 35.
Cordiés Jackson L, Machado Reyes L. Combinaciones de antimicrobianos. Acta Medica 1998; 8(1): 101-104.
- 36.
Kollef M.H. Broad- spectrum antimicrobials and the treatment of serious bacterial infections: getting it right up front. Clin Infect Dis 2008; 47 Supl. 1: S3-13.
[PubMed] - 37.
Mateus A, Brodbelt DC, Barber N, StärkKDC. Qualitative study of factors associated with antimicrobial usage in seven small animal veterinary practices in the UK. Prev Vet Med 2014; 117(1): 68-78.
[PubMed] - 38.
Black DM, Rankin SC, King LG. Antimicrobial therapy and aerobic bacteriologic culture patterns in canine intensive care unit patients: 74 dogs (January-june 2006). J Vet Emerg Crit Care (San Antonio) 2009; 19(5): 489-495.
[PubMed] - 39.
Arvy C, Arvy N, Schneider N et al. La marbofloxacina es efectiva en tortugas. Consulta de Difusión Veterinaria, 101, 2003: 24. Resumen: Marbofloxacina a first line treatement for turtles, presentado en el 46 th BSAVA Annual Congress Birmingham, abril 2003.