Caso clínico de Animales Exóticos
Contacto: cvselvatica@gmail.com
Historia clínica
Se examinó en consulta con carácter de urgencia un conejo (Oryctolagus cuniculus), de raza Belier, macho castrado, de dos años de edad, con hiporexia, ausencia de la producción fecal y comportamiento más agitado de doce horas de evolución. Los propietarios describían que constantemente se tumbaba en el suelo, estiraba las extremidades y se incorporaba de forma súbita, y atribuían este comportamiento a molestias abdominales. Tres meses antes había sido atendido en nuestro centro por un cuadro de hipomotilidad gastrointestinal, de origen desconocido, con buena respuesta al tratamiento.
La dieta se consideró apropiada (80 % de heno, verduras de hoja verde fibrosa 15 % y pienso 5 %) y no se refirió la ingesta de alimentos inapropiados.
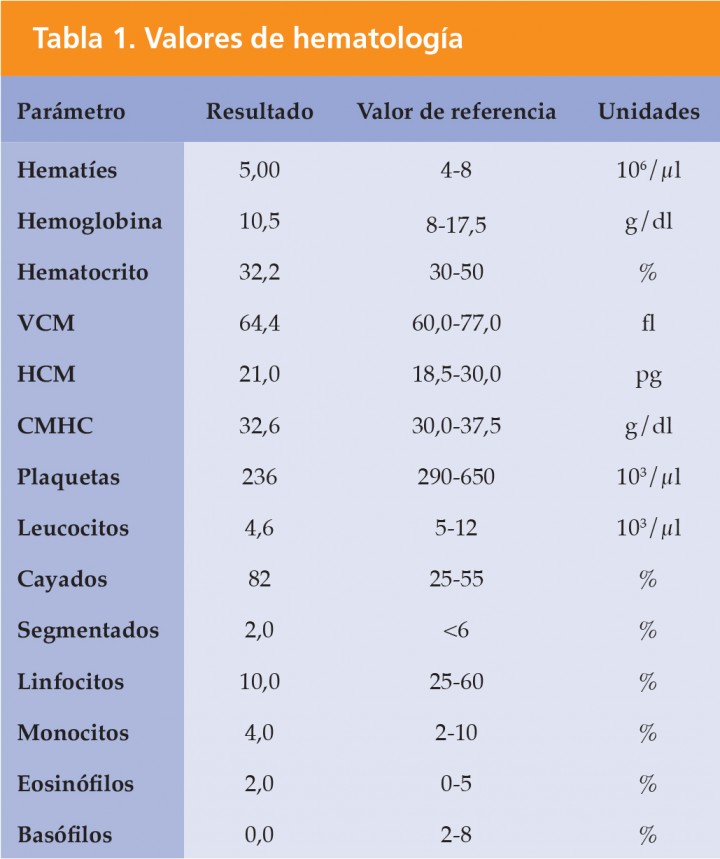
En la exploración general el paciente mostraba una buena condición corporal (3/5), mucosas ligeramente pálidas, taquipnea y dolor a la palpación del abdomen craneal. Presentaba una temperatura rectal de 39,4 ºC. Se extrajo sangre para realizar analítica sanguínea (Tablas 1 y 2).1 En la hematología se observó una ligera leucopenia con neutrofilia madura y linfopenia, y leve trombocitopenia. En el frotis sanguíneo se observaron abundantes policromatófilos. La bioquímica sanguínea, realizada con el analizador Vetscan Vs2 (Vetscan Comprehensive Diagnostic Profile, Abaxis, Union City, CA, EE. UU.), mostraba aumento de ALT y globulinas, leve hipoalbuminemia e hiponatremia.
VCM: volumen corpuscular medio; HCM: hemoglobina corpuscular media; CMHC: concentración de hemoglobina corpuscular media.
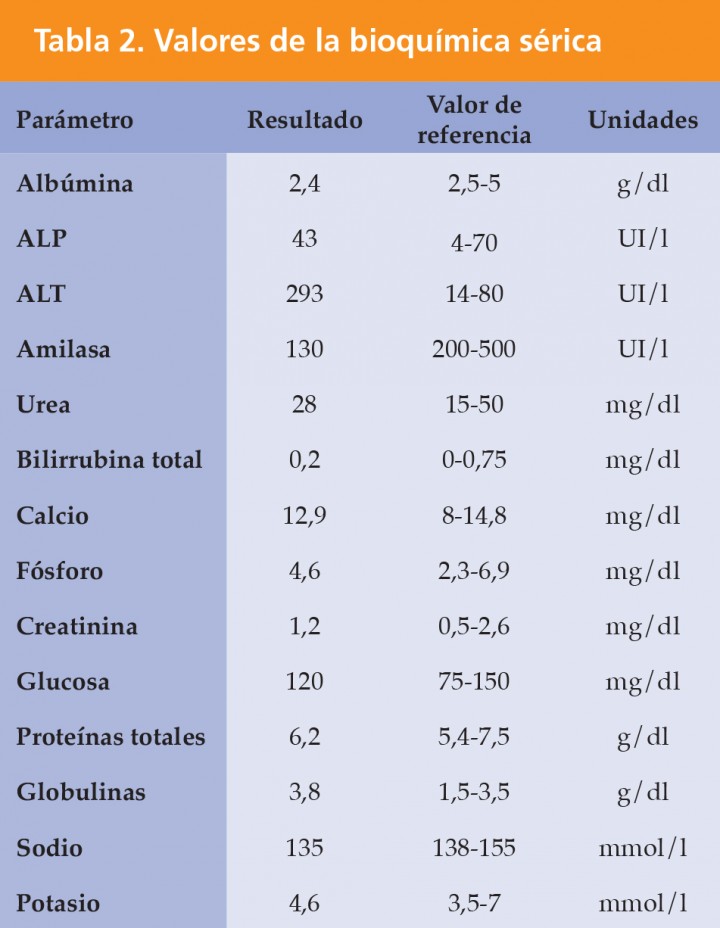
ALT: alanina aminotransferasa; ALP: fosfatasa alcalina.
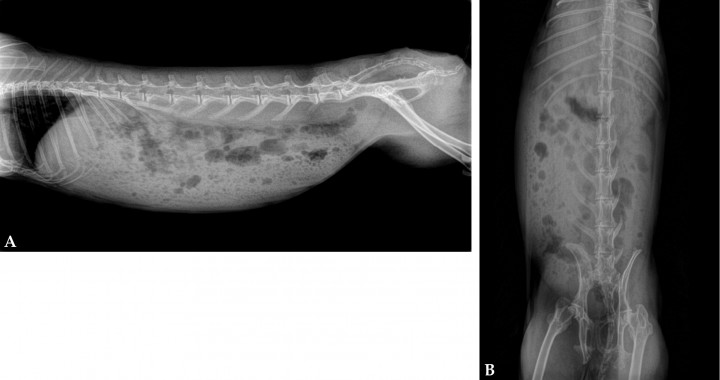
En las radiografías realizadas de la cavidad abdominal (Fig. 1) se apreciaba distensión estomacal con contenido gástrico y gas a nivel intestinal compatible con hipomotilidad gastrointestinal.
Figura 1
Radiografías abdominales. (A) Proyección lateral derecha. (B) Proyección ventrodorsal. Se aprecia distensión gástrica con contenido estomacal, aumento de gas en intestino, ausencia de contenido en su porción más caudal.
En base a las pruebas realizadas y los hallazgos obtenidos, ¿qué diagnósticos diferenciales considerarías?
En este caso la presencia de dolor abdominal, la ausencia en la producción de heces y la reducción en la ingesta en las últimas horas junto con los hallazgos radiográficos son compatibles con un cuadro de hipomotilidad gastrointestinal.
Existen muchas enfermedades que pueden cursar con hipomotilidad gastrointestinal en el conejo. En la mayoría de los casos se debe a dietas inadecuadas, con valores de fibra bruta por debajo de los recomendados, junto con otros factores de manejo como puede ser la restricción de ejercicio o de la ingesta de agua.2
No obstante, animales que reciben una correcta alimentación pueden presentar estasis gastrointestinal de forma secundaria a otras patologías, como puede ser enfermedad dental, dolor, cambios ambientales, infección, enfermedades crónicas, neoplasia, empleo de ciertos medicamentos (anestésicos, anticolinérgicos, opioides y antibióticos con potencial de generar disbiosis/enterotoxemia), obstrucción/cuerpos extraños, pancreatitis y enfermedad hepática (lipidosis, torsión, colangiohepatitis).2,3
En el presente caso el resultado de la bioquímica sanguínea es específico de daño hepatocelular. La presencia de anemia regenerativa leve con trombocitopenia podría indicar la presencia de hemorragia interna. Dichos hallazgos laboratoriales junto con la ausencia de otros signos específicos de enfermedad nos hacen considerar dentro del diferencial la enfermedad hepática como etiología más probable.
¿Qué pruebas complementarias podríamos realizar para alcanzar el diagnóstico definitivo en este caso?
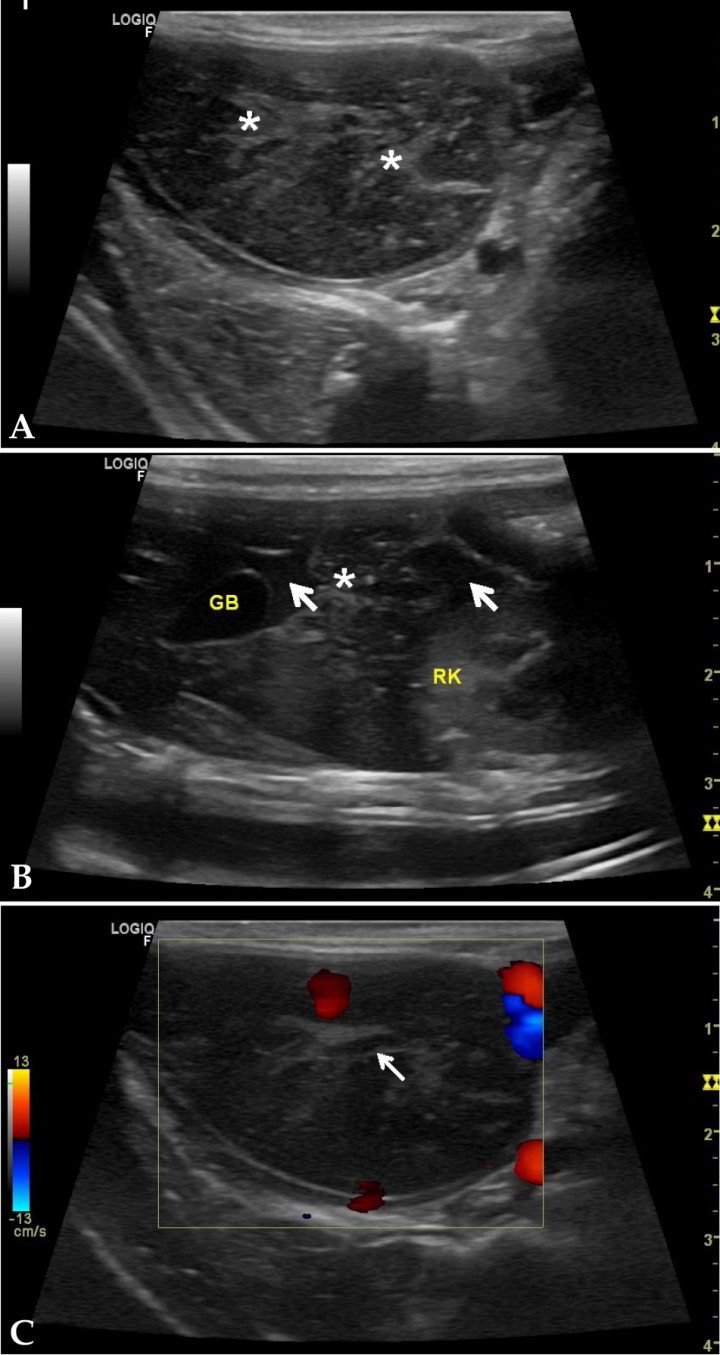
Ante la sospecha de una enfermedad hepática, las pruebas de diagnóstico por imagen, tales como la ecografía, son fundamentales para poder valorar la morfología e integridad del parénquima hepático y de las vías biliares. Se realizó una ecografía abdominal utilizando un transductor lineal de 6-12 MHz (Figs. 2A y 2B), observándose un aumento de tamaño de uno de los lóbulos hepáticos en lado derecho, compatible con el lóbulo caudado, con bordes redondeados y parénquima heterogéneo. Se apreciaba la presencia de líquido anecoico interlobar y aumento de ecogenicidad de grasa mesentérica perihépatica. A través del Doppler color (Fig. 2C) se puso de manifiesto la ausencia del flujo sanguíneo hacia el lóbulo afectado. Con los resultados del estudio ecográfico se sospechó la presencia de un lóbulo hepático torsionado, llegando al diagnóstico presuntivo de torsión de lóbulo hepático (TLH) en este conejo.
Figura 2
Imágenes ecográficas del hígado en cortes longitudinales y parasagitales derechos. (A) Lóbulo hepático de ecogenicidad mixta (asteriscos sobre focos hiperecoicos), bordes redondeados, grasa mesentérica hiperecogénica. (B) Corte sagital a la altura de riñón derecho, presencia de contenido anecoico entre lóbulos (flechas blancas), área hepática con contorno irregular y ecogenicidad mixta (asterisco). (C) Corte longitudinal a nivel del hilio hepático utilizando el Doppler color sobre lóbulo afectado. Nótese ausencia de flujo en vena de paredes ecogénicas, vaso porta (flecha blanca). GB: vesícula biliar; RK: riñón derecho.
En fases incipientes de esta patología, el diagnóstico mediante radiografías y ecografía puede suponer un reto, por lo que la resonancia magnética y la tomografía computarizada pueden ser necesarias para llegar al diagnóstico definitivo.4
¿Qué plan terapéutico instaurarías?
Tras el diagnóstico presuntivo de torsión de lóbulo hepático se recomendó la intervención y resección del lóbulo afectado. Previamente se le proporcionó tratamiento de soporte mediante fluidoterapia con suero salino fisiológico 4 ml/kg/h i.v. (Suero fisiológico Braun Sol.Iny. 0,9%, B.Braun España, Barcelona), ranitidina 2 mg/kg i.v. BID (Zantac, GlaxoSmithKline, Madrid), enrofloxacino 5 mg/kg s.c. BID (Baytril 2,5%, Bayer, Kiel), metoclopramida 0,5 mg/kg i.v. BID (Vomend antiemeticum, Dechra Veterinary Products S.L.U, Barcelona) y buprenorfina 0,03 mg/kg i.m. TID (Buprecare, Divasa Farmavic, Barcelona). El tratamiento conservador no está indicado ante la presencia de tejido necrótico hepático, las alteraciones en equilibrio ácido/base que pueden darse por el cuadro digestivo asociado y el riesgo de hemorragia por ruptura hepática que supone. El diagnóstico precoz y la rápida intervención se correlaciona con un mayor índice de supervivencia en los casos de TLH.4,5,6
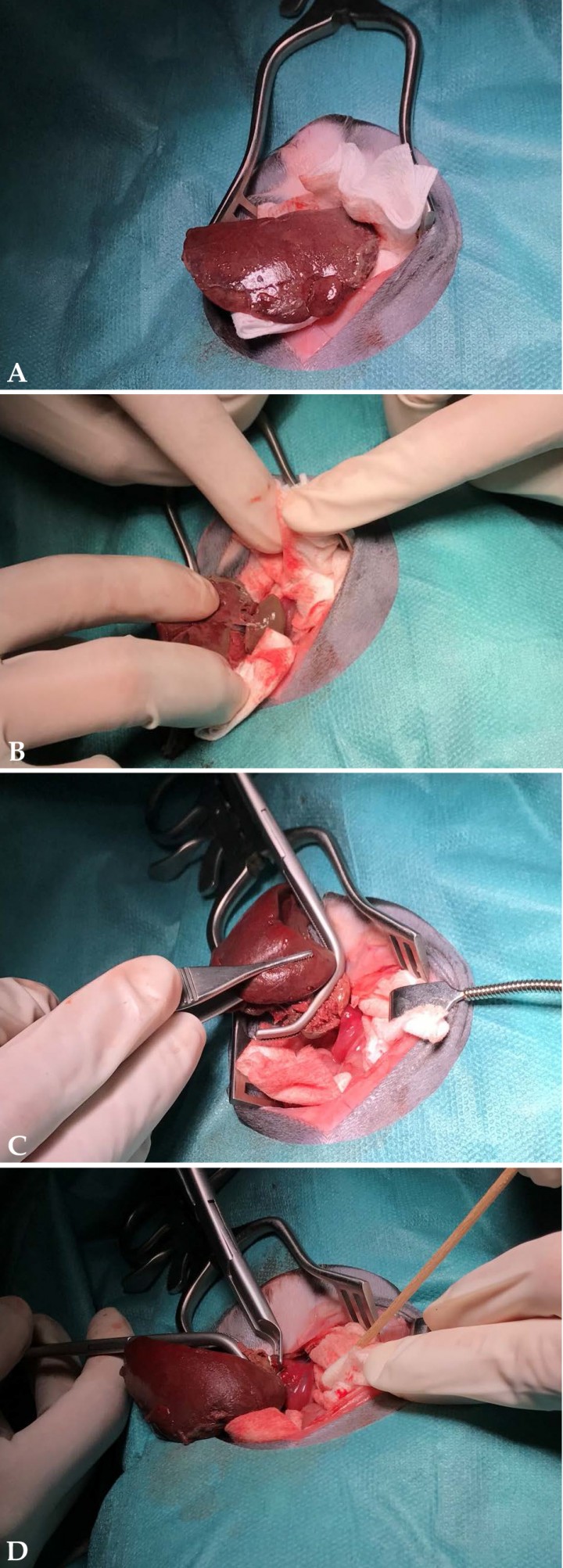
En este caso se realizó la intervención 24 horas tras el diagnóstico mediante abordaje abdominal craneal por la línea media. Se identificó el lóbulo caudado con signos de inflamación, congestión, bordes redondeados, de aspecto necrótico y con una tonalidad marrón mate (Fig. 3A) que lo diferenciaba del resto del parénquima sano. Se apreciaba contenido abdominal de aspecto serohemorrágico, posiblemente como resultado del sangrado hepático y del aumento de la presión hidrostática de los vasos. El lóbulo presentaba un hilio fácilmente reconocible donde se encontraban todos los vasos completamente girados (Fig. 3B) resultando en una estrangulación completa del mismo. Tras la exploración cautelosa del resto del parénquima hepático y con la ayuda de un clamp Satinsky (Fig. 3C), se aplicaron tres clips hemostáticos de 6,2 mm (Fig. 3D) (Hemoclips de titanio Aesculap, B.Braun España, Barcelona) sobre el pedículo vascular y se procedió a la resección del lóbulo afectado (Fig. 4).
Figura 3
Imágenes macroscópicas del lóbulo caudado afectado durante la cirugía. (A) Aspecto del lóbulo caudado durante la cirugía; se aprecia congestión y cambio de coloración del lóbulo torsionado. Presencia de contenido fibrinoso en superficie y aspecto rugoso. (B) Visualización del hilio vascular durante la cirugía; se observa el estrangulamiento de los vasos que irrigan el lóbulo afectado. (C) Previa a la ligadura del hilio vascular, los vasos torsionados se aseguran a través de un clamp vascular Satinsky. (D) Ligadura del pedículo vascular con hemoclips de titanio de 6,2 mm; se emplazaron un total de 3 hemoclips.
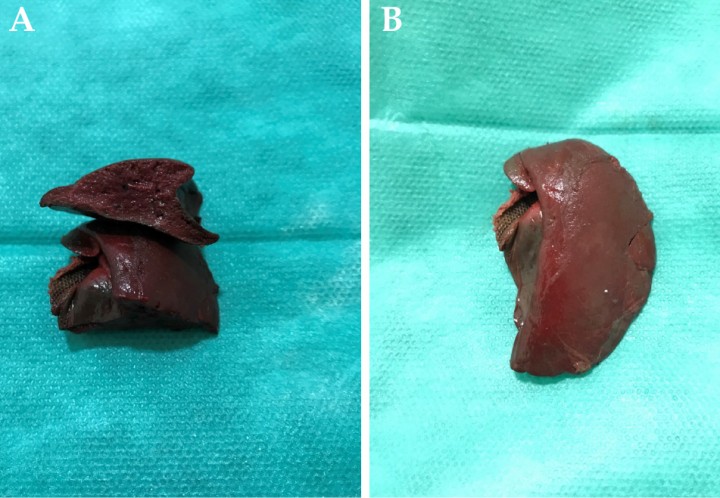
Figura 4
(A y B) Aspecto macroscópico del lóbulo caudado torsionado tras su extracción. Nótese el parénquima hepático de color más mate, superficie rugosa y tejido friable.
Resolver el estrangulamiento vascular y volver a posicionar el lóbulo afectado en su posición anatómica está contraindicado por la posible liberación de toxinas bacterianas, riesgo de embolismo, diseminación bacteriana y posible daño isquémico por reperfusión. 4,6-8
El cierre abdominal se realizó con sutura monofilamento reabsorbible de gliconato (Monosyn 3/0 sutura, B.Braun España, Barcelona). Se remitieron muestras del lóbulo extirpado para cultivo y antibiograma e histopatología.
Dentro de las intervenciones hepáticas, la hemorragia puede suponer un riesgo para la vida del animal, por lo que se disponía de sangre entera heparinizada para realizar una transfusión intraoperatoria. Finalmente, no fue necesaria la transfusión debido al escaso sangrado durante la intervención.
El resultado de la histopatología concluyó la presencia de congestión difusa aguda grave con atrofia hepatocelular por compresión, necrosis hepática coagulativa difusa aguda grave y peritonitis fibrinosa, característica de torsión e infartación de lóbulo hepático.
El cultivo de gérmenes aerobios y anaerobios realizado obtuvo como resultado positivo el crecimiento de Achromobacter xylosoxidans, con resistencia a la mayoría de antibióticos empleados convencionalmente exceptuando el trimetroprim sulfametoxazol.
¿Qué evolución podemos esperar?
La hepatectomía en los casos de TLH presenta generalmente un buen pronóstico. Sin embargo, pueden surgir complicaciones, documentadas en otras especies como el perro, tales como anemia, hemoperitoneo, arritmias o hipoalbuminemia.7
En el presente caso no se produjo ninguna complicación durante la recuperación postoperatoria. A las pocas horas de la cirugía el animal empezó a comer por sí mismo pequeñas cantidades de heno e inició de nuevo las defecaciones. Dado que durante las primeras horas la ingesta no era lo suficiente como para satisfacer sus necesidades calóricas se optó por la colocación de una sonda nasogástrica para poder asistir la alimentación con papilla de cuidados intensivos para herbívoros (Emeraid IC herbivore, Emeraid, Cornell, U.S.A) a 50 ml/kg/día repartida en tres tomas. Se mantuvo hospitalizado con tratamiento de fluidos con salino fisiológico a 4 ml/kg/h i.v. (Suero fisiológico Braun Sol.Iny. 0,9%, B.Braun España, Barcelona), buprenorfina 0,03 mg/kg i.m. TID (Buprecare, Divasa Farmavic, Barcelona), enrofloxacino 5 mg/kg s.c. BID (Baytril 2,5%, Bayer, Kiel) y metronidazol 20 mg/kg i.v. BID (Metronidazol I.V. Braun 5 mg/ml, B. Braun España, Barcelona), ranitidina 2 mg/kg i.v. BID (Zantac, GlaxoSmithKline, Madrid), metoclopramida 0,5 mg/kg i.v. BID (Vomend antiemeticum, Dechra Veterinary Products S.L.U, Barcelona), S-adenosilmetionina 1/4 de comprimido PO SID (Hepatosil, Farmadiet, Barcelona), durante 48 horas. A las 24 y 48 horas tras la cirugía mantenía un valor de microhematocrito y de sólidos totales dentro de la normalidad.
Posteriormente, el animal se envió a casa presentando una evolución favorable hasta el alta definitiva diez días tras la cirugía. Un mes después se realizó una ecografía de control hepático donde no se halló ningún cambio en la silueta, ecogenicidad y arquitectura del parénquima hepático ni de vías biliares. Se realizó también control sanguíneo de hematología y bioquímica sérica, en la que se apreciaba una normalización de la ALT.
Discusión
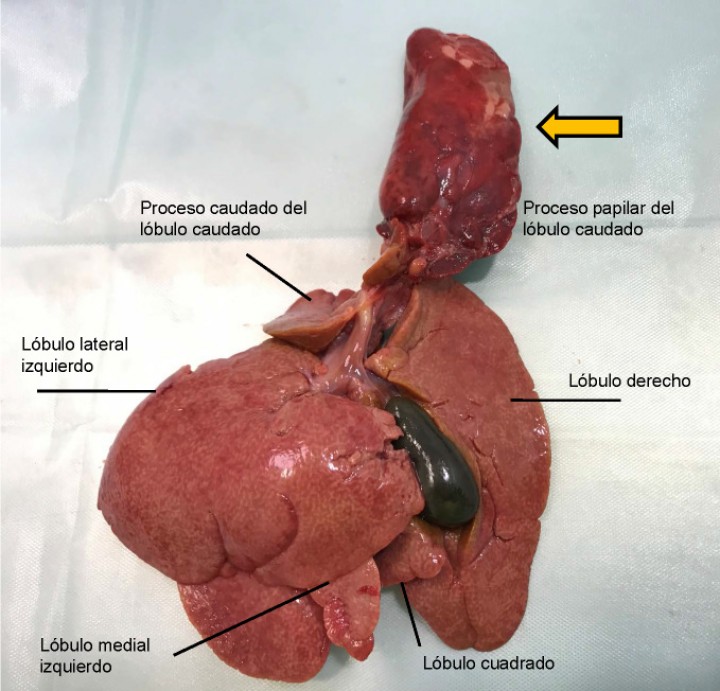
En la revisión bibliográfica sobre los casos de TLH en conejo encontramos disparidad en la descripción anatómica del hígado y la división de sus lóbulos, existiendo mayor controversia en la descripción de lóbulo hepático derecho y sus lóbulos asociados.4,8 En base a la experiencia de los autores y a la descripción que realiza Pignon C. et al en 2013, podemos diferenciar una marcada hendidura que divide el hígado en los lóbulos derecho e izquierdo. El lóbulo izquierdo se divide a su vez en lóbulo izquierdo lateral y medial. El lóbulo derecho presenta el lóbulo cuadrado caudal a la vesícula biliar y el lóbulo caudado, dirigido hacia caudal. Encontramos dos lobulaciones de este lóbulo caudado, consistentes en el proceso caudado y el proceso papilar (Fig. 5).8
Figura 5
Aspecto de la cara visceral de hígado con TLH de lóbulo caudado en un conejo. Se observa la torsión presente en el proceso papilar del lóbulo caudado, desplazado dorsalmente (flecha amarilla). Identificamos lóbulo hepático derecho e izquierdo. Lóbulo derecho: presencia de lóbulo cuadrado caudal a la vesícula y presencia de lóbulo caudado con dos procesos, caudado y papilar.
La torsión de lóbulo hepático es un proceso de rara presentación descrito en diferentes especies, como en perros, gatos, caballos, cerdos, nutrias, ratas, ratones y conejos. De igual modo, ha sido descrito en medicina humana en casos esporádicos.4,7
En el conejo, el lóbulo afectado habitualmente es el lóbulo caudado, siendo supuestamente más propenso al desplazamiento debido a su vinculación con la región hiliar dorsal del hígado.4-6,8 En las torsiones hepáticas que se presentan en el perro, el lóbulo más afectado es el izquierdo.9
Generalmente, la TLH conduce a la oclusión del retorno venoso antes que la oclusión del aporte arterial, lo que provoca congestión aguda del lóbulo afectado con la consecuente necrosis, efusión, hemoabdomen y shock.4,5,7,9
Los signos clínicos de TLH en otras especies pueden ser de carácter agudo o crónico y pueden ser poco específicos, como la letargia o la anorexia, hasta casos más severos como puede ser abdomen agudo, colapso y muerte súbita. Los signos clínicos que se manifiestan más habitualmente en perros y gatos diagnosticados de TLH son dolor abdominal, distensión abdominal, letargia, anorexia, vómitos y diarrea.9
En el conejo, los signos clínicos se relacionan con hipomotilidad gastrointestinal y pueden ser poco específicos. Por lo general, presentan dolor abdominal, letargo, anorexia, disminución de la producción fecal y posición antiálgica, resultando la realización de pruebas diagnósticas, como son el análisis sanguíneo bioquímico y la ecografía abdominal, esenciales para el diagnóstico.
El aumento de bilirrubina sanguínea no se aprecia en perros y gatos con TLH, aunque se ha descrito comúnmente en caballos y esporádicamente en conejos.4,6
En la mayoría de las especies, la información obtenida durante la exploración física es poco específica. La debilidad, la pirexia, el dolor en la palpación abdominal y la distensión abdominal son hallazgos frecuentes en los casos de TLH. La ictericia no se suele presentar en perros y gatos, pero sí ha sido documentada en conejo.4,7
A nivel laboratorial, es frecuente encontrar en el conejo aumento de las enzimas hepáticas (ALT y AST) y, en menor medida, de la fosfatasa alcalina4,8 secundario al daño hepatocelular y la necrosis generada. El aumento de las transaminasas en los casos de TLH es muy significativo.8 En el presente caso solo se pudo relacionar con un aumento de la ALT, manteniéndose los valores de fosfatasa alcalina dentro de la normalidad. Por otro lado, no se determinaron otras enzimas como la aspartato aminotransferasa o glutamil transpeptidasa, siendo éstas de ayuda para la caracterización del daño hepatocelular. Los valores renales, urea y creatinina, pueden presentarse elevados de forma secundaria a la azotemia prerrenal en los conejos que presentan deshidratación y anorexia asociadas a la hipomotilidad gastrointestinal.4 En este caso se apreciaba una ligera hiponatremia no considerándose este valor de relevancia por el método bioquímico empleado en su determinación. La hipoalbuminemia podría ser atribuible al proceso inflamatorio que presentaba junto con la presencia de hemorragia abdominal. No obstante, la determinación bioquímica empleada puede resultar imprecisa para la determinación de albúmina y electrolitos en conejos.
La anemia es un hallazgo frecuente debido a la hemorragia dentro del lóbulo afectado, a la efusión abdominal hemorrágica generada y a la eritrolisis.4,7 Podemos encontrar signos de regeneración como la policromasia y la presencia de glóbulos rojos nucleados. En este caso los valores de hemoglobina y el total de glóbulos rojos se encontraban dentro de los valores de referencia, pero cabe destacar la presencia de abundantes policromatófilos en la evaluación del frotis sanguíneo.
En ocasiones podemos encontrar trombocitopenia y aumento del tiempo de coagulación tras la venopunción. En el presente caso se reflejaba una leve trombocitopenia compatible con el sangrado abdominal. La medición de tiempos de coagulación como el tiempo de protrombina (TP), el tiempo parcial de tromboplastina (TPT) y la tromboelastrografía son de gran utilidad para evaluar la coagulación en estos casos en los que la cirugía se presenta como la mejor opción de tratamiento.4
La neutrofilia presente en este caso puede atribuirse a la inflamación, la congestión y la necrosis hepática.
Las radiografías abdominales realizadas en conejos con TLH muestran anormalidades poco específicas, siendo las alteraciones más constantes la hepatomegalia y la morfología redondeada de los márgenes hepáticos.4,6,8 La presencia de distensión gástrica y gas en estómago e intestino son sugestivos de hipomotilidad gastrointestinal u obstrucción.
Las imágenes ecográficas pueden mostrar un aumento de tamaño del hígado, con bordes redondeados, el parénquima hepático puede ser hipoecoico o de ecogenicidad mixta, siendo la grasa y el mesenterio de alrededor hiperecogénico, y puede apreciarse, también, la presencia de líquido libre anecoico. El empleo del Doppler color y pulsado confirma la disminución o ausencia de flujo sanguíneo hacia el lóbulo afectado.4-8
Los casos descritos en la literatura veterinaria relacionan un mejor pronóstico con el temprano diagnóstico y la pronta realización de hepatectomía del lóbulo afectado.4-9 Por otro lado, en diferentes fuentes, coincidiendo con la experiencia de los autores, se describen casos de TLH en conejo sin tratamiento quirúrgico y con buena progresión con tratamiento médico de soporte,4 aunque las complicaciones graves y la mortalidad se consideran mayores. Estos casos se relacionan, además, con una mayor incidencia de estasis gastrointestinal tras la resolución del cuadro clínico, posiblemente por el dolor generado por la presencia de un lóbulo torsionado o bien por cambios en la laxitud de los ligamentos de soporte.4
La etiología de la TLH es todavía desconocida, aunque se postulan diferentes teorías. En perros se sospecha de la ausencia congénita de uno de los ligamentos hepáticos o la laxitud de los mismos asociada a traumatismos tras episodios previos de dilatación gástrica/vólvulo en razas grandes, en los que se podría ejercer presión sobre los lóbulos hepáticos y generar una sobredistensión o debilitamiento de los ligamentos. Otras etiologías planteadas serían la presencia de masas hepáticas, traumatismos o saltos vigorosos, que pueden generar la ruptura de la cápsula hepática y permitir un mayor rango de movimiento.9 En el perro se postula también como posible origen las alteraciones en la morfología y el tamaño del propio lóbulo hepático tras procesos donde hay una pérdida de la arquitectura del órgano, como neoplasias, infecciones o parasitismo, o bien secundario a hernia diafragmática.7
Los ligamentos hepáticos en el conejo presentan similitud con los que encontramos en la especie canina. La dilatación gástrica en conejo, asociada a procesos de estasis gastrointestinal, podría jugar un papel importante en la distensión del ligamento triangular hepático y predisponer a la torsión hepática, al igual que se describe en el perro.4
En el presente caso, Achromobacter xylosoxidans fue aislado en el cultivo realizado. En el perro, Staphylococcus intermedius, Clostridium sp., Bacilllus sp., Klebsiella pneumoniae, Pasteurella sp. y otros bacilos gramnegativos han sido aislados en las muestras enviadas de TLH.9 Achromobacter xylosoxidans es un bacilo gramnegativo, ubicuo y capaz de sobrevivir en ambientes acuáticos extrahospitalarios e intrahospitalarios. La presentación clínica más habitual es en forma de bacteriemia, aunque también se describen casos de infección de catéteres intravasculares, meningitis, infección de vías biliares, infección del tracto urinario y osteomielitis.10
En este caso no se pudo relacionar la presencia de este microorganismo con la patología presentada.
Como conclusión, la torsión de lóbulo hepático en conejo es de presentación ocasional y cursa con un cuadro poco específico de letargia, anorexia, dolor abdominal, nerviosismo y disminución en la producción de heces, junto con anemia y aumento de transaminasas hepáticas. Es por ello que en estos casos se recomienda la realización del estudio ecográfico abdominal para poder acercarnos al diagnóstico. Otras pruebas de diagnóstico por imagen como la resonancia magnética y la tomografía axial pueden ser más sensibles en fases incipientes. El diagnóstico precoz junto con la intervención quirúrgica son el protocolo recomendado para los casos de torsión de lóbulo hepático en el conejo.
Fuente de financiación: este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Morrisey JK. Hematologic and Biochemical Values of Ferrets. En Carpenter JW y Marion CJ (ed): Exotic animal formulary. 4rd edition, Missouri, Elsevier Saunders, 2013;582-583.
- 2.
DeCubellis J, Graham J. Gastrointestinal Disease in Guinea Pigs and Rabbits. Vet Clin North Am Exot Anim Pract 2013; 16(2):421-435.
[PubMed] - 3.
Lichtenberger M, Lennox A. Updates and Advanced Therapies for Gastrointestinal Stasis in Rabbits. Vet Clin North Am Exot Anim Pract 2010; 13:525-541.
[PubMed] - 4.
Graham JE, Orcutt JC, Casale SA, et al. Liver lobe torsion in rabbits: 16 Cases (2007 to 2012). J Exot Pet Med 2014; 23:258-265.
- 5.
Graham JE, Basseches J. Liver lobe torsion in pet rabbits: Clinical consequences, diagnosis, and treatment. Vet Clin North Am Exot Anim Pract 2014; 17:195-202.
[PubMed] - 6.
Wenger S, Barrett EL, Pearson GR, et al. Liver lobe torsion in three adult rabbits. J Small Anim Pract 2009; 50:301-305.
[PubMed] - 7.
Vilalta L, Espada Y, Majó N, Martorell J. Liver Lobe Torsion in a Domestic Ferret (Mustela putorius furo). J Exot Pet Med 2016; 25(4): 321- 326.
- 8.
Pignon C, Donnelly TM, Mayer J. Hepatic lobe torsion in a rabbit (Oryctolagus cuniculus). Prat Méd Chirur l’Anim Comp 2013; 48(3): 91-98.
- 9.
Bhandal J, Kuzma A, Starrak G. Spontaneous left medial liver lobe torsion and left lateral lobe infarction in a rottweiler. Can Vet J 2008; 49:1002–1004.
[PMC] - 10.
Sancho-Chust JN, Agudo P, Camarasa A, Chiner E. Achromobacter xylosoxidans como agente colonizador de bronquiectasias. Enferm Infecc Microbiol Clin 2010; 28(3):203–210.