Descripción del primer caso autóctono de Pneumonyssoides caninum en las Islas Canarias (España)
Description of the first autochthonous case of Pneumonyssoides caninum in the Canary Islands (Spain)
D.L. Casas-García, J. Villalobos-Gómez, M.L. Ramírez-Bordón, I. Medina-Vega, I. Montenegro-Martínez
Contacto: info@cvmic.es
Resumen
La exploración endoscópica de las vías aéreas altas en un paciente canino por sospecha de inhalación de cuerpo extraño a nivel nasal derivó en la primera descripción in vivo de Pneumonyssoides caninum en la especie canina en las islas Canarias. Generalmente, su diagnóstico clínico se ha visto dificultado por la localización inaccesible de estos ácaros a nivel de vías respiratorias altas en la especie canina, por lo que su diagnóstico se ha alcanzado, por lo general, durante la necropsia. Así, el empleo en el presente caso clínico de la técnica consistente en el flushing de gas anestésico (isofluorano) en sentido rostrocaudal junto con la exploración endoscópica es lo que permitió alcanzar el diagnóstico in vivo, evitando la obtención de un diagnóstico falso negativo.
Palabras clave: rinoscopia, rinitis, Pneumonyssoides, perro.
Clin Vet Peq Anim 2020, 40 (3): 149-152
Summary
Endoscopic examination of the upper airways in a canine patient with suspected inhalation of a foreign body in the nasal cavity led to the first in vivo description of Pneumonyssoides caninum in a domestic canine in the Canary Islands. Generally, their clinical diagnosis has been hampered by the inaccessible location of these mites in the upper respiratory tract in the canine species, and therefore their diagnosis has been reached, in most of the cases during necropsy. Thus, use of a flushing technique with a combination of oxygen and anesthetic gas (isoflorane) in the rostral caudal direction, allows the mites to be dragged into the nasopharynx by the pressure of the flush and slightly intoxicated by the isoflorane. The parasites are observed in the nasopharynx and choanas by caudal flexible endoscopic view.
Keywords: rhinoscopy, rhinitis, Pneumonyssoides, dog.
Clin Vet Peq Anim 2020, 40 (3): 149-152

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
Pneumonyssoides caninum es un ácaro que parasita la cavidad nasal y los senos paranasales en la especie canina y que ha sido descrito en varios países del mundo. Desde la primera descripción de este artrópodo en los Estados Unidos,1 se han descrito casos en muchos otros países – la primera descripción de P. caninum en Europa2 se remonta a 1971–, incluido España a nivel peninsular,3 lo que sugiere una distribución mundial aunque aún se considera un parásito muy poco común en muchos países.4-7
El ciclo vital de este parásito poco habitual en nuestro país no se conoce completamente. Existen publicaciones que apuntan a que estos ácaros son parásitos comensales de la cavidad nasal y senos nasales, y se han definido cánidos salvajes como reservorios de P. caninum.8,9 La vía de transmisión más probable es por contacto directo,10 mediante movimientos activos de las larvas, que incluso pueden visualizarse en las narinas de los animales afectados. La transmisión indirecta mediante fómites no puede descartarse aún, puesto que se ha descrito que P. caninum es capaz de sobrevivir hasta 19 días en condiciones in vitro fuera del hospedador.10
Los ácaros adultos pueden ser visibles macroscópicamente y las hembras pueden llegar a medir de 1 a 1,5 mm de longitud y entre 0,6 y 0,9 mm de diámetro.5,9,10 Estas formas adultas son responsables de un cuadro clínico que va a depender de la carga parasitaria, por lo que puede variar desde la ausencia de cualquier signo clínico, en cuyo caso el diagnóstico final se alcanza post mortem,4 hasta casos más graves con la presencia de secreción nasal, estornudo, estornudo inverso, intolerancia al ejercicio y movimientos bruscos de la cabeza, ya que en infestaciones muy graves el paciente puede presentar un cuadro mixto de rinitis y sinusitis.3,8,11,12
Caso clínico
Se remitió para la exploración endoscópica de las vías respiratorias altas un paciente canino, macho entero, mestizo, de 1,5 años de vida y bajo régimen de semilibertad en zona rural del centro de la isla de Gran Canaria (Islas Canarias) por sospecha de inhalación de cuerpo extraño a nivel nasal.
Durante la anamnesis se describió la existencia de un cuadro agudo de estornudos asociado a estornudo inverso de más de 20 días de evolución, refractario al manejo médico sintomático. La exploración física del paciente reveló la existencia de descarga nasal serosa unilateral derecha, asociada a incremento de la sensibilidad nasal y a normotermia, descartándose la presencia de linfadenopatías, así como de deformación y/o ulceración del plano nasal. El estudio del hemograma reveló una ligera leucocitosis asociada a neutrofilia (14,07 x 109/l), sin alteraciones en la bioquímica sérica.
El paciente fue sometido a exploración endoscópica de las vías aéreas altas, empleándose un protocolo anestésico-analgésico que incluyó una premedicación con medetomidina (Domtor, Ecuphar Veterinaria SLU, Barcelona) a 7 µg/kg por vía intramuscular y butorfanol (Torphasol, Ecuphar Veterinaria SLU, Barcelona) a 0,4 mg/kg también por vía intramuscular. La inducción a la anestesia general se realizó con la administración de propofol (Propovet, Abott, Barcelona) a 1 mg/kg por vía intravenosa, manteniéndose una anestesia intravenosa total a base de propofol (0,4 mg/kg/minuto) durante toda la realización de la exploración traqueal y bronquial. Posteriormente, se procedió a la intubación endotraqueal del paciente y se mantuvo la anestesia con isofluorano (Isoflo, Abott, Barcelona) al 1,5 %, con mezcla de oxígeno y aire medicinal. La monitorización anestésica consistió en pulsioximetría, electrocardiografía, capnografía, temperatura y tomas seriadas de presión arterial.
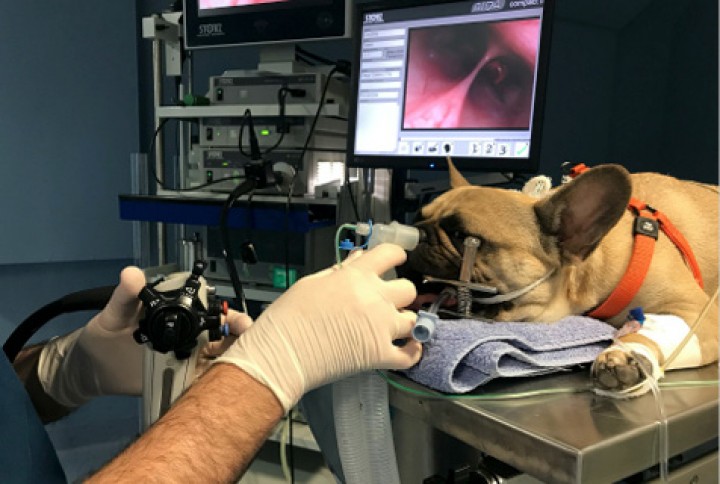
La exploración endoscópica de vías aéreas altas fue realizada mediante endoscopia rígida para ambas cavidades nasales (64019BA, Karl Storz Endoskope, Alemania) y flexible para la exploración de la nasofaringe (Silverscope 60714PKS, Karl Storz Endoskope, Alemania), combinándose con la realización de flushing anterógrado de isofluorano desde ambas cavidades nasales (Fig. 1). Se confirmó la existencia de leve nasofaringitis asociada a signos de cronicidad (Fig. 2), así como eritema y contenido mucoso de naturaleza serosa a nivel de la cavidad nasal derecha. Es en dicha cavidad donde se confirmó la presencia de varios ácaros a nivel del endoturbinado (Fig. 3), procediéndose a su extracción mediante una pinza de cuerpos extraños para su identificación posterior (Fig. 4). Tanto la orofaringe como la laringe no presentaban alteraciones estructurales macroscópicas, así como tampoco a nivel de su mucosa ni de la motilidad laríngea. La exploración de la cavidad nasal izquierda no reveló la existencia de alteraciones a nivel de la mucosa nasal, así como tampoco la presencia de otras formas parasitarias.
Figura 1
Maniobra de flushing nasal para detectar la presencia de Pneumonyssoides caninum durante la exploración endoscópica caudal.
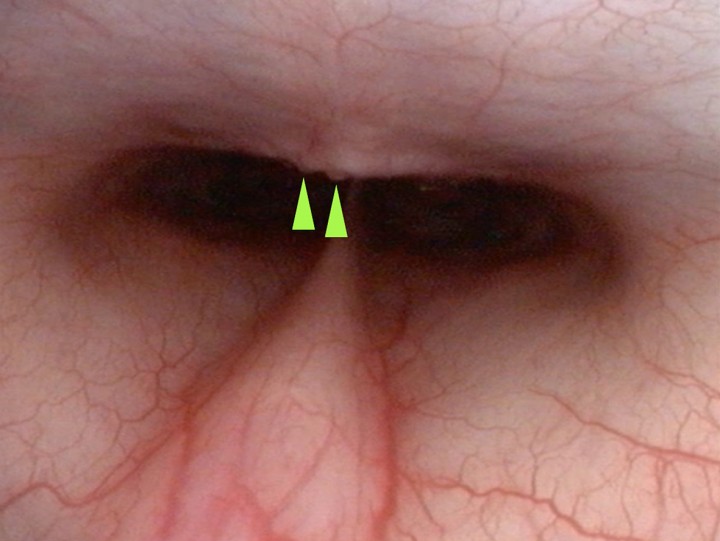
Figura 2
Leve nasofaringitis asociada a signos de cronicidad (puntas de flecha verde)
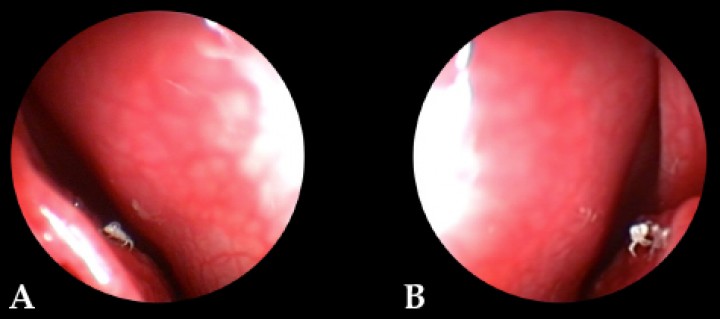
Figura 3
Imágenes endoscópicas de la presencia de P. caninum en el endoturbinado derecho del paciente. (A) Meato nasal medio. (B) Meato nasal común.
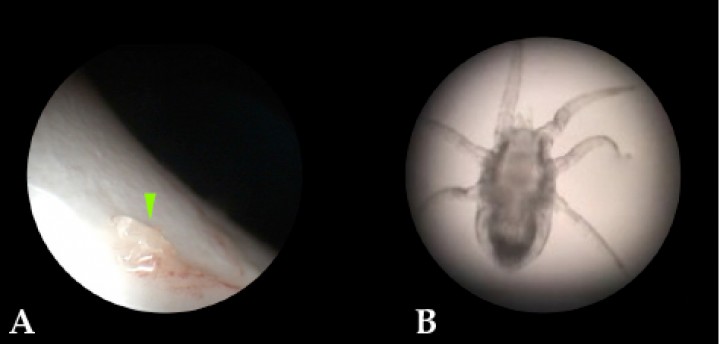
Figura 4
Ejemplar de P. caninum extraído del paciente. (A) Imagen macroscópica (punta de flecha verde). (B) Imagen microscópica (40x).
Tras la extracción e identificación de P. caninum y una vez recuperado el paciente de la anestesia, se prescribió un tratamiento antiparasitario a base de milbemicina oxima (Milbemax, Elanco GmbH, Cuxhaven, Alemania) en 3 dosis de 0,5 mg/kg vía oral con 10 días de separación entre cada una de ellas. Los posteriores controles en el centro veterinario remisor demostraron la completa resolución de los signos clínicos, sin recidiva de los signos clínicos que motivaron la consulta hasta el día de hoy, un año después.
Discusión
Este es el primer caso descrito de transmisión local de P. caninum en las Islas Canarias diagnosticado in vivo y con cura clínica tras su manejo médico, ya que el paciente nunca había abandonado la zona centro de la isla desde su nacimiento. Hay que destacar que, generalmente, las descripciones de infestaciones secundarias a P. caninum en Europa,3,4,9 especialmente fuera de la península escandinava, pueden ser casos importados del norte de Europa a través del movimiento de perros asociados al turismo. Esto puede ser de especial interés, ya que Gran Canaria representa el destino líder invernal en el mercado turístico de los países nórdicos, los cuales suponen en su conjunto el 20,77 % de los turistas que visitan Gran Canaria. Esta isla recibe a más del 50 % de los turistas nórdicos que viajan a las Islas Canarias, especialmente en temporada invernal.13
Actualmente, la mayoría de las enfermedades importadas pueden no representar un riesgo para la población de pequeños animales en un territorio insular como las Islas Canarias. Esto es debido a la ausencia de ciertos vectores naturales que permitan cerrar el ciclo de vida del agente causal (por ejemplo, Leishmania infantum).14 Sin embargo, existen enfermedades como la causada por P. caninum que, con una transmisión directa entre hospedadores, pueden convertirse en enfermedades autóctonas, tal como se demuestra en el presente trabajo, con un contagio producido localmente.
Tanto la rinitis, asociada o no a descarga nasal serosa, como los episodios de estornudo y estornudo inverso crónicos y recidivantes junto con la sacudida de la cabeza son los principales signos clínicos asociados a la infección por P. caninum en la especie canina, habiendo sido descritos casos de hiposmia e incluso anosmia en perros de trabajo.4 Sin embargo, cabe destacar que la intensidad de estos signos clínicos puede variar de un perro a otro en función tanto de la carga parasitaria como del umbral de sensibilidad de la mucosa nasal y nasofaríngea. Además, hay que recalcar que debería reforzarse la sospecha de P. caninum en el diagnóstico diferencial en pacientes que presenten dicho cuadro clínico y que no estén correctamente desparasitados.
No se ha demostrado que la existencia de un cuadro de rinitis parasitaria secundaria a P. caninum produzca eosinofilia.10 Incluso en condiciones in vitro, se han descrito leves eosinofilias tras 8 días desde la inoculación de P. caninum que, posteriormente, vuelve a valores fisiológicos.10 Es por ello que el hemograma no ha demostrado ser útil como método de predicción de un componente parasitario secundario a P. caninum en la especie canina.
En algunas ocasiones, especialmente cuando existen altas cargas parasitarias, los ácaros P. caninum pueden visualizarse externamente como pequeños puntos blanquecinos móviles a nivel de la trufa. Es bajo estas circunstancias cuando el flushing nasal puede permitir la recolección e identificación microscópica de P. caninum. Aun así, el acceso a las localizaciones más comunes donde se alojan estos ácaros hace que, generalmente, su diagnóstico in vivo sea difícil y solo en raras ocasiones pueden detectarse post mortem. Por esta razón el flushing nasal se ha descrito como una técnica de diagnóstico de baja sensibilidad en casos de bajas cargas parasitarias.15
Se ha descrito el empleo de serologías para la detección de anticuerpos frente a P. caninum,12 aunque actualmente no existen kits comerciales que puedan emplearse en clínica. Así, el diagnóstico in vivo final de la infestación por este ácaro nasal no se puede verificar a menos que se observen formas adultas a nivel nasal y/o nasofaríngeo, lo que hace imprescindible la exploración endoscópica de la vía respiratoria alta. Por ello en todos los procedimientos de rinoscopia por enfermedad nasal crónica se debe realizar de rutina el flush nasal de rostral a caudal con la mezcla de oxígeno e isoflorano o sevoflorano, se tenga o no sospecha de infestación por Pneumonyssoides caninum.5,12,13 Para la realización de dicha maniobra basta con desacoplar momentáneamente la tubuladura del sistema de anestesia inhalatoria del tubo endotraqueal y apoyar su extremo sobre una o ambas narinas mientras se está llevando a cabo la exploración endoscópica de la nasofaringe mediante retroflexión. Es en ese momento en el que se deben realizar de 2 a 3 presiones sobre la válvula de descarga rápida para oxígeno que suele emplearse como flujo auxiliar de oxígeno, con el fin de garantizar un medio rico en agente anestésico inhalatorio a nivel nasal y nasofaríngeo sin comprometer la estabilidad del plano anestésico. Esto provocará que los ácaros se movilicen en sentido rostrocaudal arrastrados por la presión del oxígeno y el gas anestésico, siendo identificados endoscópicamente a nivel de las coanas y la nasofaringe.11
En cuanto a su manejo médico, aunque se han probado diferentes acaricidas en el tratamiento de esta parasitosis con resultados variables –como la ivermectina–,11 el uso de lactonas macrolíticas como la selamectina,16,17 la moxidectina y la milbemicina5,18 parecen ser el tratamiento más eficaz, recomendándose realizar un ciclo de tres administraciones con un intervalo de 7-14 días entre cada una de ellas9 e incluso de 3-6 semanas.11,18,19
El uso frecuente de estos antiacaricidas de forma preventiva podría ser, junto con la dificultad en el diagnóstico, el motivo por el cual la prevalencia de esta parasitosis es baja.
Fuente de financiación: este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: ninguno de los autores de este artículo tiene una relación financiera o personal con otras personas u organizaciones que pudieran inapropiadamente influir o sesgar el contenido de este artículo.
Bibliografía
- 1.
Chandler WL, Ruhe DS. 1940. Pneumonyssus caninum n. sp., a mite from the frontal sinus of the dog. J. Parasitol 1940; 26:59-70.
- 2.
Christensson D, Rehbinder C. Pneumonyssus caninum: a mite in the pneumatic cavities of the dog. Nordisk Veterinärmedicin. 1971; 23:499-505.
- 3.
Olmeda García AS, Miró G, Rodriguez Rodriguez JA. Pneumonyssus caninum -parásito de las fosas nasales del perro- en España. Medna Vet 1991;8:45-47.
- 4.
Bredal WP. The prevalence of nasal mite (Pneumonyssoides caninum) infection in Norwegian dogs. Vet Parasitol 1998; 76(3):233-237.
[PubMed] - 5.
Bredal WP. An epidemiological survey of therapy and diagnostic procedures used by Norwegian small animal practitioners in cases of nasal mite (Pneumonyssoides caninum) infection in dogs. Vet Res Commun, 1998; 22(6): 389-399.
[PubMed] - 6.
Movassaghi AR, Mohri M. Nasal mite of dogs Pneumonyssus (Pneumonyssoides) caninum in Iran. Vet Rec, 1998; 142.
[PubMed] - 7.
Wills SJ, Arrese M, Torrance A, Lloyd S, Pratschke K, Whitbread T, Gould S. Pneumonyssoides species infestation in two Pekingese dogs in the UK. J Small Anim Pract, 2008; 49(2): 107-109.
[PubMed] - 8.
Bredal WP. Gjerde BK, Kippenes H. Pneumonyssoides caninum, the canine nasal mite, reported for the first time in a fox (Vulpes vulpes). Vet Parasitol 1997; 73: 291-297.
[PubMed] - 9.
Gunnarsson LK, Zakrisson G, Egenvall A, Christensson DA, Uggla A. Prevalence of Pneumonyssoides caninum infection in dogs in Sweden. J Am Anim Hosp Assoc, 2001; 37: 331-337.
[PubMed] - 10.
Gunnarsson L, Zakrisson G, Lilliehöök I, et al. Experimental infection of dogs with the nasal mite Pneumonyssoides caninum. Vet Parasitol 1998; 77: 179-186.
[PubMed] - 11.
Marks SL. Pneumonyssoides caninum: the canine nasal mite. Compend Contin Educ Vet, 1994; 16: 577-582.
- 12.
Gunnarsson L, Zakrisson G. Demonstration of circulating antibodies to Pneumonyssoides caninum in experimentally and naturally infected dogs. Vet Parasitol 2000; 94: 107-116.
[PubMed] - 13.
Patronato de Turismo de Gran Canaria [Internet]. Gran Canaria; 2016 [citado 25 jul 2019]. Informe de Mercados Nórdicos. Disponible en: http://www.grancanaria.com/turismo/nl/area-profesional/informes-y-estadisticas/paises-emisores/paises-nordicos/
- 14.
Suárez BR, Isidoro BF, Santos SS, et al. Review of the current situation and the risk factors of Leishmania infantum in Spain. Revista española de salud publica, 2012; 86: 555-564.
[PubMed] - 15.
ESCCAP: Consejo Europeo para el Control de las Parasitosis de los Animales de Compañía. Control de ectoparásitos en perros y gatos [Internet]. 2nd ed; 2018 [actualizado abr 2018; citado 25 jul 2019]. Disponible en http://www.esccap.es/wp-content/uploads/2018/05/guia3_2018.pdf
- 16.
Gunnarsson L, Zakrisson G, Christensson D, Uggla A. Efficacy of selamectin in the treatment of nasal mite (Pneumonyssoides caninum) infection in dogs. J Am Anim Hosp Assoc, 2004; 40: 400-404.
[PubMed] - 17.
Fisher MA, Shanks DJ. A review of the off-label use of selamectin (Stronghold®/Revolution®) in dogs and cats. Acta Vet Scand, 2008; 50: 46.
[PubMed] - 18.
Gunnarsson LK, Moller LC, Einarsson AM, et al. Clinical efficacy of milbemycin oxime in the treatment of nasal mite infection in dogs. J Am Anim Hosp Assoc, 1999; 35: 81-84.
[PubMed] - 19.
Mundell AC, Ihrke PJ. Ivermectin in the treatment of Pneumonyssoides caninum: a case report. J Am Anim Hosp Assoc, 1990; 26: 393-396.