Obtención de valores hematológicos con el analizador URIT-5160 en el Galgo español
Hematology values using the URIT-5160 analyzer in Spanish Greyhounds
Contacto: pf.navarro@ucv.es
Resumen
El objetivo de este estudio fue determinar los intervalos de referencia de las concentraciones de hematocrito (HTC), hemoglobina (HGB), glóbulos rojos (GR), volumen corpuscular medio (VCM), concentración de hemoglobina corpuscular media (CHCM), glóbulos blancos (GB) y plaquetas (PLT) en la raza Galgo español con el analizador URIT-5160 (RAL, Barcelona). Para este estudio se seleccionó una población de 34 perros de la raza Galgo español de entre 1 y 11 años aparentemente sanos, a los que se les realizó anamnesis, exploración física completa, hemograma, frotis sanguíneo, bioquímica y serología de Leishmania infantum. El sexo y estado reproductivo fueron variables escogidas de manera aleatoria. Los intervalos de referencia fueron calculados mediante métodos paramétricos. La hipótesis de normalidad fue comprobada mediante el test Anderson-Darling e inspección visual de los histogramas. Se incluyeron un total de 33 perros. Los intervalos de referencia obtenidos con el analizador URIT-5160 (RAL, Barcelona) fueron para la serie roja: HTC 54,27-57,39%, HGB 10,39-20,51 g/dL, RBC 7,74-8,23 x 106/μL, VCM 68,95-70,58 fL y CHCM 35,67-36,06 g/dL. Por otro lado, para la serie blanca se determinó un intervalo de referencia de 4,32-5,31 x 103/μL. Las plaquetas no siguieron una distribución normal con lo que no se pudo calcular el intervalo de referencia.
Palabras clave: hematología, Galgo español, intervalos de referencia, Lebrel.
Clin Vet Peq Anim 2022, 42 (2): 99-104
Summary
The aim of this study was to determinate the reference intervals for the concentrations of hematocrit (HCT), hemoglobin (HGB), red blood cells (RBC), mean corpuscular volume (MCV), mean corpuscular hemoglobin concentration (MCHC), white blood cells (WBC) and platelets (PLT) in the Spanish Greyhound breed with the URIT-5160 (RAL, Barcelona) analyzer. A total of 34 Spanish Greyhounds, between the ages of 1 to 11 years and apparently healthy were selected. Clinical history, a complete physical examination, complete blood count, blood smear, biochemistry and Leishmania infantum serology were performed to all the selected dogs. Sex and reproductive status were randomly selected. The reference intervals (RI) were calculated by parametric methods. The hypothesis of normality was verified by the Anderson Darling test and the visual inspection of histograms. A total of 33 dogs were included in the study. The reference intervals obtained on the URIT-5160 (RAL, Barcelona) analyzer were: HCT 54.27-57.39%, HGB 10.39- 20.51 g/dL, RBC 7.74-8.23 x 106/μL, MVC 68.95-70.58 fL y MCHC 35.67-36.06 g/dL. Moreover, for the WBC a reference interval of 4.32-5.31 x 103 μL was determined. Platelets did not follow a normal distribution which meant that a reference interval was not possible to calculate.
Keywords: hematology, Spanish Greyhound, reference intervals, Greyhound.
Clin Vet Peq Anim 2022, 42 (2): 99-104

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
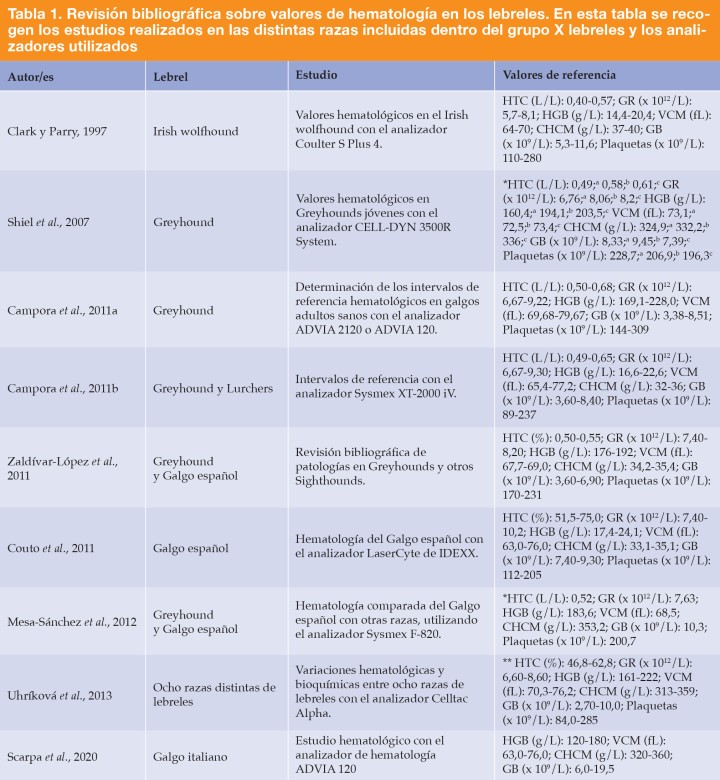
El Galgo español es una raza canina que se clasifica en el grupo 10 de los lebreles (Sighthounds), sección 3ª (lebreles de pelo corto), según la Federación Canina Internacional (FCI). Actualmente, por sus características físicas y clinicopatológicas, así como una mayor masa muscular, el hematocrito más elevado, los huesos carpales y tarsales más alargados y una mayor agudeza visual,1 el Galgo español es un perro mayoritariamente utilizado para la caza de conejos y liebres en la Península Ibérica. Dadas las características físicas excepcionales de los lebreles, son varios los estudios que se han centrado en la obtención de intervalos de referencia (IR) para este conjunto de razas. En la Tabla 11-9 se recopilan los estudios realizados respecto a los valores de hematología y los distintos analizadores utilizados para el grupo lebreles.
HTC: hematocrito; HGB: hemoglobina; GR: glóbulos rojos; VCM: volumen corpuscular medio; CHCM: concentración de hemoglobina corpuscular media; GB: glóbulos blancos.
*Estos estudios proporcionan la media de los valores.
**Estos valores se corresponden con la raza Greyhound.
a5-6 meses; b9-10 meses; c12-13 meses.
Los IR describen la variabilidad de un parámetro biológico en una población de individuos sanos.10 Este concepto se describe por primera vez en medicina humana en 1969 para describir las fluctuaciones de ciertos parámetros dentro de un grupo definido de personas.11 En medicina se ha consolidado ampliamente que los distintos géneros, la edad o incluso la etnia puedan dar lugar a rangos diferentes para un mismo parámetro.12,13
Los IR suponen un factor crítico a la hora de evaluar clínicamente a un paciente, ya que su interpretación errónea nos puede llevar a falsos diagnósticos y/o tratamientos innecesarios que van a resultar perjudiciales para el paciente en mayor o menor medida.14 Es cierto que existen IR para la mayoría de especies domésticas y los distintos analizadores hematológicos,10,15-17 pero no uno para cada raza existiendo en el caso de los perros una variación genética del 27% comparado con el 5-10% que existe en la población humana.18 Por ello, parece importante establecer los valores analíticos dentro de una población sana en función de la edad, el sexo, el estado reproductivo o la raza para no incurrir en un diagnóstico erróneo.14 La Sociedad Americana de Patología Clínica Veterinaria (ASVCP) proporciona unas guías para el establecimiento de nuevos IR en veterinaria.19
Los objetivos de este estudio fueron (1) establecer los IR de los valores hematológicos en un grupo de perros de la raza Galgo español utilizando el analizador URIT-5160 (RAL, Barcelona) y (2) comparar los resultados hematológicos con aquellos obtenidos en otros estudios para las razas Galgo y la población canina general.
Material y métodos
Tipo de estudio y población seleccionada
El estudio presentado es de tipo prospectivo y unicéntrico, realizado durante los meses de febrero, marzo y abril de 2021 en la provincia de Tarragona.
Se incluyeron 34 perros de la raza Galgo español aparentemente sanos, de vida exterior e interior. La edad, el sexo y el estado reproductivo fueron variables y se incluyeron de manera aleatoria. Para la evaluación del estado de salud inicialmente se realizó una anamnesis y un examen físico completo, así como analíticas sanguíneas completas (hemograma, bioquímica y ELISA para detección de Leishmania infantum). Los criterios de exclusión para el estudio fueron la presencia de enfermedades concurrentes o toma de medicación durante el estudio, así como hallazgos anormales en los resultados clinicopatológicos.
Métodos analíticos
Todos los perros incluidos en el estudio debieron estar en ayunas las 12 horas previas a la extracción de sangre. Esta se realizó a través de la vena yugular utilizando una aguja de 23G y una jeringuilla de 2 mL. El hemograma y la bioquímica sanguínea se procesaron en el laboratorio interno del hospital, dentro de las 4 horas posteriores a la extracción.
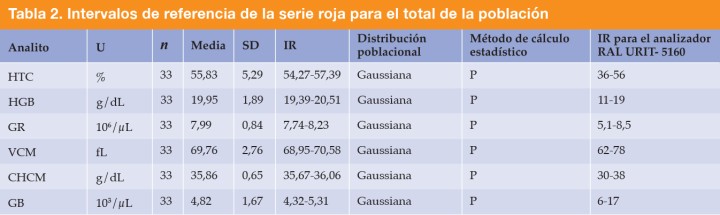
Para el estudio hematológico se utilizó un tubo con anticoagulante EDTA (0,5 mL) para la conservación de la muestra. Las muestras fueron analizadas con el equipo de URIT-5160 (RAL, Barcelona) para la obtención de los parámetros hematológicos: hematocrito (HTC), hemoglobina (HGB), glóbulos rojos (GR), Volumen Corpuscular Medio (VCM), Concentración de Hemoglobina Corpuscular Media (CHCM), plaquetas y recuento total de glóbulos blancos (GB). Los valores de estudio y de referencia para este analizador se encuentran adjuntos en la Tabla 2. Por último, se realizó un frotis sanguíneo mediante tinción de Romanowsky para corroborar los resultados obtenidos en la hematología en referencia al número de plaquetas y a la detección de posibles agentes infecciosos.
HTC: hematocrito; HGB: hemoglobina; GR: glóbulos rojos; VCM: volumen corpuscular medio; CHCM: concentración de hemoglobina corpuscular media; GB: glóbulos blancos; IR: intervalo de referencia; P: paramétrico; SD: desviación estándar; U: unidad.
Para la bioquímica sanguínea se utilizó un tubo con anticoagulante de heparina de litio (1 mL) para la conservación de la muestra. Las muestras fueron analizadas con el equipo de bioquímica (MNCHIP, RAL, Barcelona) para los parámetros albúmina, proteínas totales, glucosa, urea, creatinina, fosfatasa alcalina y alanina aminotransferasa (ALT).
Para el estudio serológico de Leishmania infantum se utilizó un tubo en blanco con gel separador para la conservación de la muestra. Una vez obtenida se dejaba reposar durante 20 min para posteriormente centrifugarse durante 5 minutos a 1340 x g. El suero fue separado de la muestra y congelado a -20 ºC hasta ser analizado mediante un test de ELISA basado en enzimoinmunoensayo para la detección de inmunoglobulinas G contra Leishmania infantum (LEISCAN, Ecuphar, Barcelona) por personal cualificado. Todos aquellos pacientes con una Rz (relación directa con la densidad óptica de las muestras) mayor a 1,1 se consideraron positivos.
Control de calidad y calibración del analizador
Los controles de calidad (QC) del analizador fueron realizados siguiendo las recomendaciones del fabricante. Diariamente y previo al análisis de las muestras, el analizador realiza de manera automática tres controles comerciales con un control de sangre entera industrial (R&D Systems, Bio-techne, Minneapolis) que se utiliza a modo de control hematológico para los valores de referencia del analizador con valor bajo, normal y alto.
Para la calibración se utiliza un calibrador sanguíneo proporcionado por el fabricante que se realizó tras la obtención del analizador.
Análisis estadístico
Los valores atípicos fueron detectados mediante gráficos de box-plot e inspección visual de los histogramas y eliminados en caso de ser observaciones aberrantes por quedar muy distantes del conjunto de datos, aunque se hizo hincapié en mantenerlos siguiendo las recomendaciones de la ASVCP.19
Los intervalos de referencia (IR) se obtuvieron (R v.3.4.3; https://www.r-project.org/) mediante métodos paramétricos dado el número de individuos incluidos en el estudio y siguiendo las recomendaciones de la ASVCP.19 Los IR fueron calculados cuando la distribución de la población se consideró Gaussiana con intervalos de confianza (IC) del 90% conforme a las guías de la ASVCP.19 Para verificar una distribución Gaussiana se examinaron los histogramas visualmente y se confirmaron con el test de Anderson-Darling en todos los parámetros.
Resultados
De los 34 perros incluidos en el estudio, uno de ellos fue eliminado por presentar un título de anticuerpos 1/320 frente a Leishmania infantum. La anamnesis y exploración física resultaron dentro de la normalidad para todos los individuos. Finalmente se incluyeron en el estudio 11 machos y 22 hembras de entre 1 y 11 años. Respecto al estado reproductivo de la población, 20 de las 22 hembras y 10 de los 11 machos estaban esterilizados.
Se realizó un frotis sanguíneo a la población estudiada tras la extracción sanguínea. Se encontraron agregados plaquetarios en 6 perros (18,18 %).
Los parámetros evaluados para la bioquímica fueron normales en todos los casos, a excepción de un aumento leve de glucosa en 2 de los perros (6,06%).
Todos los parámetros de estudio cumplieron con la hipótesis de normalidad. Ningún valor fue eliminado.
Serie roja
Se obtuvieron los siguientes IR para el total de la población (n=33) mediante métodos paramétricos: 55,83-57,39% para el valor HTC, 19,39-20,51 g/dL para el valor HGB, 7,74-8,23 x 106/μL para el valor GR, 68,95-70,58 fL para el valor VCM y 35,67-36,06 g/dL para el valor CHCM (Tabla 2).
Según los IR normales para la especie canina en el analizador URIT-5160 (RAL, Barcelona) se obtuvieron valores superiores en la población de estudio para el HTC y la HGB. Por otro lado, los IR no mostraron variaciones en los GR y los índices eritrocitarios (VCM, CHCM). Respecto al total de la población, tan solo un paciente (3,03%) mostró un VCM por encima de los IR y siete pacientes (21,21%) mostraron GR por encima de los IR.
Serie blanca
Se obtuvieron los siguientes IR para el total de la población (n=33) mediante métodos paramétricos: 4,32-5,31 x 103/μL para el valor de glóbulos blancos totales (Tabla 2).
Según los IR normales para la especie canina en el analizador URIT-5160 (RAL, Barcelona) se obtuvieron valores inferiores en los leucocitos en la mayoría de la población estudiada (78,78%).
Serie plaquetar
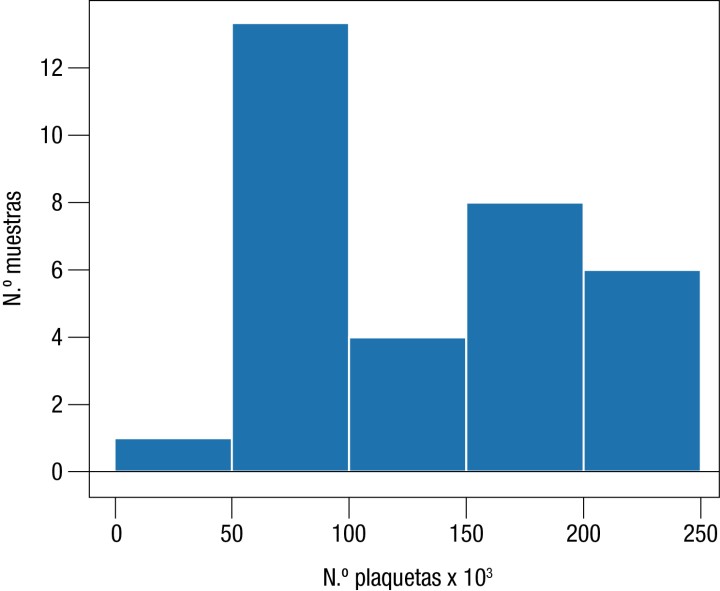
La obtención de los IR para la serie plaquetar no se pudo realizar puesto que la hipótesis de normalidad no se cumplió y, por tanto, no se pudieron utilizar métodos estadísticos paramétricos conforme a las instrucciones dadas por la ASVCP. Sin embargo, se realizó un histograma para su inspección visual (Fig. 1) y se comprobó que la mayoría de la población se encontraba entre las 50 000 y 100 000 plaquetas/μL.
Figura 1
Distribución mediante histograma de las plaquetas.
Discusión
Los resultados del presente estudio determinan que los valores HTC y HGB evaluados con el analizador URIT-5160 (RAL, Barcelona) son superiores respecto al resto de la población canina y que el recuento total de leucocitos se encuentra por debajo del intervalo de referencia respecto a la población general, coincidiendo con los resultados ya publicados para el Galgo español.6,7 Aunque el Galgo español comparta el mismo ancestro que los demás lebreles,18 hay estudios que coinciden en que cada una de las razas podría presentar características laboratoriales diferentes.8
El estudio realizado por Couto et al.6 determinó que el 37% de los galgos presentan valores de HTC superiores a los IR de su analizador para la población canina general. De igual forma, se observó un aumento en la HGB en el 63% de los casos. Valores similares se evidencian en nuestro estudio, donde el 45,45% y 66,67% de los perros muestran IR fuera de rango para el HTC y la HGB, respectivamente. Este perfil puede atribuirse a las características fisiológicas específicas de estos animales para adaptarse a un mayor rendimiento atlético y así́ aumentar la capacidad de transportar oxígeno en momentos donde se requiere mucha demanda.1 Aunque hoy en día ya no se suele usar el Galgo español para carreras, todas estas variaciones hematológicas podrían deberse a su historia y genética compartida con los Greyhounds.18
En relación a los GR, aunque en el estudio realizado por Couto et al.6 un 20% de los perros se hallaba por encima de rango, coincidiendo con el 21,21% obtenido en este estudio, la obtención de los IR refleja que no hay variaciones estadísticamente significativas respecto al resto de la población canina. La hipótesis para este porcentaje de individuos podría ser la contracción esplénica por estrés y la consecuente liberación de eritrocitos en sangre.3,20,21
Los índices eritrocitarios (VCM y CHCM) se encuentran dentro de los rangos establecidos para la especie canina coincidiendo con los estudios realizados anteriormente en el Galgo español.6,7 Por el contrario, en los Greyhounds sí existe elevación de estos parámetros, pudiéndose deber al aumento de la eritropoyesis debido a la menor esperanza de vida de los glóbulos rojos en esta raza respecto a la población canina general.8
En este estudio, el IR para los GB (4,32-5,31 x 103/ μL) se establece por debajo del estipulado para la población canina (6-17 x 103/ μL). Así pues, un 78,78% de la población se encuentra por debajo del límite de referencia para la especie canina frente al 10% evidenciado por Couto et al.6 Por el contrario, en el estudio realizado por Mesa-Sánchez et al.7 no se observó ninguna diferencia a este nivel sugiriendo que los galgos tienen valores de GB similares al resto de perros. Los resultados obtenidos en este estudio apuntan a que esta población celular se asemeja más a la descrita en Greyhounds y Whippets.3-5,8 La disminución de los GB puede sugerir una leucopenia patológica, pero al no haber incluido en el estudio todas las poblaciones pertenecientes a la serie blanca, no podemos concluirlo. Otros estudios en Greyhounds también mostraron un descenso en la población de neutrófilos lo que podría ser causa de la leucopenia.3,4
El estudio estadístico de los valores de PLT no se ha determinado debido a la distribución no Gaussiana de los datos. Nuestra hipótesis es que esta distribución atípica pueda ser debida a la presencia de agregados plaquetarios en varias de las muestras (18,18%). La inspección visual del histograma coincide con otros estudios donde el recuento de plaquetas se encontró por debajo del IR para la población canina general.6,7 La trombocitopenia patológica es poco probable, ya que un estudio evaluó las PLT en Greyhounds con valores similares mediante citometría de flujo descartando causas patológicas.22 Por consiguiente, podríamos extrapolar esta información al Galgo español. La hipótesis de este estudio es que el descenso de las PLT podría deberse a artefactos producidos por agregados plaquetarios23 o a que los Galgos tengan valores menores de manera fisiológica, coincidiendo con otros estudios donde el valor PLT se correlaciona negativamente con el valor HTC.3,6,7
La principal limitación encontrada en este estudio ha sido el bajo número de individuos, ya que según la ASVCP son recomendables más de 120 muestras para la obtención de intervalos de referencia mediante métodos no paramétricos.19 Otra limitación del estudio ha sido la falta de IR para el diferencial leucocitario, así como para la serie plaquetar. Debido al bajo número de perros incluidos en el estudio y la inclusión aleatoria de los mismos, las variables como la edad, el sexo y el estado reproductivo no han podido ser evaluadas estadísticamente de manera individual. Otra limitación ha sido la falta de otras pruebas diagnósticas para la completa evaluación del estado de salud.
Adicionalmente, la falta de referencias bibliográficas específicas del Galgo español en referencia a los valores estudiados durante este estudio deriva en una gran limitación en la práctica del día a día. En muchas ocasiones, los valores de estos animales son extrapolados de los Greyhounds debido a la gran similitud que se puede encontrar entre ambos, encontrándose valores de HTC y HGB elevados, así como valores de GB y PLT disminuidos.1,3-5 Aunque los resultados de nuestro estudio sean semejantes a los estudios de los demás lebreles, se debe tener en consideración que no todos presentan las mismas características hematológicas.2
Este estudio podría ser de ayuda como herramienta adicional en la consulta, ya que aporta un mejor conocimiento de la raza y proporciona valores mucho más específicos si se utiliza el analizador URIT-5160 (RAL, Barcelona).
Agradecimientos
Queremos agradecer al equipo del Hospital Bofarull Veterinaris por su ayuda y disponibilidad y, en especial, a todos los colaboradores de cuatro patas.
Fuente de financiación: este trabajo no se ha realizado con fondos comerciales, públicos o privados.
Conflicto de intereses: los autores declaran no tener ningún tipo de conflicto de interés.
Nota: este artículo es parte de un trabajo de fin de grado realizado en la facultad de veterinaria y ciencias experimentales de la Universidad Católica de Valencia San Vicente Mártir.
Bibliografía
- 1.
Zaldívar López S, Marín LM, Iazbik MC, et al.: Clinical pathology of greyhounds and other sighthounds. Vet Clin Pathol 2011; 40(4): 414-425.
- 2.
Clark P, Parry BW: Some haematological values of Irish wolfhounds in Australia. Aust Vet J 1997; 75(7): 523-524.
[PubMed] - 3.
Shiel RE, Brennan SF, O'Rourke LG, McCullough M, Mooney CT: Hematologic values in young pretraining healthy greyhounds. Vet Clin Pathol 2007; 36: 274-277.
[PubMed] - 4.
Campora C, Freeman KP, Lewis FI, et al.: Determination of haematological reference intervals in healthy adult greyhounds. J Small Anim Pract 2011; 52(6): 301-309.
[PubMed] - 5.
Campora C, Freeman KP, Serra M, Sacchini F: Reference intervals for greyhounds and lurchers using the Sysmex XT-2000iV hematology analyzer. Vet Clin Pathol 2011; 40(4): 467-474.
[PubMed] - 6.
Couto CG, Bertolone N, Couto JI, et al.: Hematología del Galgo español utilizando el analizador hematológico LaserCyte (IDEXX). Clín Vet Peq Animal 2011; 31: 205-207.
- 7.
Mesa Sanchez I, Zaldivar Lopez S, Couto CG: Haematological, blood gas and acid-base values in the galgo español (spanish greyhound). Small Anim Pract 2012; 53(7): 398-403.
[PubMed] - 8.
Uhríková I, Lačňáková A, Tandlerová K: Haematological and biochemical variations among eight sighthound breeds. Aust Vet J 2013; 91(11): 452-459.
[PubMed] - 9.
Scarpa P, Ruggerone B, Gironi S, Vitiello T, Paltrinieri S: Haematological and biochemical reference intervals in healthy racing and retired italian greyhounds. Acta Vet Hung 2020; 68(1): 71-78.
[PubMed] - 10.
Geffre A, Concordet D, Braun JP, Trumel C: Reference value advisor: a new freeware set of macroinstructions to calculate reference intervals with Microsoft Excel. Vet Clin Pathol 2011; 40(1): 107-112.
[PubMed] - 11.
Gräsbeck R: The evolution of the reference value concept. Clin Chem Lab Med 2004; 42(7): 692-697.
[PubMed] - 12.
Horn PS, Pesce AJ: Effect of ethnicity on reference intervals. Clin Chem 2002; 48(10): 1802-1804.
[PubMed] - 13.
Zhang X, Ding Y, Zhang Y, et al.: Age- and sex-specific reference intervals for hematologic. Int J Lab Hematol 2019; 41(3): 331-337.
[PubMed] - 14.
Lefebvre HP: Greyhound-specific reference intervals: a good start to a long race. Vet Clin Pathol 2011; 40(4): 405-406.
[PubMed] - 15.
Moritz A, Fickenscher Y, Meyer K, Failing K, Weiss D: Canine and feline hematology reference values for the ADVIA 120 hematology system. Vet Clin Pathol 2004; 33(1): 32-38.
[PubMed] - 16.
Bourgés AN, Geffré A, Concordet D, Braun JP, Trumel C: Canine reference intervals for the Sysmex XT-2000iV. Vet Clin Pathol 2011; 40(3): 303-315.
[PubMed] - 17.
Schneider L, Mischke R: Platelet variables in healthy dogs: reference intervals. Comp Clin Pathol 2016; 25: 1097-1106.
- 18.
Parker HG, Kim LV, Sutter NB: Genetic structure of the purebred domestic dog. Science 2004; 304: 1160-1164.
[PubMed] - 19.
Friedrichs KR, Harr KE, Freeman KP, et al.: ASVCP reference interval guidelines: determination of de novo reference intervals in veterinary species and other related topics. Vet Clin Pathol 2012; 41(4): 441-453.
[PubMed] - 20.
Nitsche KE: Erythrocytosis in dogs and cats: diagnosis and management. Compendium on Continuing Education for the Practicing Veterinarian-North American edition 2004; 26(2):104-119.
- 21.
Perez García EF, Barbosa Mireles MA, Del Angel Caraza J, Quijano Hernandez IA: Caracterización clínica de la eritrocitosis en perros. Vanguardia Veterinaria 2019; 26-34.
- 22.
Santoro SK, Garrett LD, Wilkerson M: Platelet concentrations and platelet- associated IgG in Greyhounds. J Vet Intern Med 2007; 21(1): 107-112.
[PubMed] - 23.
Rebar A, MacWilliams P, Feldman B, et al. Manual de hematología de perros y gatos. 2002, Barcelona, España: Teton Newmedia.