Manejo del paciente canino con parvovirosis
Emergency management of canine parvovirosis
Contacto: spenelo@ucm.es
Resumen
El parvovirus canino continúa siendo uno de los agentes etiológicos diagnosticados más frecuentemente en los cuadros de gastroenterocolitis en perros, afectando a pacientes de cualquier edad. La aparición de nuevas cepas, extendidas a nivel mundial, demuestra una constante evolución del virus, provocando sintomatología clínica en animales con pauta de vacunación completa. Aunque la sintomatología típica comprende signos digestivos, la leucopenia severa y las lesiones en la pared del intestino favorecen la translocación bacteriana y la posible aparición de shock séptico y fallecimiento del paciente. Si bien el diagnóstico definitivo requiere técnicas laboratoriales complejas como la PCR, considerada como el gold standard, las técnicas utilizadas en los centros veterinarios (inmunocromatografía rápida o ELISA) tienen una alta especificidad, con una sensibilidad variable en función de la prueba utilizada. Otras pruebas complementarias, como analítica sanguínea completa y determinados biomarcadores, se utilizarán como valor pronóstico y de evolución de la enfermedad, ayudando a establecer un tratamiento más eficaz e individualizado. A pesar de que se ha descrito el tratamiento ambulatorio en esta enfermedad, la fluidoterapia y la nutrición serán pilares fundamentales, por lo que estos pacientes requerirán una hospitalización intensiva. El tratamiento antibiótico ha sido ampliamente discutido, existiendo protocolos muy variables en función de la bibliografía consultada. Los nuevos tratamientos como el trasplante fecal, probióticos o antioxidantes requieren de estudios más completos para poder determinar su eficacia en la disminución del tiempo de hospitalización y aumento de la supervivencia. En el presente artículo se revisan las principales características de la enfermedad y los últimos avances en su tratamiento.
Palabras clave: parvovirus canino, enteritis, fluidoterapia, albúmina, tratamiento.
Clin Vet Peq Anim 2022, 42 (3): 155-167
Summary
Canine parvovirus continues to be one of the most frequently diagnosed aetiological agents of gastroenterocolitis in dogs, affecting patients of all ages. The emergence of new strains, spread worldwide, demonstrates a constant evolution of the virus, causing clinical symptoms in animals with a complete vaccination schedule. Although the typical symptomatology includes digestive signs, severe leucopenia and lesions in the intestinal wall favour bacterial translocation and the possible occurrence of septic shock and death of the patient. Although definitive diagnosis requires complex laboratory techniques such as PCR, considered the gold standard, the tests used in house, as rapid immunochromatography or ELISA, have a high specificity, with a variable sensitivity depending on the test. Other complementary tests, such as complete blood analysis and certain biomarkers, will be used as a prognostic indicator, helping to establish a more effective and individualised treatment. Although outpatient treatment has been described, fluid therapy and nutrition will be the mainstay, so these patients will require intensive hospitalization. Antibiotic treatment has been widely discussed, with protocols varying widely depending on the literature. New treatments, such as faecal transplantation, probiotics or antioxidants require more complete studies to determine their efficacy in reducing hospitalization time and increasing survival. This article reviews the main characteristics of the disease and the latest advances in its treatment.
Keywords: canine parvovirus, enteritis, fluid therapy, albumin, treatment.
Clin Vet Peq Anim 2022, 42 (3): 155-167

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
Los cuadros de gastroenteritis en cachorros son uno de los motivos más frecuentes de consulta en la clínica de pequeños animales, presentándose muchas veces como urgencias. Dentro del diagnóstico diferencial de este cuadro clínico se incluye el parvovirus canino (CPV), que constituye una de las causas más comunes de mortalidad y morbilidad en cachorros.1-5 En este artículo se realiza una revisión actualizada del manejo hospitalario de los pacientes caninos con esta patología.
Etiología
El CPV pertenece al género Protoparvovirus, familia Parvoviridae. Es un virus de ADN de cadena simple y de tamaño pequeño.1,4-6 Su tasa de mutación está cercana a la de los virus de ARN, por lo que han aparecido nuevas variantes o cepas (CPV-2a, 2b y 2c), que tienen una eficacia de replicación mayor en el hospedador canino, así como mayor capacidad de replicación y producción de enfermedad en gatos.1,4-8
La infección por parvovirus en gatos se conoce desde hace más de 100 años, producida por el virus de la panleucopenia felina (“Feline Panleucopenia Virus”, FPV).1,4-8 En los caninos, se describió el virus por primera vez en 1967 como agente etiológico de enfermedad gastrointestinal y respiratoria, denominándose virus diminuto de los caninos y designándose más tarde como parvovirus canino tipo 1 (“Canine parvovirus-1”, CPV-1). El CPV-2 fue detectado por primera vez en 1978 en Estados Unidos, Australia y Europa. Causó gastroenteritis hemorrágicas fatales y miocarditis subagudas en perreras y criaderos por todo el mundo.1,4-8 La circulación del nuevo virus CPV-2 y los programas iniciales de vacunación proporcionaron inmunidad en las poblaciones caninas, lo que redujo la mortalidad y la diseminación del virus. En 1979 y 1980, se detectó la presencia de una nueva variante antigénica, CPV-2a. En 1984 se describió una segunda variante, CPV-2b y en el año 2000, CPV-2c.9 Actualmente, la parvovirosis canina se encuentra extendida por todo el mundo y puede provocar sintomatología clínica incluso en animales con un buen manejo y con una pauta de vacunación completa (incluido adultos).4,6,9 En estudios recientes se ha demostrado que el virus se encuentra en un activo proceso de evolución.1,5,6,9
Fisiopatología
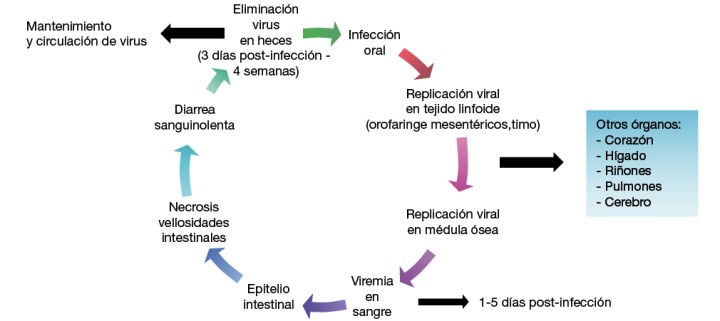
Las cepas de CPV-2 y FPV pueden infectar otros hospedadores (coyotes, lobos, mapaches, panda rojo, hurones, leones, chacales y mangostas)6,10-13 y permanecer en el ambiente más de un año.5,14 El CPV se propaga rápidamente por ruta fecal-oral (transmisión directa) o por exposición oronasal a fómites contaminados con heces (transmisión indirecta). Se replica en la orofaringe, ganglios mesentéricos y timo, produciendo viremia 1-5 días tras la exposición. Posteriormente, infecta a las células en rápida división de las criptas del epitelio intestinal, médula ósea, lengua, cavidad oral y miocitos, y otros tejidos (pulmones, hígado, bazo y riñones) (Fig. 1). El periodo de incubación comprende entre 4 y 14 días, precediendo la eliminación de virus en heces a la sintomatología clínica en el paciente.1,4-6 Durante el destete, los enterocitos de las criptas intestinales tienen un alto índice mitótico debido a los cambios en la flora bacteriana y la dieta, por lo que son más susceptibles al tropismo vírico.1,2,4-6,15
Figura 1
Fisiopatología del parvovirus canino.
El CPV interrumpe el recambio normal celular del intestino delgado, produciendo acortamiento y atrofia de vellosidades, que pierden la capacidad de absorción, causando enteritis profunda, con vómitos, diarreas hemorrágicas (Fig. 2), malabsorción y translocación bacteriana por ruptura de la integridad de la barrera intestinal (aumenta el riesgo de septicemia por E. coli).1,2,4-6,15 Otros signos clínicos son anorexia, depresión, fiebre, pérdida de peso y deshidratación.
Figura 2
Diarrea hemorrágica en un paciente canino con parvovirus.
En el timo, el virus destruye la corteza del órgano, que junto a la destrucción de los precursores de leucocitos en la médula ósea, produce leucopenia (recuentos de 500-2000 leucocitos/µl). A esta depleción de leucocitos contribuye la marginación de los neutrófilos por la endotoxemia y potencial sepsis, así como una pérdida marcada de neutrófilos a través de la pared intestinal inflamada. Esta falta de inmunidad, junto con la bacteriemia por translocación bacteriana, supone un alto riesgo de síndrome de respuesta inflamatoria sistémica (SIRS), shock séptico, fallo multiorgánico y muerte.1,4,15,16 Los cuadros de parvovirosis pueden verse también exacerbados por infecciones concurrentes. La recuperación del intestino delgado puede requerir un período de 2-3 semanas tras la infección.
Otras formas clínicas menos frecuentes son: presentaciones hiperagudas,6,17 eritema multiforme,18,19 cuadros neurológicos por CPV o secundario a neuroglucopenia4-6,20 y miocarditis.4-6,21 Los perros de edad avanzada, cachorros correctamente inmunizados o aquellos expuestos a una baja concentración vírica pueden ser portadores asintomáticos o presentar cuadros clínicos más leves.6,15,22,23
Diagnóstico
Debido a que la sintomatología es similar a otras gastroenterocolitis hemorrágicas, se aconseja una detección temprana de CPV para evitar su dispersión en el entorno hospitalario y en colectividades, dado que el virus puede incluso eliminarse en heces previamente a la aparición de signos digestivos.5,6
Las pruebas diagnósticas pueden realizarse con muestra de heces, hisopos orofaríngeos y sangre completa. El diagnóstico definitivo se realiza mediante detección de antígeno por ELISA, PCR (más sensible y específico), microscopía electrónica, hemaglutinación o aislamiento vírico.1,5,6,17,24,25 Las más frecuentemente utilizadas en el propio centro veterinario para el testaje inicial son las pruebas rápidas inmunocromatográficas o ELISA, generalmente con alta especificidad (puede ser mayor del 90%),14,24,26,27 y sensibilidad variable entre un 16% y un 80 % comparando con la PCR (considerada el gold standard).6,17,24,26,27 Es necesario tener en cuenta la vacunación previa, ya que, según el test y la vacuna utilizada (vacunas vivas modificadas), se pueden obtener resultados falsos positivos hasta 28 días post-vacunación.5,24,25,28
Asimismo estas pruebas pueden mostrar resultados falsos negativos, ya que las heces deben contener un mínimo de 106 copias de ADN/mg para obtener un resultado positivo. Los anticuerpos frente al parvovirus presentes en el tracto digestivo pueden secuestrar partículas víricas e impedir que los tests las detecten.24,29 Si un paciente con resultado negativo en un test rápido presenta sintomatología compatible con parvovirus y alta sospecha de la enfermedad, deben realizarse otras pruebas complementarias para evitar la diseminación de la enfermedad (de elección PCR).5,25
A continuación, detallamos otros hallazgos frecuentes en estos pacientes.
Hemograma
Leucopenia
Se produce por neutropenia y linfopenia debido a que el virus afecta a la médula ósea, timo y otros tejidos linfoides. La presencia de citopenias y su duración puede constituir un factor predictivo de la evolución del paciente. Un estudio describe que un recuento total de leucocitos por encima de 4500/µl y un recuento de linfocitos mayor de 1000/µl, tanto en el momento del ingreso como 48 h después, tienen valor predictivo de supervivencia. El mismo estudio no encuentra diferencias significativas en la neutropenia entre los supervivientes y no supervivientes.30 Otro estudio asocia un recuento de glóbulos blancos mayor a 3200/µl y de neutrófilos mayor a 1650/µl a las 72 horas de comenzar el tratamiento con una evolución positiva del cuadro clínico.31 Además de las citopenias asociadas a la línea blanca, también se ha descrito una reducción de la capacidad fagocítica y del burst oxidativo en perros con parvovirus neutropénicos o con neutrófilos banda circulantes.32
Anemia
La anemia se produce por una combinación de aplasia medular, hemorragias intestinales y hemodilución por la fluidoterapia.33-36
Trombocitopenia
Ocurre por disminución de la producción de plaquetas o como resultado directo de la acción del virus o del sistema inmune sobre las plaquetas o el endotelio. Se ha documentado también en cachorros con parvovirus un estado de hipercoagulabilidad no asociada a coagulación intravascular diseminada, debido a un efecto procoagulante de las endotoxinas (provenientes de la lisis bacteriana) y las citoquinas (liberadas por los linfocitos y macrófagos).4,5,36
Bioquímica
Las alteraciones descritas no son específicas.
Hipopotasemia
Severa, frecuentemente junto con hiponatremia e hipocloremia, debido a la anorexia, los vómitos y la diarrea, que puede contribuir al decaimiento del paciente.1,2,4-6,14,37
Hipoalbuminemia
Debida a anorexia, malabsorción, enteropatía perdedora de proteínas y síntesis de proteínas de fase aguda hepática en detrimento de la síntesis de albúmina. La electroforesis de proteínas séricas en estos animales muestra hipoalbuminemia, hipogammaglobulinemia e hiper-α2-globulinemia.4,5,31,37,38 Algunos estudios han demostrado que los niveles altos de las proteínas de fase aguda, como por ejemplo la proteína C-reactiva,evaluados 12 y 24 h tras la hospitalización del animal, indican una mayor mortalidad en estos animales.39 Otros estudios evalúan la ceruloplasmina; en los animales con buena evolución y altas probabilidades de supervivencia; esta proteína de fase aguda disminuye significativamente en las primeras 72 h de tratamiento.31
Aumento de urea, creatinina y fósforo inorgánico
Aumentos asociados, por lo general, a la deshidratación e hipovolemia. Por ello, en estos pacientes debe evitarse la utilización de fármacos potencialmente nefrotóxicos o que disminuyan la perfusión renal.1,4-6
Elevaciones de la actividad de la fosfatasa alcalina y de la alanina aminotransferasa
Elevaciones secundarias a hipoxia hepática por hipovolemia, aunque se ha postulado que puede contribuir la absorción de sustancias tóxicas por la pérdida de la integridad de la barrera intestinal.5,16,37 La elevación aislada de la actividad de la fosfatasa alcalina puede ser normal en cachorros, lo que complica su interpretación fisiopatológica.40
Hipocolesterolemia
Puede utilizarse como un indicador de la gravedad de la enteritis. Las lipoproteínas plasmáticas se unen a la porción bioactiva de las moléculas de endotoxinas lo que evita que estimulen los monocitos y macrófagos, regulando así la respuesta del hospedador a las endotoxinas; existen estudios donde se muestra una correlación entre las concentraciones plasmáticas bajas de colesterol y la mortalidad en humanos;41 en veterinaria, algunos estudios sugieren la asociación entre hipocolesterolemia e hipertrigliceridemia con una menor supervivencia en pacientes críticos.14,39,42,43
Equilibrio ácido-base
Los estudios sobre el equilibrio ácido-base en estos animales han mostrado la existencia de acidosis o alcalosis según la severidad de los vómitos o del origen de la diarrea. En la mayoría de los casos se observa una acidosis metabólica, posiblemente por la pérdida excesiva de bicarbonato por el tracto intestinal y el acúmulo de ácido láctico por hipoperfusión.5,6,44
Otros biomarcadores
Los pacientes infectados por parvovirus, al igual que en el caso de otras enfermedades críticas, presentan una activación del eje hipotálamo-hipófisis-adrenal, además de alteraciones en los niveles de hormonas tiroideas. La respuesta al estrés y el síndrome de respuesta inflamatoria sistémica (SIRS) se manifiestan con un aumento marcado de los niveles séricos de cortisol en relación con pacientes sanos. Algunos estudios indican que los niveles de cortisol aumentan y la concentración de tiroxina sérica disminuye a medida que aumenta la severidad de la enfermedad, encontrándose estos parámetros directamente correlacionados con la mortalidad.39,45 Se han propuesto valores de cortisol ≤16,9 ng/ml a las 72 h de inicio del tratamiento como un valor predictivo de supervivencia.31
Otros autores describen hipocobalaminemia en estos pacientes, cuya relevancia clínica se desconoce.46 Recientemente se han descrito niveles elevados de biomarcadores de lesión cardíaca (troponina cardiaca-I y creatin-kinasa-banda miocárdica) en perros con parvovirosis, aunque no se relacionaron con predicción de mortalidad; sí que se asociaron a mayor mortalidad los aumentos de los marcadores de lesión intestinal intestinal-fatty acid-binding protein (I-FABP) y trefoil factor 3 (TFF-3).31
Diagnóstico por imagen
Los hallazgos no son específicos de pacientes infectados con parvovirus. Las radiografías abdominales pueden ser normales al inicio de la enfermedad, o mostrar signos de íleo con distensión de asas intestinales por acúmulo de líquido o gas. Los signos ecográficos son asimismo inespecíficos, mostrando áreas de distensión con fluido y gas tanto en estómago como en intestino, íleo con movimientos peristálticos inefectivos, efusión peritoneal anecoica, etc.1,2,5,6 Ambas técnicas ayudan a descartar otras causas del cuadro clínico, como son cuerpos extraños, obstrucción e invaginación intestinal.1,2,5,6
Tratamiento
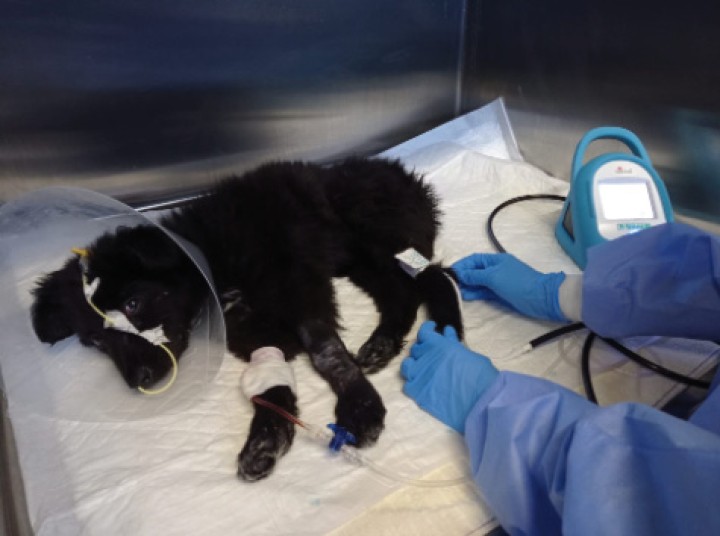
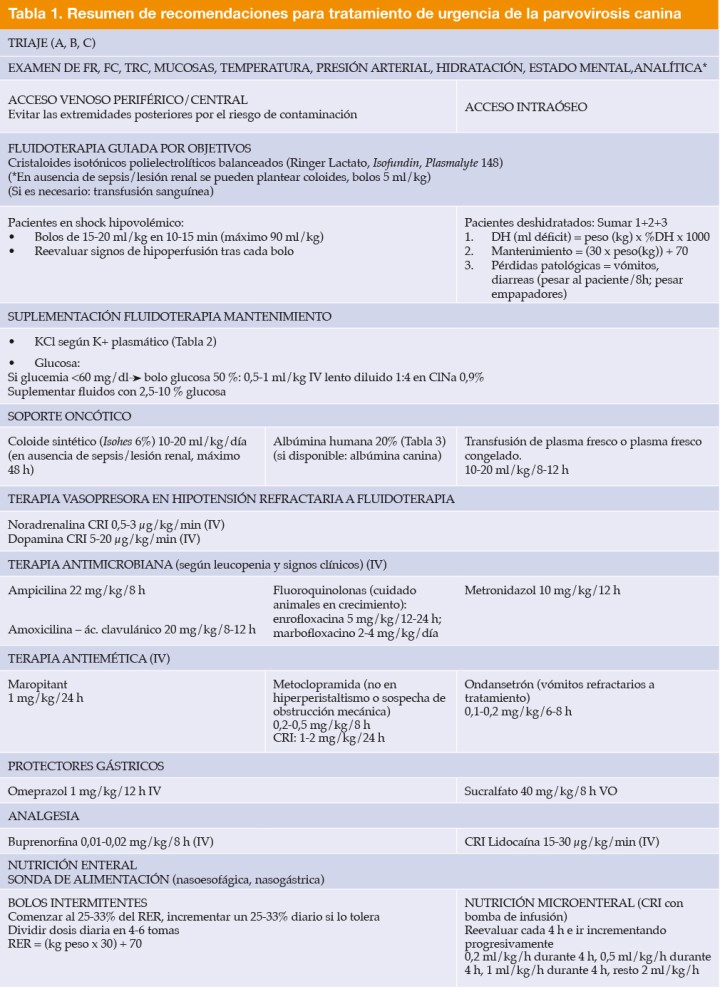
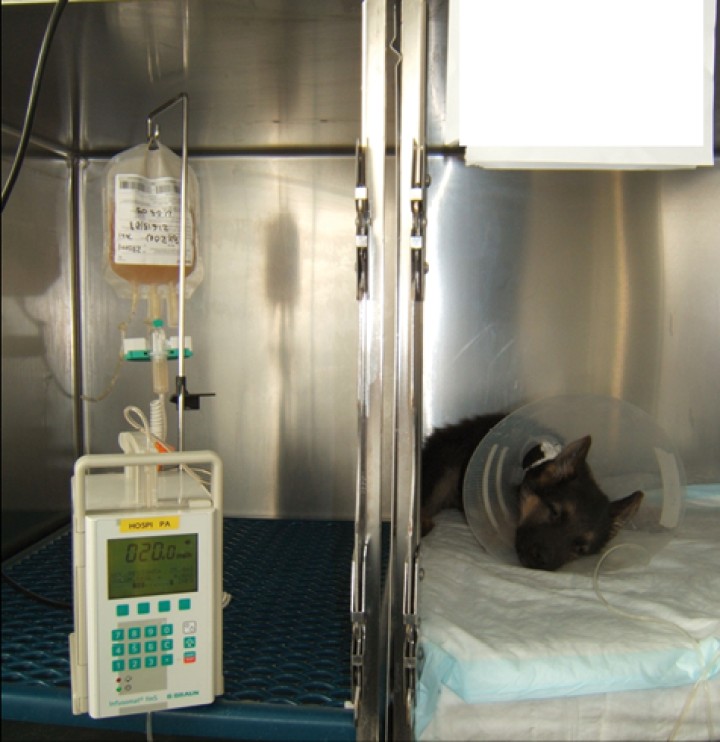
Las tasas de supervivencia en animales con parvovirus son muy variables, desde el 9% en animales sin tratamiento hasta el 90% en animales con tratamiento intensivo.5,14,47 No se utiliza un tratamiento específico frente al agente infeccioso, sino de soporte frente a sus consecuencias. Se recomienda un tratamiento agresivo con hospitalización intensiva y control frecuente de glucemia, temperatura, frecuencia cardiaca y respiratoria, pérdidas, hidratación y presión arterial (Fig. 3 y Tabla 1), hasta que se resuelvan los signos clínicos de vómitos y diarreas. Generalmente los pacientes mejoran clínicamente cuando los niveles de leucocitos comienzan a restaurarse, aunque pueden desarrollar complicaciones graves como neumonía por aspiración, intususcepciones, hipotensión, hipoglucemias o hipoalbuminemia con edema, que pueden desembocar en alta morbilidad y en un aumento del tiempo de hospitalización.1,2,4-6,14,48 Hay que mantener medidas de aislamiento y bioseguridad por la elevada tasa de contagio (Fig. 4).
Figura 3
Medición de la presión arterial no invasiva mediante un método oscilométrico en un paciente canino con parvovirus.
*La analítica debería incluir: hemograma, bioquímica básica, iones, gasometría y lactato y, en cuanto sea posible, test de parvovirosis. FR: frecuencia respiratoria, FC: frecuencia cardiaca, CRI: perfusión a ritmo constante, DH: deshidratación, RER: requerimiento energético en reposo, IV: intravenoso, VO: vía oral.
Figura 4
Medidas de bioseguridad para evitar la propagación intrahospitalaria del parvovirus: uso de bata, guantes, calzas y material exclusivo para estos pacientes.
Fluidoterapia
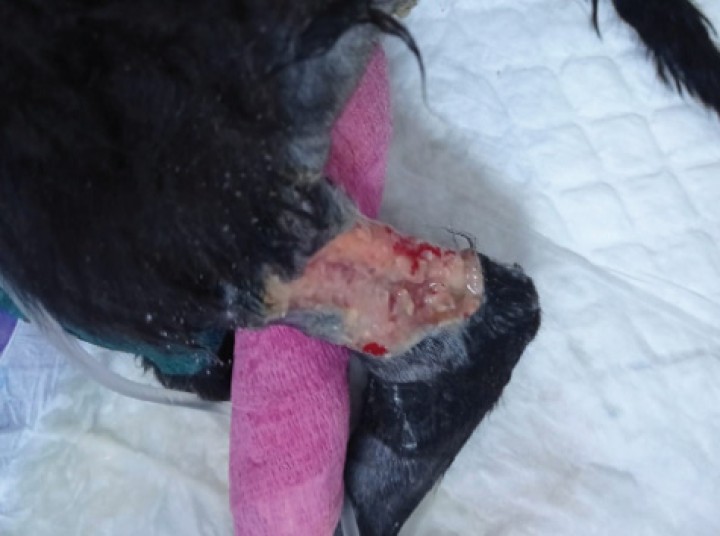
Es fundamental para la restauración del volumen intravascular y el mantenimiento de una hidratación adecuada.5,49 Es necesario establecer un acceso vascular, aunque en los pacientes más hipovolémicos o con deshidratación severa puede ser complicado, requiriendo inicialmente otros accesos, como la vía intraósea, que permitirán comenzar la fluidoterapia de resucitación.5,49,50 La cateterización intravenosa y el cuidado del catéter deben ser escrupulosamente asépticos, ya que la infección inducida por los catéteres es una complicación muy grave,51 describiéndose desde abscesos y celulitis en el punto de inyección (Fig. 5), hasta poliartritis séptica y discoespondilitis.49,52 Existe un mayor riesgo de infección en los animales con leucopenia severa.
Figura 5
Infección del punto de inyección por catéter intravenoso, con necrosis de la piel y presencia de contenido purulento, en un paciente canino leucopénico por parvovirus.
Debido al alto riesgo de contaminación del catéter con vómitos/heces, es preferible la colocación de un catéter central yugular (Fig. 6), ya que, además de proporcionar una vía de administración de fluidos y medicación, permite la extracción de sangre para monitorización de glucosa, electrolitos o albúmina, entre otros, sin necesidad de puncionar de nuevo al paciente.5 Puede utilizarse la vía subcutánea en los casos de deshidratación moderada,53 pero está contraindicada cuando exista un compromiso circulatorio, ya que, al existir vasoconstricción periférica, la absorción y distribución de los fluidos no va a ser la adecuada.50 Generalmente el fluido de elección es un cristaloide isotónico balanceado (Ringer Lactato o equivalente). El volumen inicial y la velocidad de administración dependerán del grado de deshidratación e hipovolemia.5,50 Si hay signos de hipovolemia (taquicardia/bradicardia, hipotermia, aumento del tiempo de relleno capilar, hipotensión, etc.), se administrarán bolos de cristaloide isotónico de 15-20 ml/kg en 10-15 minutos (máximo 80-90 ml/kg), monitorizando los parámetros de perfusión hasta que se vayan normalizando (terapia guiada por objetivos).50,53 Una vez restaurado el volumen intravascular, se repondrán las pérdidas de fluido intersticial. Para calcular el volumen de fluidos y reponerlo en las siguientes 12-24 horas hay que tener en cuenta el grado de deshidratación intersticial calculado tras la resucitación, el volumen de mantenimiento y las pérdidas patológicas (vómitos/diarreas) que suelen ser cuantiosas en estos pacientes.50 Existen varios métodos para monitorizar la pérdida de fluidos como, por ejemplo, pesar al paciente 2-3 veces al día o los empapadores sobre los que vomita/defeca, ya que 1 gramo equivale aproximadamente a 1 ml de fluido perdido.
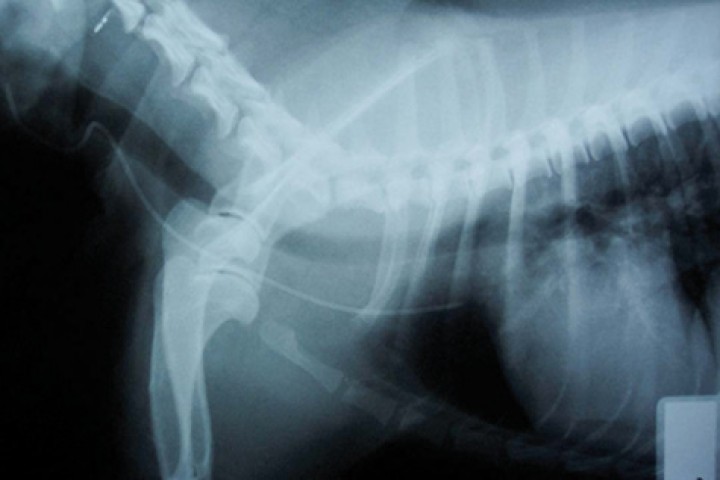
Figura 6
Radiografía de tórax laterolateral de un paciente canino tras la inserción de un catéter venoso central para comprobación de la correcta colocación (vena cava craneal).
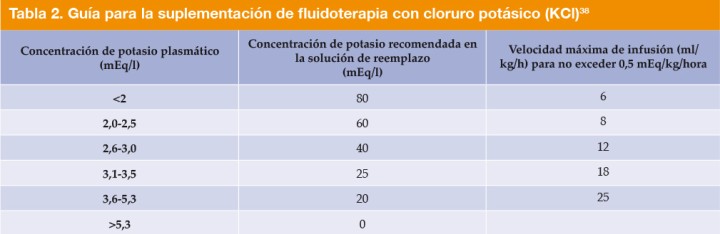
Debido a la anorexia, los vómitos y la diarrea, los animales suelen desarrollar hipopotasemia e hipoglucemia.49,54,55 La hipopotasemia severa puede producir debilidad muscular, íleo paralítico, arritmias cardiacas y poliuria. El potasio debe suplementarse con los fluidos según las concentraciones sanguíneas (Tabla 2).50 También es necesario monitorizar la glucemia y suplementar glucosa en caso de hipoglucemia.49 Si la glucemia es menor de 60 mg/dl, se administra un bolo intravenoso o intraóseo de glucosa 0,5 g/kg (Glucosa 50%, 1 ml/kg diluida 1:4 con ClNa 0,9%), añadiendo posteriormente del 2,5 al 5 % de glucosa en los fluidos.1,4,5,49
Las pérdidas por las diarreas junto con la falta de absorción de nutrientes pueden dar lugar a una hipoproteinemia importante. La morbilidad y mortalidad aumenta cuando la concentración de albúmina sérica disminuye por debajo de 2 g/dl.5,50,56,57 Tanto en medicina humana como en veterinaria se ha asociado la hipoalbuminemia con retraso en la cicatrización de heridas, alteraciones en el transporte de fármacos y un mayor riesgo de dehiscencia de suturas en pacientes quirúrgicos.56 Puede ser repuesta preferentemente mediante soluciones de albúmina o, si no hay disponibilidad de esta, administración de plasma fresco o fresco-congelado (PFC) (Fig. 7). En pacientes con hipoalbuminemia severa (<1,5 g/dl) se puede recurrir a administrar soluciones de albúmina humana56,58 (Tabla 3), hasta alcanzar niveles de 2-2,5 g/dl. La albúmina humana puede producir reacciones de hipersensibilidad temprana y tardía, por lo que, si está disponible, es preferible usar albúmina de la misma especie.56,57,59 En España, actualmente no se encuentran disponibles soluciones de albúmina canina.
Figura 7
Administración de plasma fresco congelado en un paciente canino con parvovirus.
FC: frecuencia cardiaca, FR: frecuencia respiratoria, CRI: perfusión a ritmo constante, PA: presión arterial.
Generalmente, 20 ml/kg de plasma fresco o PFC aumentarían la concentración de albúmina en 0,5 g/dl.5,14,56 Además del aporte de albúmina, el PFC podría proporcionar inmunoglobulinas e inhibidores de las proteasas séricas, que teóricamente pueden neutralizar los virus circulantes y ayudar a controlar el SIRS (aunque esto no se ha podido evidenciar).60 El aumento de permeabilidad endotelial es uno de los factores que aumentan la morbilidad y mortalidad de los pacientes con SIRS y sepsis. La sepsis origina la degradación del glicocálix endotelial, hiperpermeabilidad endotelial, disminución del tono vascular, hipoalbuminemia y alteración de la microcirculación, lo que puede conducir a shock séptico y fallo multiorgánico.61 Algunos estudios apoyan la teoría de que el PFC ayuda a reducir la hiperpermeabilidad vascular, restaura parcialmente el daño del glicocálix y disminuye la expresión de marcadores de hiperpermeabilidad endotelial.62-65
El tratamiento con coloides sintéticos es controvertido;1,2,14,66 pueden ser útiles para la resucitación y para aumentar la presión oncótica, pero por otra parte están contraindicados en pacientes sépticos (medicina humana), situación que puede darse en animales con parvovirosis. En consecuencia, no deberían administrarse si el paciente está séptico o si presenta riesgo de fallo renal.66
Los pacientes que tienen anemia secundaria a la diarrea hemorrágica o por endoparasitismo concurrente y que muestren signos clínicos debidos a la anemia deben recibir transfusiones de sangre completa o concentrados de glóbulos rojos.1
Nutrición
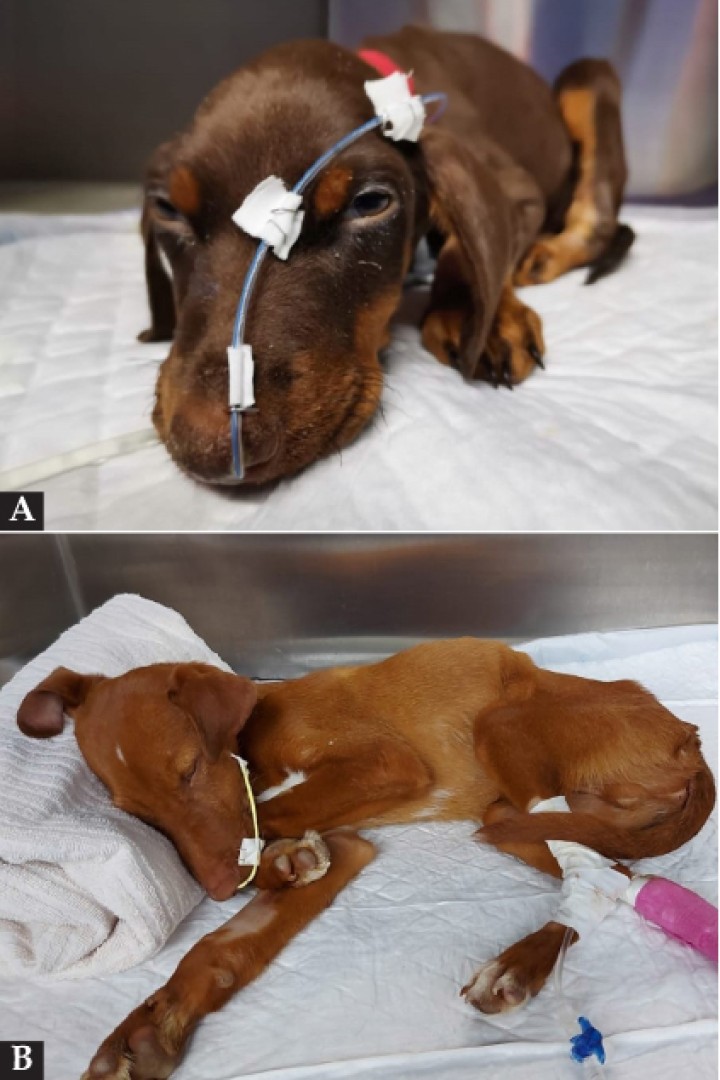
Tradicionalmente se recomendaba un ayuno de 24 a 72 horas en la hospitalización de estos pacientes. Se ha demostrado que la nutrición enteral temprana disminuye la morbilidad y la estancia hospitalaria.1,5,14 Es esencial para prevenir la atrofia de los enterocitos y proporcionar los nutrientes requeridos para la recuperación del paciente. Debido a que la nutrición parenteral se ha asociado a septicemia, alteraciones metabólicas, desequilibrio ácido-base, hiperglucemia, hipertrigliceridemia y desórdenes hepatobiliares,67 la alimentación se administrará preferentemente por vía enteral, mediante la colocación de una sonda de alimentación nasogástrica, que permitirá además succionar el contenido gástrico residual para prevenir problemas ocasionados por sobredistensión (dolor, vómitos/regurgitaciones) (Fig. 8). Un estudio reciente documenta que no existen variaciones en el estado ácido-base de los pacientes con sondas nasogástricas en los que se succiona el contenido gástrico.68
Figura 8
(A) Paciente con sonda de alimentación nasoesofágica de PVC flexible y radiopaca. (B) Paciente con sonda nasogástrica de poliuretano radiopaco.
Se comenzará la alimentación con un 25-33% del requerimiento energético diario del paciente, administrándolo en bolos intermitentes o en infusión continua (CRI) con la ayuda de bombas de infusión (iniciar con 0,2-0,5 ml/kg/h). Si los vómitos no se controlan, se debería instaurar nutrición parenteral, ya sea total o parcial.1,5,14
Antibióticos
Los pacientes con enteritis por parvovirus tienen un alto riesgo de translocación bacteriana. Se recomienda la administración de antibióticos de amplio espectro en estos pacientes cuando cumplen con al menos dos de los criterios de SIRS: temperatura <37,8 ºC o >39,4 °C, taquicardia, taquipnea, leucocitos <6000 o >16 000 células/μl o más del 3% de neutrófilos en banda.16 Se aconseja también en presencia de diarreas hemorrágicas persistentes. Los protocolos antibióticos utilizados son variados, no existiendo un consenso de utilización a nivel mundial. Por lo general, se utilizan β-lactámicos (p. ej., ampicilina 22 mg/kg IV TID; amoxicilina-ácido clavulánico 20 mg/kg IV TID; cefazolina 20 mg/kg IV TID), solos o en combinación con una fluoroquinolona (enrofloxacina 5 mg/kg IV SID; marbofloxacino 2 mg/kg IV SID).5,49,54 Esta combinación proporcionará una cobertura adecuada frente a bacterias que pueden translocarse desde el intestino.14 Las fluoroquinolonas se han asociado con anormalidades en el desarrollo del cartílago en pacientes en crecimiento (suspender si hay inflamación articular).14,52 En casos severos, puede añadirse metronidazol (10 mg/kg IV lento en 20 minutos BID) para aumentar la cobertura anaerobia.1,5,14
Antiparasitarios
Las coinfecciones con parásitos intestinales pueden exacerbar la enteritis parvovírica, por lo que si procede debe instaurarse un tratamiento antiparasitario vía oral en cuanto cesen los vómitos,5,6,49 mientras se esperan los resultados del análisis coprológico.
Antieméticos
Los vómitos en estos pacientes están causados por la destrucción de las criptas intestinales, la motilidad intestinal alterada y la activación de la cascada de las citoquinas inducida por las endotoxinas, que produce una irritación local y una activación del centro del vómito y de la zona gatillo quimiorreceptora. Los vómitos persistentes agravan la pérdida de fluidos y electrolitos, interfieren con el soporte nutricional y retrasan la administración oral de fármacos. Los antieméticos que se pueden utilizar son: ondansetrón (0,5 mg/kg IV cada 8 h) y/o maropitant (1 mg/kg IV cada 24 h) y/o metoclopramida (0,5 mg/kg IV cada 8 h o 1-2 mg/kg/día CRI) aunque esta última debe evitarse con hipermotilidad intestinal o sospecha de obstrucción mecánica.5,69 Se pueden añadir protectores digestivos (omeprazol, pantoprazol, sucralfato).70
Analgesia
Es frecuente el dolor abdominal en estos pacientes producido por los vómitos y el íleo. Los analgésicos opioides pueden favorecer el vómito y el íleo, por lo que se elegirán agonistas parciales como la buprenorfina (0,01-0,02 mg/kg/8 h). La lidocaína a dosis de 15-30 µg/kg/min IV en infusión continua puede proporcionar efecto analgésico y sin alterar el peristaltismo intestinal.5 El maropitant proporciona también analgesia visceral.71 Deben evitarse aquellos fármacos que pueden disminuir la perfusión gastrointestinal, como los alfa-2 adrenérgicos y los AINEs.4,5
Otros tratamientos
Antivirales
Oseltamivir
Se trata de un antiviral, inhibidor de la neuraminidasa, utilizado para el tratamiento de la influenza humana. Aunque algún estudio en perros con parvovirus documenta un aumento de peso y un mantenimiento de los recuentos de glóbulos blancos sanguíneos, no existen estudios documentados en los que se describa una disminución de la morbilidad, disminución del tiempo de hospitalización o disminución de la mortalidad.72
Interferón
Algunos estudios antiguos muestran que el interferón omega felino disminuye la incidencia de fiebre, vómitos, diarrea y mortalidad y mejora el apetito. No se han asociado efectos secundarios a su utilización, pero su uso está limitado principalmente por su alto coste.1,5,14,73 El empleo de interferón-ω de uso en humanos parece prometedor.73
Plasma hiperinmune
Tradicionalmente se postulaba que la administración de plasma hiperinmune (procedente de perros inmunizados frente a CPV) mejoraba la supervivencia y reducía los vómitos en perros con parvovirosis inducida de forma experimental.74,75 Otros autores describen que una dosis única de plasma hiperinmune no es eficaz para mejorar los signos clínicos o acelerar la recuperación hematológica en perros con infección natural por parvovirus.76 Posteriormente, se ha descrito que su administración no reduce la viremia, la duración de la hospitalización ni aumenta la supervivencia, aunque sí que mejora los marcadores de shock en las primeras 24 h de hospitalización.65
Factor estimulante de colonias de granulocitos
La leucopenia en estos pacientes contribuye de forma importante al aumento de morbilidad y mortalidad por la bacteriemia asociada. El aumento de las concentraciones de factor estimulante de colonias de granulocitos canino (G-CSF) mejora el recuento de glóbulos blancos en estudios experimentales, pero los estudios son poco concluyentes con respecto a la mejora en la supervivencia de los pacientes.77,78
Probióticos
Estos pacientes presentan una importante disbiosis de la microbiota intestinal,9 por lo que podría estar indicado el uso de probióticos.80 Algunos estudios sugieren que la administración de probióticos mejora el grado de hidratación, la incidencia de vómitos y diarrea, el fecal score y el apetito, aunque otros no muestran beneficios con respecto a la estancia hospitalaria ni en la mortalidad.80
Trasplante fecal
Estudios recientes sugieren que la administración intrarrectal de 10 gramos de heces de un donante canino sano diluido en 10 ml de ClNa 0,9 % estéril mejora la diarrea, disminuye la estancia hospitalaria y aumenta la supervivencia.1,5
Antioxidantes
Se ha descrito que la adición de n-acetilcisteína al tratamiento convencional del parvovirus mejora el estrés oxidativo que presentan estos pacientes y contribuye a mejorar el recuento leucocitario.81
Tratamientos ambulatorios
Se han descrito tratamientos ambulatorios tras la estabilización del paciente, normalización de los parámetros de perfusión y control de vómitos, con tasas de éxito variables.5,82
Prevención
Una vacunación efectiva es esencial para la protección individual y para poder llegar a alcanzar la “inmunidad de rebaño”. Las guías actuales de vacunación para perros y gatos establecidas por la “World Small Animal Veterinary Association” recomiendan la primera dosis entre las 6 y las 8 semanas de vida y, después, cada 2-4 semanas hasta como mínimo las 16 semanas de edad y, a continuación, a los 6-12 meses, con dosis de recuerdo cada 3 años (esto puede variar en colectividades).83
Conclusión
A pesar de la disponibilidad de vacunas seguras y eficaces, la enteritis por parvovirus es una de las principales causas de morbilidad y mortalidad en cachorros caninos, y de presentación frecuente en clínica de urgencias. Aunque el diagnóstico suele ser sencillo (sospecha clínica unida a resultados positivos de tests rápidos en el propio centro veterinario), el tratamiento sigue siendo un desafío, ya que, en pacientes graves, constituye una terapia de soporte intensiva y costosa. Futuros estudios deberían ir dirigidos a mejorar y unificar los protocolos de tratamiento y factores de pronóstico. El desarrollo de terapias antivirales efectivas o que incrementen la inmunidad ante el virus podrían resultar de ayuda en estos pacientes. Además, sería de gran utilidad investigar en profundidad si algunos aparentes fallos en la vacunación son debidos a las propias vacunas (p. ej., inmunogenicidad reducida ante nuevas variantes) o bien a deficiencias en los protocolos de vacunación.
Fuente de financiación: este trabajo no se realizó con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran la inexistencia de conflicto de intereses.
Bibliografía
- 1.
Tuteja D, Banu K, Mondal B. Canine parvovirology-a brief updated review on structural biology, occurrence, pathogenesis, clinical diagnosis, treatment and prevention. Comp Immunol Microbiol Infect Dis 2022; 82: 1-15.
[pubMed] - 2.
Kennedy M, Odunayo A. Canine Parvovirus | Clinician’s Brief 2017.
- 3.
Sullivan LA. Parvoviral enteritis: What’s New? Adv Small Anim Med Surg 2019; 32(11): 1-3.
[pubMed] - 4.
Mia MdM, Hasan M. Update on Canine Parvovirus Infection: A Review from the Literature. Veterinary Sciences: Research and Reviews 2021; 7(2): 92-100.
- 5.
Mazzaferro EM. Update on canine parvoviral enteritis.Vet Clin North Am Small Anim Pract 2020; 50(6): 1307-1325.
[pubMed] - 6.
Penelo S. Estudio y caracterización de cepas de parvovirus canino en España. Tesis Doctoral. Universidad Complutense de Madrid; 2016.
- 7.
Capozza P, Martella V, Buonavoglia C, Decaro N. Emerging parvoviruses in domestic cats. Viruses 2021; 13(6): 1077-1088.
[pubMed] - 8.
Barrs VR. Feline Panleukopenia: A Re-emergent Disease. Vet Clin North Am Small Anim Pract 2019; 49(4): 651-670.
[pubMed] - 9.
Decaro N, Buonavoglia C, Barrs VR. Canine parvovirus vaccination and immunisation failures: Are we far from disease eradication? Vet Microbiol 2020; 247: 108760.
[pubMed] - 10.
Temeeyasen G, Sharafeldin TA, Lin CM, Hause BM. Spillover of canine parvovirus type 2 to pigs, South Dakota, USA, 2020. Emerg Infect Dis 2022; 28(2): 471-473.
[pubMed] - 11.
Kimpston CN, Hatke AL, Castelli B, et al. High prevalence of antibodies against canine parvovirus and canine distemper virus among coyotes and foxes from Pennsylvania: Implications for the intersection of companion animals and wildlife. Microbiol Spectr 2022; 10(1): 1-5.
[pubMed] - 12.
Mwalongo O, Shahada F, Bigambo M, Gwakisa P, Lankester F. Host range and prevalence of canine parvovirus CPV-2a and 2b strains in wild carnivores of the Serengeti-Maasai Mara ecosystem in Tanzania. Journal of Research and Development (MJRD) 2022; 1(7): 343-353.
- 13.
Voorhees IEH, Lee H, Allison AB, et al. Limited intrahost diversity and background evolution accompany 40 years of canine parvovirus host adaptation and spread. J Virol 2020; 94: 1162-1181.
[pubMed] - 14.
Mylonakis M, Kalli I, Rallis T. Canine parvoviral enteritis: an update on the clinical diagnosis, treatment, and prevention. Vet Med (Auckl) 2016; 7: 91-100.
[pubMed] - 15.
Kelman M, Norris JM, Barrs VR, Ward MP. A history of canine parvovirus in Australia: what can we learn? Aust Vet J 2020; 98(10): 504-510.
[pubMed] - 16.
Alves F, Prata S, Nunes T, et al. Canine parvovirus: A predicting canine model for sepsis. BMC Vet Res 2020; 16(1): 199.
[pubMed] - 17.
Marenzoni ML, Momesso M, Marchesi MC, et al. When the diagnosis of parvovirus in dogs and cats becomes challenging. Vet Ital 2020; 56(2): 67-76.
[pubMed] - 18.
Favrot C, Olivry T, Dunston SM, Degorce-Rubiales F, Guy JS. Parvovirus infection of keratinocytes as a cause of canine erythema multiforme. Vet Pathol 2000; 37(6): 647-649.
[pubMed] - 19.
Woldemeskel M, Liggett A, Ilha M, Saliki JT, Johnson LP. Canine parvovirus-2b-associated erythema multiforme in a litter of english setter dogs. Vet Diagn Invest 2011; 23(3): 576-580.
[pubMed] - 20.
Somporn L, Piewbang C, Wardhani SW. Molecular detection of feline panleukopenia virus and canine parvovirus in the rabies-negative brain of cats and dogs. Thai J Vet Med 2020; 50(suppl): 120-122.
- 21.
Lakhdhir S, Viall A, Alloway E, et al. Clinical presentation, cardiovascular findings, etiology, and outcome of myocarditis in dogs: 64 cases with presumptive antemortem diagnosis (26 confirmed postmortem) and 137 cases with postmortem diagnosis only (2004-2017). J Vet Cardiol 2020; 30: 44-56.
[pubMed] - 22.
Clegg SR, Coyne KP, Dawson S, et al. Canine parvovirus in asymptomatic feline carriers. Vet Microbiol 2012; 157(1-2): 78-85.
[pubMed] - 23.
Clegg SR, Coyne KP, Parker J, et al. Molecular epidemiology and phylogeny reveal complex spatial dynamics in areas where canine parvovirus is endemic. J Virol 2011; 85(15): 7892-7899.
[pubMed] - 24.
Walter-Weingärtner J, Bergmann M, Weber K, et al. Comparison of eight commercially available faecal point-of-care tests for detection of canine parvovirus antigen. Viruses 2021; 13(10): 2080.
[pubMed] - 25.
Decaro N, Desario C, Elia G, et al. Occurrence of severe gastroenteritis in pups after canine parvovirus vaccine administration: A clinical and laboratory diagnostic dilemma. Vaccine 2007; 25(7): 1161-1166.
[pubMed] - 26.
Desario C, Decaro N, Campolo M, et al. Canine parvovirus infection: Which diagnostic test for virus? J Virol Methods 2005; 126(1-2): 179-185.
[pubMed] - 27.
Decaro N, Desario C, Beall MJ, et al. Detection of canine parvovirus type 2c by a commercially available in-house rapid test. Vet J 2010; 184(3): 373-375.
[pubMed] - 28.
Freisl M, Speck S, Truyen U, et al. Faecal shedding of canine parvovirus after modified-live vaccination in healthy adult dogs. Vet J 2017; 219: 15-21.
[pubMed] - 29.
Proksch AL, Unterer S, Speck S, Truyen U, Hartmann K. Influence of clinical and laboratory variables on faecal antigen ELISA results in dogs with canine parvovirus infection. Vet J 2015; 204(3): 304-308.
[pubMed] - 30.
Goddard A, Leisewitz AL, Christopher MM, Duncan NM, Becker PJ. Prognostic usefulness of blood leukocyte changes in canine parvoviral enteritis. J Vet Intern Med 2008; 22(2): 309-316.
[pubMed] - 31.
Eregowda CG, De UK, Singh M, et al. Assessment of certain biomarkers for predicting survival in response to treatment in dogs naturally infected with canine parvovirus. Microb Pathog 2020; 149: 104485.
[pubMed] - 32.
du Preez K, Rautenbach Y, Hooijberg EH, Goddard A. Oxidative burst and phagocytic activity of phagocytes in canine parvoviral enteritis. J Vet Diagn Invest 2021; 33(5): 884-893.
[pubMed] - 33.
Das G, Narayan Meena ARS S, Khare RK. Clinical and haemato-biochemical changes in canine parvovirus infection. Journal of Pharmacognosy and Phytochemistry 2020; 9(4): 1601-1604.
- 34.
Shah SA, Sood NK, Wani N, Gupta K, Singh A. Haemato-biochemical changes in canine parvoviral infection. Indian J Vet Pathol 2013; 37(2): 131-133.
- 35.
Terzungwe M. Hematological parameters of dogs infected with canine parvovirus enteritis in Sumy Ukraine. World Journal of Innovative Research 2018; 5(3): 262462.
- 36.
Whitehead Z, Goddard A, Botha WJ, Pazzi P. Haemostatic changes associated with fluid resuscitation in canine parvoviral enteritis. J S Afr Vet Assoc 2020; 91(0): e1-e9.
[pubMed] - 37.
Kumar R, Kumar B, Kumar S, Singh MK, Kumar R. Study of biochemical parameter in canine parvovirus infected canines. J Phar Innov 2020; 9(4): 40-43.
- 38.
Chalifoux NV, Parker SE, Cosford KL. Prognostic indicators at presentation for canine parvoviral enteritis: 322 cases (2001-2018). J Vet Emerg Crit Care 2021; 31(3): 402-413.
[pubMed] - 39.
Petini M, Drigo M, Zoia A. Prognostic value of systemic inflammatory response syndrome and serum concentrations of acute phase proteins, cholesterol, and total thyroxine in cats with panleukopenia. J Vet Intern Med 2020; 34(2): 719-724.
[pubMed] - 40.
Fernandez NJ, Kidney BA. Alkaline phosphatase: beyond the liver. Vet Clin Pathol 2007; 36(3): 223-233.
[pubMed] - 41.
Vyroubal P, Chiarla C, Giovannini I, et al. Hypocholesterolemia in clinically serious conditions-review. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2008; 152(2): 181-189.
[pubMed] - 42.
Yilmaz Z, Senturk S. Characterisation of lipid profiles in dogs with parvoviral enteritis. J Small Anim Pract 2007; 48(11): 643-650.
[pubMed] - 43.
Viall AK, McNamee AL, Olsen LE, Deitz KL, Hostetter SJ. Prognostic value of dyslipidemia for sick dogs hospitalized in the intensive care unit of a veterinary teaching hospital. J Am Vet Med Assoc 2019; 254(6): 699-709.
[pubMed] - 44.
Venn EC, Barnes AJ, Hansen RJ, et al. Serum D-lactate concentraalions in dogs with parvoviral enteritis. J Vet Intern Med 2020; 34(2): 691-699.
[pubMed] - 45.
Oikonomidis IL, Theodorou K, Papaioannou E, et al. Serial measurement of thyroid hormones in hospitalised dogs with canine parvoviral enteritis: Incidence of non-thyroidal illness syndrome and its association with outcome and systemic inflammatory response syndrome. Vet J 2021; 274: 105715.
[pubMed] - 46.
Engelbrecht M, Botha WJ, Pazzi P, McClure V, Hooijberg E. Serum cobalamin concentrations in dogs infected with canine parvoviral enteritis. J Am Vet Med Assoc 2022: 260 (7): 1-8.
[pubMed] - 47.
Naseri A, Gulersoy E, Durgut K, et al. Serum biomarkers of endothelial glycocalyx injury in canine parvoviral infection. Austral Journal of Veterinary Sciences 2020; 52 (3): 95-101.
- 48.
Gerlach M, Proksch AL, Dörfelt R, Unterer S, Hartmann K. Therapy of canine parvovirus infection-review and current insights. Tierarztl Prax Ausg K Kleintiere Heimtiere 2020; 48(1): 26-37.
[pubMed] - 49.
Lambert, A. Canine and Feline parvovirus infection. En Ettinger S, Feldman E, Côté E. Textbook of Veterinary Internal Medicine. 8th ed.; 2017 Vol 2., capítulo 225: pp2478-2488.
- 50.
Fragío Arnold C. Fluidoterapia en patologías digestivas. En Fragío Arnold, C: Manual de Fluidoterapia En Pequeños Animales. Multimédica ediciones veterinarias.; 2018, capítulo 8: pp317-322.
- 51.
Crisi PE, de Santis F, Aste G, et al. Inflammatory, Mechanical and Infectious Complications Associated with Peripheral Intravenous Catheters in Dogs and Cats: A Risk Factor Analysis. Vet Sci 2022; 9(3): 118.
[pubMed] - 52.
Goddard A, Leisewitz AL. Canine parvovirus. Vet Clin North Am Small Anim Pract 2010; 40(6): 1041-1053.
[pubMed] - 53.
Davis H, Jensen T, Johnson A, et al. 2013 AAHA/AAFP fluid therapy guidelines for dogs and cats. J Am Anim Hosp Assoc 2013; 49(3): 149-159.
[pubMed] - 54.
Barr M. Canine Viral Enteritis. En: Bruyette D, Bexfield N, Chretin J, et al., Clinical Small Animal Internal Medicine. Vol 2. 1st ed. John Wiley & Sons, Inc.; 2020;857-860.
- 55.
ALHosary A. Prevalence of parvovirus infection in household dogs with special reference to its effects on some blood parameters. Alexandria Journal for Veterinary Sciences 2016; 51(2): 174.
- 56.
Mazzaferro EM, Edwards T. Update on albumin therapy in critical illness. Vet Clin North Am Small Anim Pract 2020; 50(6): 1289-1305.
[pubMed] - 57.
Mazzaferro EM, Balakrishnan A, Hackner SG, et al. Delayed type III hypersensitivity reaction with acute kidney injury in two dogs following administration of concentrated human albumin during treatment for hypoalbuminemia secondary to septic peritonitis. J Vet Emerg Crit Care 2020; 30(5): 574-580.
[pubMed] - 58.
Fragío C, Daza MA, García E. Transfusiones sanguíneas en perros y gatos. Clin Vet Peq Anim 2009; 29(4): 229-238.
- 59.
Martin LG, Lucher TY, Alperin DC, Gay JM, Hines SA. Serum antibodies against human albumin in critically ill and healthy dogs. J Am Vet Med Assoc 2008; 232: 1004-1009.
[pubMed] - 60.
Macintire DK, Smith-Carr S. Canine parvovirus. Part II. Clinical signs, diagnosis, and treatment. Compend Contin Educ Vet 1997; 19(3): 291-302.
- 61.
Chelazzi C, Villa G, Mancinelli P, de Gaudio AR, Adembri C. Glycocalyx and sepsis-induced alterations in vascular permeability. Critical Care 2015; 19(1): 26.
[pubMed] - 62.
Schött U, Solomon C, Fries D, Bentzer P. The endothelial glycocalyx and its disruption, protection and regeneration: A narrative review. Scand J Trauma Resusc Emerg Med 2016; 24(1): 48.
[pubMed] - 63.
Peng Z, Pati S, Potter D, et al. Fresh frozen plasma lessens pulmonary endothelial inflammation and hyperpermeability after hemorrhagic shock and is associated with loss of syndecan 1. Shock 2013; 40(3): 195-202.
[pubMed] - 64.
Pati S, Matijevic N, Doursout MF, et al. Protective effects of fresh frozen plasma on vascular endothelial permeability, coagulation, and resuscitation after hemorrhagic shock are time dependent and diminish between days 0 and 5 after thaw. J Trauma 2010; 69(1): 55-63.
[pubMed] - 65.
Acciacca RA, Sullivan LA, Webb TL, Johnson V, Dow SW. Clinical evaluation of hyperimmune plasma for treatment of dogs with naturally occurring parvoviral enteritis. J Vet Emerg Crit Care 2020; 30(5): 525-533.
[pubMed] - 66.
Adamik KN, Yozova ID. Colloids Yes or No? - a “Gretchen Question” Answered. Front Vet Sci 2021; 8: 624049.
[pubMed] - 67.
Flores Dueñas CA, Gaxiola Camacho SM, Montaño Gómez MF, et al. The effect of short term peripheral parenteral nutrition on treatment outcomes and mortality in critically ill pediatric canine patients. Ir Vet J 2021; 74(1): 15.
[pubMed] - 68.
Chih A, Rudloff E, Waldner C, Linklater AKJ. Incidence of hypochloremic metabolic alkalosis in dogs and cats with and without nasogastric tubes over a period of up to 36 hours in the intensive care unit. J Vet Emerg Crit Care 2018; 28(3): 244-251.
[pubMed] - 69.
Yalcin E, Keser GO. Comparative efficacy of metoclopramide, ondansetron and maropitant in preventing parvoviral enteritis-induced emesis in dogs. J Vet Pharmacol Ther 2017; 40(6): 599-603.
- 70.
Marks SL, Kook PH, Papich MG, Tolbert MK, Willard MD. ACVIM consensus statement: Support for rational administration of gastrointestinal protectants to dogs and cats. J Vet Intern Med 2018; 32(6): 1823-1840.
[pubMed] - 71.
Marquez M, Boscan P, Weir H, Vogel P, Twedt DC. Comparison of nk-1 receptor antagonist (maropitant) to morphine as a pre-anaesthetic agent for canine ovariohysterectomy. PLoS One 2015; 10(10): e0140734.
[pubMed] - 72.
Savigny MR, Macintire DK. Use of oseltamivir in the treatment of canine parvoviral enteritis. J Vet Emerg Crit Care 2010; 20(1): 132-142.
[pubMed] - 73.
Mueller RS, Hartmann K. Interferon therapies in small animals. Vet J 2021; 271: 105648.
[pubMed] - 74.
Ishibashi K, Maede Y, Ohsugi T, Onuma M, Mikami T. Serotherapy for dogs infected with canine parvovirus. Nihon Juigaku Zasshi 1983; 45(1): 59-66.
[pubMed] - 75.
Meunier PC, Cooper BJ, Appel MJG, Lanieu ME, Slauson DO. Pathogenesis of canine parvovirus enteritis: sequential virus distribution and passive immunization studies. Vet Pathol 1985; 22(6): 617-624.
[pubMed] - 76.
Bragg R, Duffy A, DeCecco F, et al. Clinical evaluation of a single dose of immune plasma for treatment of canine parvovirus infection. J Am Vet Med Assoc 2012; 40(6): 700-704.
[pubMed] - 77.
Muñoz AI, Vallejo-Castillo L, Fragozo A, et al. Increased survival in puppies affected by Canine Parvovirus type II using an immunomodulator as a therapeutic aid. Sci Rep 2021; 11(1): 19864.
[pubMed] - 78.
Armenise A, Trerotoli P, Cirone F, et al. Use of recombinant canine granulocyte-colony stimulating factor to increase leukocyte count in dogs naturally infected by canine parvovirus. Vet Microbiol 2019; 231: 177-182.
[pubMed] - 79.
Park JS, Guevarra RB, Kim BR, et al. Intestinal microbial dysbiosis in beagles naturally infected with canine parvovirus. J Microbiol Biotechnol 2019; 29(9): 1391-1400.
[pubMed] - 80.
Schmitz SS. Value of probiotics in canine and feline gastroenterology. Vet Clin North Am Small Anim Pract 2021; 51(1): 171-217.
[pubMed] - 81.
Gaykwad C, Garkhal J, Chethan GE, Nandi S, De UK. Amelioration of oxidative stress using N-acetylcysteine in canine parvoviral enteritis. J Vet Pharmacol Ther 2018; 41(1): 68-75.
[pubMed] - 82.
Perley K, Burns CC, Maguire C, et al. Retrospective evaluation of outpatient canine parvovirus treatment in a shelter-based low-cost urban clinic. J Vet Emerg Crit Care 2020; 30(2): 202-208.
[pubMed] - 83.
Day MJ, Horzinek MC, Schultz RD, Squires RA. WSAVA guidelines for the vaccination of the dogs and cats. J Small Anim Pract 2016; 57(1): E1-E45.
[pubMed]