Manejo anestésico del paciente con patología cardiaca adquirida
Anaesthetic management of the patient with acquired cardiac pathology
A. Martinez-Albiñana, Q. Plaza-del Castaño, N. Aguilar-Gallego, P. Fernandez-Rodriguez, J. Viscasillas-Monteagudo
Contacto: agustin.martinez@anicura.es
Resumen
La anestesia del paciente con patología cardiaca es frecuente en nuestra clínica diaria. Es por ello que en este manuscrito pretendemos abordar los conceptos hemodinámicos básicos de estos pacientes, así como las consideraciones anestésicas subyacentes para que el lector pueda enfrentarse a la anestesia de las principales patologías cardiacas adquiridas.
Palabras clave: anestesia, cardiología, gasto cardiaco, perfusión.
Clin Vet Peq Anim 2022, 42 (3): 169-179
Summary
Anaesthesia for patients with cardiac conditions is common in our daily clinic. In this manuscript we intend to address the basic haemodynamic concepts of these patients, as well as their underlying anaesthetic considerations so that the reader can face the anaesthesia of the main acquired cardiac conditions.
Keywords: anaesthesia, cardiology, cardiac output, perfusion.
Clin Vet Peq Anim 2022, 42 (3): 169-179

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
Durante cualquier procedimiento anestésico los objetivos cardiovasculares son el mantenimiento del suministro de oxígeno y nutrientes a todos los tejidos, la recogida de los productos de desecho y, en general, el mantenimiento de la homeostasis. Pero conseguir estos objetivos puede volverse un verdadero desafío en pacientes con enfermedad cardiovascular subyacente.
En pacientes con enfermedad cardiovascular, la optimización del suministro de oxígeno requiere entender la fisiopatología de la enfermedad cardiaca que presenten. Cada patología cardiaca genera unas características clínicas específicas, al igual que el grado de severidad de la misma, la cual puede dar lugar a pacientes compensados y descompensados.1
En los pacientes cardiópatas es importante dominar el uso de fármacos anestésicos y las herramientas de monitorización disponibles, con el fin de equilibrar la fisiopatología de la enfermedad con los efectos de los fármacos anestésicos. En último término, se debe individualizar en cada paciente un plan anestésico que minimice el compromiso cardiovascular.
La presente revisión bibliográfica pretende abordar los conceptos hemodinámicos básicos, navegando por las diferentes fases de la anestesia (valoración preanestésica, premedicación, inducción, mantenimiento y recuperación) y, por último, desarrollar los puntos clave en la anestesia de las principales patologías cardiacas. La finalidad de este escrito es que el lector pueda manejarse con comodidad en la anestesia de estos pacientes.
Conceptos hemodinámicos básicos
Para ayudar al lector a comprender la repercusión de la anestesia en ciertas patologías cardiacas, es importante incidir en algunos conceptos básicos sobre la fisiología y hemodinámica cardiovascular.
El gasto cardiaco (GC), que por lo general se expresa en mililitros por minuto (ml/min), se define como el volumen de sangre eyectado por el corazón (normalmente se simplifica hablando del ventrículo izquierdo) en un minuto. El GC también puede encontrarse en la bibliografía como “Volumen minuto sanguíneo”.
El GC, por lo tanto, puede determinarse de manera simplificada con la siguiente fórmula: GC= Volumen sistólico x Frecuencia cardiaca.
El volumen sistólico (VS), medido en mililitros, puede definirse como el volumen de sangre eyectado en cada ciclo cardiaco y es susceptible de ser estimado mediante ecocardiografía.
Debemos tener en cuenta también que la presión arterial (PA) depende directamente del GC y de la resistencia vascular periférica (RVP), siguiendo la siguiente fórmula: PA= GC x RVP.
Los pacientes que presentan una patología cardiaca verán reducido su GC, lo que se traducirá en un descenso de la PA. Este suceso hará que se pongan en marcha mecanismos compensatorios que serán beneficiosos a corto plazo, aunque más tarde se transformarán en descompensatorios y, finalmente, serán los responsables de la sintomatología de insuficiencia cardiaca.2
La caída de la PA será detectada en los barorreceptores (principalmente aórticos y carotídeos), lo cual generará un estímulo del sistema nervioso autónomo simpático que conduce a la liberación de catecolaminas (adrenalina y noradrenalina). Esto generará vasoconstricción, aumento de la frecuencia cardiaca y aumento de la contractilidad cardiaca.
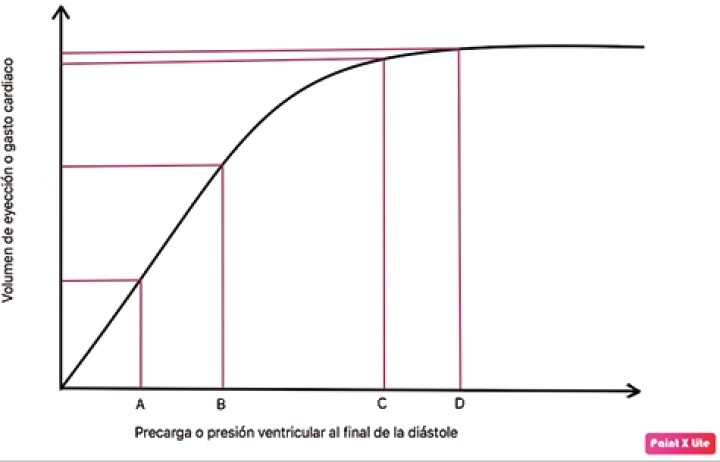
La caída de la PA también será detectada en el aparato yuxtaglomerular del riñón, activando el sistema renina-angiotensina-aldosterona, el cual generará un aumento de la vasoconstricción, retención de sodio, cloro y, por ende, agua. De esta manera, por medio de la vasoconstricción y el aumento de la volemia, el organismo tiende a la elevación de la presión arterial y el retorno venoso (precarga cardiaca). El incremento de la precarga cardiaca busca un aumento de la contractilidad, mediada por la ley de Frank- Starling (Fig. 1) aunque esta solo se dará en el área dependiente de volemia, observado en la línea hasta alcanzar el punto C.
Figura 1
La curva de Frank-Starling relaciona precarga con volumen sistólico (VS) y determina dos zonas: zona de precarga-dependencia y zona de precarga-independencia. Un pequeño aumento de precarga en zona de precarga-dependencia (de A hacia B) va a provocar un gran cambio en el VS. Por el contrario, un aumento de precarga en zona de precarga-independencia (de C hacia D) resultará en leves o nulos cambios en el VS.
Para entender cómo los mecanismos compensatorios iniciales pueden volverse negativos para el paciente, abordaremos los siguientes puntos:
- El aumento de la frecuencia cardiaca (FC) reducirá la duración de la diástole, con lo cual disminuirá el tiempo de llenado ventricular y el tiempo de perfusión del miocardio. Además, el aumento de FC y de contractilidad también aumentará la demanda de oxígeno del miocardio, pudiendo incluso generar focos hipóxicos que podrían ocasionar arritmias.
- El aumento del tono vasomotor genera un incremento en la resistencia que debe vencer el músculo cardiaco para poder acortarse (postcarga cardiaca). Este hecho agravará un déficit de volumen sistólico.
- El aumento de la volemia repercutirá en un incremento de la precarga cardiaca de un corazón que no es capaz de bombear toda la sangre que le llega. Esto desencadenará un fenómeno congestivo e incluso edema.
La mayoría de los anestésicos tienen efectos sobre la función autónoma, el tono vascular, la FC y la contractilidad cardiaca, por ello es imprescindible conocer las limitaciones funcionales que va a padecer nuestro paciente y asegurar un protocolo anestésico en el que prevalezca un equilibrio hemodinámico, así como anticiparnos a posibles complicaciones que puedan llegarse a dar durante la anestesia.
Otro aspecto a tener en cuenta durante la anestesia es la tendencia a la hipercoagulabilidad en algunas de estas patologías y un riesgo de tromboembolia asociada a la alteración de la hemodinamia durante la anestesia.
La patología cardiaca también repercutirá en la farmacocinética de los fármacos anestésicos. Entre las principales repercusiones, podemos encontrar las siguientes:
- Atendiendo a la absorción del fármaco podemos decir que la reducción del GC producirá una reducción de esta, a causa de la mala perfusión. Esto podría traducirse en inicios de acción más largos y en efectos algo más impredecibles de los fármacos anestésicos cuando se administran por vía intramuscular o subcutánea. Asimismo, las concentraciones alveolares de los anestésicos inhalatorios se verán incrementadas a causa de una reducción del gasto cardiaco, lo que produce un aumento del tiempo de tránsito de la sangre por los capilares alveolares; esto derivará en una mayor profundidad anestésica.
- En relación con la distribución de los fármacos, debemos tener en cuenta que la reducción del GC conllevará una disminución en el volumen de distribución, lo que se traducirá en un inicio de acción algo más lento. Si el paciente sufre formación de edemas, los fármacos hidrosolubles (como los bloqueantes neuromusculares) verán disminuida su respuesta. Por último, si nuestro paciente padece hipoalbuminemia (resultado de una malabsorción por posible edema intestinal, una pérdida renal de proteínas ante una afección renal secundaria al problema cardiaco, etc.), ello daría lugar a un aumento de la fracción libre de aquellos fármacos con alta unión a proteínas (como, por ejemplo, el propofol, la lidocaína, la alfaxalona, los opioides, etc.).
- La reducción de la perfusión hepática y renal se traducirá en un retraso en el metabolismo y la excreción de los fármacos que, por ende, presentarán una duración de su acción aumentada.
Principios anestésicos en enfermedad cardiovascular
Valoración preanestésica
La mayoría de las complicaciones que pueden surgir durante el procedimiento anestésico son previsibles y en gran número evitables, siendo la valoración preanestésica una herramienta fundamental en el éxito del procedimiento anestésico-quirúrgico, ya que aporta la posibilidad de evaluar todos los aspectos críticos posibles y estar prevenido desde el primer momento.
En la actualidad, no existe un consenso o guía que recomiende cuáles deben ser las pruebas preanestésicas ideales, pero se ha confirmado una mayor probabilidad de mortalidad perioperatoria en pequeños animales cuando los pacientes carecieron de valoración preanestésica.3 Algunos autores sostienen que toda evidencia o sospecha de enfermedad cardiaca o respiratoria debe ser investigada antes de un procedimiento anestésico-quirúrgico por medio de radiografías, electrocardiograma y ecocardiografía.4 Mediante el uso de estas pruebas complementarias se garantiza el conocimiento del estado del paciente, lo que permite tomar las medidas necesarias para disminuir el riesgo del procedimiento.
Exploración física y pruebas preanestésicas
Son múltiples los estudios que evidencian las complicaciones perioperatorias y el riesgo de morbimortalidad en veterinaria.5-8 Previo al procedimiento, se debe realizar un examen físico completo, prestando especial atención a los sistemas cardiovascular y respiratorio. Se debe localizar y caracterizar los soplos cardiacos, los cambios en los sonidos pulmonares, el aumento de frecuencia y esfuerzo respiratorio, color de mucosa y tiempo de relleno de capilar. La presencia de pulso yugular, y las irregularidades o déficits de pulso son indicadores obvios de posible enfermedad cardiaca. El examen físico debería acompañarse de un electrocardiograma, una ecocardiografía9 o una radiología torácica, además de la medición de la PA con el fin de diagnosticar la existencia de cardiopatías y de definir el estado hemodinámico del paciente a intervenir.
Se debe tener en cuenta que una patología cardiaca puede producir un trastorno renal,8 por lo que debería realizarse un análisis sanguíneo completo. Una reducción aguda del GC puede provocar una disminución de la tasa de filtración glomerular, un aumento de la creatinina sérica y de la urea, y una disminución en la producción de orina.10,11
Estabilización previa
La anestesia debe aplazarse en todo paciente recién diagnosticado o inestable con problemas cardiacos, excepto que sea absolutamente necesario. Con el fin de disminuir los riesgos anestésicos, el paciente debería ser estabilizado mediante la medicación adecuada, para posteriormente evaluar de nuevo su estado y así realizar la anestesia si es posible.12
Aquellos pacientes con una insuficiencia cardiaca congestiva (ICC) izquierda con edema pulmonar deberían recibir furosemida (2 mg/kg IV cada 1-2 horas) hasta su estabilización. Los derrames pleurales se drenarán por completo, a ser posible. En aquellos pacientes que presenten ascitis, debe evitarse su drenaje completo, ya que puede dar lugar a un desequilibrio electrolítico e hipoproteinemia. Sin embargo, si la ascitis es grave, el drenaje parcial puede mejorar la ventilación al disminuir la presión sobre el diafragma. La administración intravenosa de pimobendán (0,15-0,3 mg/kg) o la infusión continua de dobutamina (comenzándose a dosis bajas, 1 µg/kg/min, que se va aumentando hasta que el paciente responda) mejoran rápidamente la contractilidad miocárdica. Se recomienda en perros con insuficiencia cardiaca izquierda causada por una cardiomiopatía dilatada o enfermedad de la válvula mitral degenerativa de grado avanzado, y que no hayan recibido previamente pimobendán, o cuando se ha dejado de administrar una dosis oral el día de la anestesia.
Pauta de medicación cardiaca previa a anestesia
Existe controversia sobre si el día de la anestesia deben administrarse los fármacos cardiacos o no. Hay que tener en cuenta que algunos de los fármacos usados para tratar la patología cardiaca tienen efecto vasodilatador, lo que puede provocar hipotensión cuando se administran junto con otros fármacos vasodilatadores.
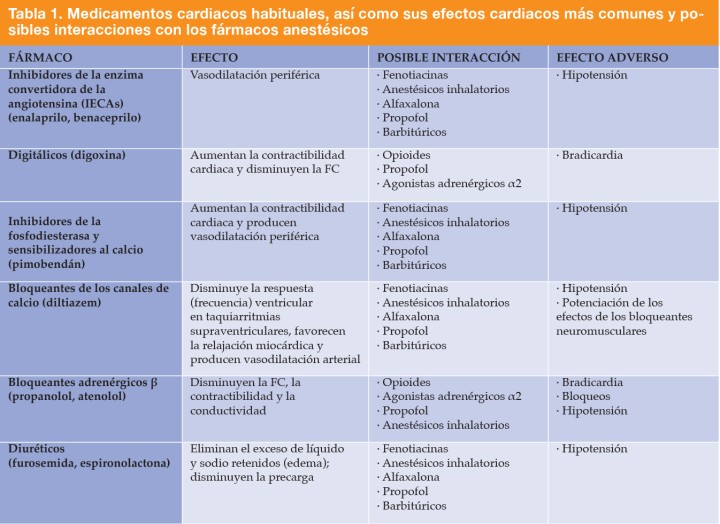
En la Tabla 1, el lector puede encontrar los medicamentos más frecuentemente administrados en el tratamiento de las patologías cardiacas, así como sus efectos secundarios más comunes y las posibles interacciones con los fármacos anestésicos.13
FC: frecuencia cardiaca. Tabla extraída de: Rioja E, Salazar V, Martinez M, Martinez F. Grupo Asis Biomedia. Manual de anestesia y analgesia de pequeños animales con patologías o condiciones específicas. Zaragoza, España, Servet 2016
La guía de la AAHA (American Animal Hospital Association) publicada en 2020 recomienda mantener como medicación cardiaca el pimobendán y la furosemida, y retirar la medicación antihipertensiva 24 horas antes del procedimiento, especialmente los IECA como el enalaprilo o el benazeprilo.14
Premedicación
La premedicación es un paso extremadamente importante porque proporciona sedación, analgesia y una reducción en las dosis de inducción y mantenimiento.15 Debemos tener en cuenta los objetivos para cualquier anestesia en pacientes con enfermedad cardiovascular: mantener una FC fisiológica, evitar deprimir la función miocárdica, mantener el GC, evitar cambios en la PA sistémica, evitar el aumento de la carga de trabajo del miocardio y, por tanto, la demanda de oxígeno, y mantener el suministro de oxígeno.
Hay que considerar que pacientes excitados, que luchen o que presenten miedo van a presentar taquicardia y aumento de la resistencia periférica, de la PA, del trabajo cardiaco y del consumo de oxígeno miocárdico.16 Estos cambios son extremadamente peligrosos en pacientes con enfermedad cardiovascular, y posiblemente provoquen descompensación e insuficiencia cardiaca. Por lo tanto, estos factores de estrés deben evitarse en pacientes con enfermedad cardiovascular y el manejo tranquilo, junto con la administración de una dosis baja de un tranquilizante y analgésico preventivo, es crucial.
La selección del protocolo anestésico se ajustará de manera individualizada al paciente, ya que no existe un protocolo único para todas las patologías cardiacas. Casi todos los fármacos anestésicos comprometen la función cardiovascular a través de uno o varios mecanismos y pueden complicar gravemente el suministro de oxígeno en pacientes con enfermedad cardiaca subyacente.
Inducción
La inducción es una de las fases de mayor riesgo del periodo perianestésico, en la que gran parte de los fármacos inductores producen efectos cardiovasculares adversos que conducen a depresión o vasodilatación miocárdica.
Siempre que no cause estrés al paciente, el equipo de monitorización debe estar conectado antes de la inducción y se debe preoxigenar al paciente al menos 3 minutos, ya que esto prolonga considerablemente el tiempo de desaturación de la hemoglobina y, por tanto, la aparición de hipoxemia.17
El propofol actúa como un vasodilatador dosis-dependiente y puede producir hipotensión significativa incluso en dosis moderadas.18 Mientras que los pacientes con enfermedad cardiaca leve pueden tolerar la hipotensión asociada con el propofol, este debe usarse con precaución en aquellos pacientes con enfermedad más grave o en aquellos en los que una disminución de la presión arterial (producida por la disminución de la resistencia vascular periférica) empeore la función cardiaca.
La alfaxalona no se ha estudiado ampliamente en pacientes con enfermedad cardiovascular, pero la evidencia actual sugiere que los efectos depresivos cardiovasculares son similares a los causados por el propofol.19,20 La coinducción con midazolam logra disminuir la dosis requerida de alfaxolona, pero esta reducción no repercute en una menor depresión cardiovascular.21
El etomidato tiene la gran ventaja de producir una mínima o nula depresión cardiovascular, ya que no cambia la FC, la contractilidad, la postcarga o el retorno venoso. Su administración puede producir flebitis, dolor en el lugar de inyección, ruptura de glóbulos rojos y posible hemólisis, además de supresión adrenocortical temporal (aproximadamente durante 6 horas tras la inducción).22 Proporciona una relajación muscular deficiente y puede estimular mioclonias, por lo que se aconseja administrarlo junto con una benzodiacepina o fentanilo para facilitar una inducción suave.23
La ketamina es un anestésico disociativo cuyos efectos cardiovasculares son resultado de la estimulación del sistema nervioso simpático (SNS), lo que aumenta la FC, la contractilidad y la presión arterial media, con pocos cambios en la resistencia vascular periférica.24 Como consecuencia, produce un aumento del trabajo del miocardio y de la demanda de oxígeno del mismo que se compensa con aumento del GC y del flujo sanguíneo coronario.25 Este aumento de la demanda de oxígeno puede empeorar la función cardiaca o las arritmias, por lo que la ketamina está contraindicada en la miocardiopatía hipertrófica y otras formas de miocardiopatía.26
Los opioides mu-agonistas a dosis altas, y normalmente junto con benzodiacepinas, son eficaces para conseguir la inducción del paciente y permitir la colocación sin complicaciones de un tubo endotraqueal, especialmente en pacientes deprimidos, aunque producen una depresión respiratoria de moderada a severa y bradicardia. A esta técnica se la denomina neuroleptoinducción.
Mantenimiento
Con el fin de disminuir los efectos cardiovasculares causados por los fármacos, se deben emplear técnicas de anestesia multimodal equilibrada, en la que usaremos agentes hipnóticos, analgésicos sistémicos, técnicas de anestesia locorregional y, en algunos casos, bloqueantes neuromusculares. Con el fin de obtener una hemodinamia óptima puede ser necesario utilizar vasopresores, inotrópicos, antiarrítmicos y/o vasodilatadores.
El uso de ventilación con presión positiva intermitente debe realizarse con cautela, instaurándose presiones inspiratorias pico menores de 15 cm H2O. El exceso de presión inspiratoria y la presión positiva al final de la espiración (PEEP) pueden producir una reducción del retorno venoso, con lo que disminuiría el GC y produciría hipotensión, afectando a la perfusión y al aporte de oxígeno a los tejidos.
Los anestésicos inhalatorios son los fármacos comúnmente escogidos para el mantenimiento de la anestesia, pero hay que tener en cuenta que estos deprimen la función cardiovascular, lo que lleva a una disminución de la PA y del GC dosis-dependiente.27 Para minimizar estos efectos secundarios se recomienda aplicar estrategias de reducción de la concentración mínima alveolar (CAM) realizando protocolos de anestesia parcial intravenosa y, si el paciente lo requiere, dando apoyo cardiovascular con el uso de inótropos y vasopresores.
La utilización de anestesia total intravenosa (TIVA) puede también ser una posibilidad para realizar el mantenimiento anestésico en los pacientes con cardiopatías. Se puede utilizar la infusión continua de propofol (0,25 mg/kg/min) y de alfaxalona (0,07 mg/kg/min).28 La infusión continua de etomidato quedaría desaconsejada por la supresión adrenal de larga duración que podría ocasionar.
El uso de infusiones a ritmo constante permite disminuir las concentraciones inspiradas de anestésicos inhalados, reduciendo así su compromiso cardiovascular. Se ha demostrado que el uso de fentanilo a 0,3 µg/kg/min reduce la necesidad de isoflurano en un 50%.29 Las técnicas de anestesia locorregional reducen drásticamente el uso de agentes inhalados y sistémicos, con un compromiso cardiovascular mínimo a dosis apropiadas de anestésico local, lo que conduce a un paciente más estable.30-32
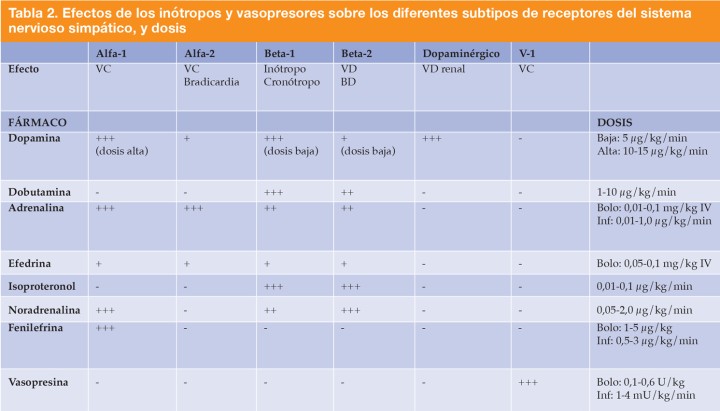
Los fármacos inótropos positivos aumentan la contractilidad miocárdica y se usan para mejorar el volumen de eyección, el GC y la PA. Estos fármacos también tienden a incrementar la FC a medida que se incrementa su dosis (cronótropos positivos). Los fármacos vasopresores incrementan la resistencia vascular periférica, lo cual aumenta la PA. Dependiendo del tipo de patología, estos fármacos estarían indicados o contraindicados (Tabla 2).
VC: vasoconstricción; VD: vasodilatación; BD: broncodilatación; Inf: infusión. Tabla extraída del libro Johnson, Rebecca A., Lindsey BC Snyder, and Carrie A. Schroeder, eds. Canine and Feline Anesthesia and Co-Existing Disease. John Wiley & Sons, 2022.
La fluidoterapia ayuda a mantener el volumen intravascular, el GC y el aporte de oxígeno.33 La velocidad de infusión debe ser suficiente para reemplazar las pérdidas urinarias, de evaporación por las vías respiratorias y sangrado, por lo que un ritmo de 2-3 ml/kg/h podría ser suficiente cuando no existen pérdidas o el sangrado es mínimo. En los pacientes con insuficiencia cardiaca, un aumento de la precarga no genera aumento del GC debido a que la respuesta del miocardio a un mayor estiramiento no es correcta y la presión de llenado a menudo está elevada crónicamente. En estas situaciones se recomienda ser cauto con la cantidad de fluidoterapia para evitar una sobrecarga.
Recuperación
Durante la fase de recuperación se debe continuar con la monitorización del paciente. Los parámetros a controlar son las variables hemodinámicas (FC, PA, pulso y color mucosas), además de la temperatura.
Puede que el paciente necesite ser suplementado con oxígeno, con fluidos o mantener algunos fármacos como inótropos o fármacos antiarrítmicos.
El control analgésico postoperatorio es otro pilar fundamental en todo paciente sometido a cirugía, ya que el dolor puede estimular el sistema nervioso simpático y alterar las variables hemodinámicas.
Enfermedades cardiovasculares adquiridas
Enfermedad degenerativa de la válvula mitral
Se trata de la enfermedad cardiaca más frecuente en el paciente canino, suponiendo aproximadamente un 75 % de las cardiopatías.34 Podemos hablar de ella como una enfermedad idiopática, hereditaria y degenerativa de la válvula atrioventricular izquierda que podría llevar a generar insuficiencia valvular (Figs. 2 y 3).
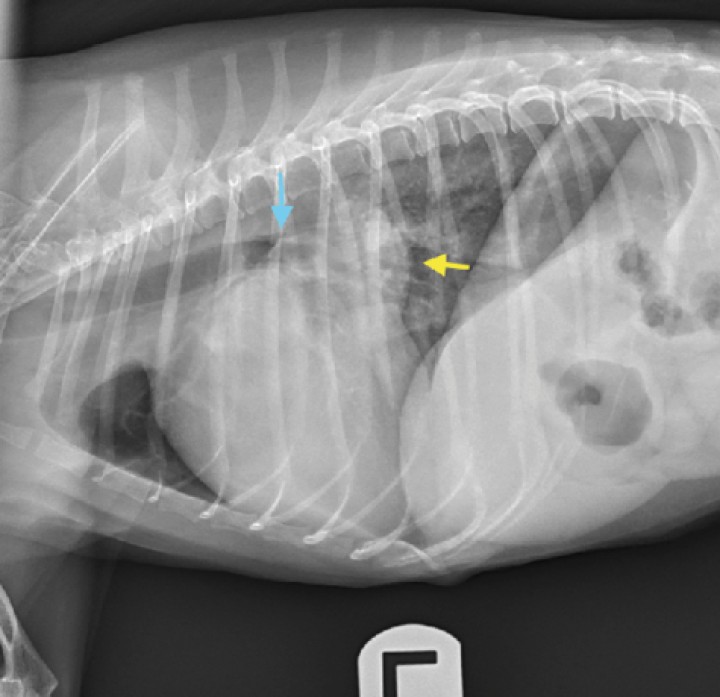
Figura 2
Radiografía lateral izquierda de un perro con cardiomegalia (VHS = 12,5 CV) y dilatación de atrio izquierdo. Se observa un aumento de opacidad de tejido blando entre las 12 y las 2 de la silueta cardiaca, según la cronología del reloj, compatible con un aumento del tamaño del atrio izquierdo (flecha amarilla). Se observa además el desplazamiento dorsal de la tráquea, así como la compresión del bronquio principal izquierdo (flecha azul). VHS: Vertebral Heart Score; CV: cuerpos vertebrales.
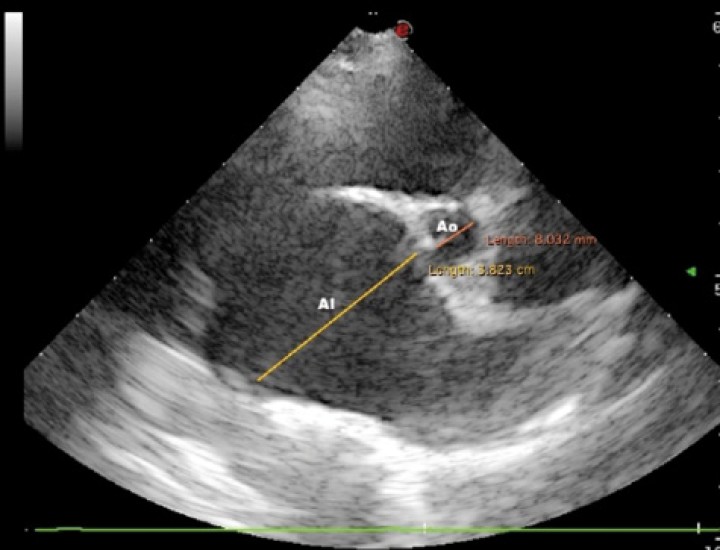
Figura 3
Imagen ecocardiográfica paraesternal derecha en eje corto a la altura de la base cardiaca en la que se observa un aumento del ratio atrio izquierdo/aorta (AI/Ao= 4,76; normal <1,6). AI: atrio izquierdo; Ao: Aorta.
Atendiendo a su fisiopatología, el cierre incompleto de la válvula resulta en una regurgitación del ventrículo izquierdo (VI) hacia el atrio izquierdo (AI) durante la sístole. Este flujo turbulento genera el soplo cardiaco. Esta regurgitación terminará causando congestión de la circulación pulmonar, edema de pulmón e hipertensión pulmonar. No olvidemos también que esta alteración podría conllevar una reducción significativa del GC y la activación de los mecanismos compensatorios maladaptativos.
En cuanto a la anestesia de estos pacientes, debemos considerar las siguientes cuestiones:
- Deberíamos evitar la bradicardia, puesto que si el volumen sistólico se ve reducido a causa de la regurgitación, la compensación normal para mantener el GC se produce mediante un aumento de la FC. La sugerencia anestésica se basaría en evitar o reducir la dosis de fármacos como los agonistas α2 adrenérgicos o un excesivo incremento del tono vagal proporcionado por los opioides agonistas puros. La petidina resulta la excepción como opioide puro, puesto que su uso producirá un leve incremento de la FC al margen de su poder analgésico.
- La diferencia entre el gradiente de presión entre VI y aorta determinará el volumen de regurgitación mitral observado. Así pues, pequeñas reducciones en la resistencia vascular sistémica, sin caer en valores de hipotensión, podrían ser beneficiosos. La sugerencia anestésica se basaría en evitar los agonistas α2 adrenérgicos o, de manera excepcional, reducir su dosis. La utilización de acepromacina como sedante a dosis bajas (5-10 µg/kg IV o IM) podría resultar de utilidad.
- Deberíamos evitar la expansión excesiva de volumen, puesto que un estado hipervolémico podría aumentar la congestión pulmonar y favorecería la aparición de edemas. La fluidoterapia debería estar muy controlada en estos pacientes, administrando la cantidad mínima necesaria: quizá valores de 2-3 ml/kg/h podrían ser adecuados, pudiendo modificar estos valores según las pérdidas quirúrgicas o fallo cardiaco congestivo claro.
Cardiomiopatía hipertrófica
La cardiomiopatía hipertrófica (CMH) se considera la cardiopatía felina más frecuente, llegando a afectar a uno de cada siete gatos. Su aparición en el paciente canino es muy infrecuente.35
Esta patología cardiaca se caracteriza por una hipertrofia concéntrica y fibrosis del VI, que genera una dificultad en la diástole ventricular como consecuencia de la incapacidad de dicho ventrículo para llenarse con presiones normales en las venas pulmonares. Además, la hipertrofia ventricular puede producir una obstrucción dinámica del tracto de salida. Todo esto se verá traducido en un GC reducido (Figs. 4 y 5). Cuando la enfermedad progresa, este incremento de la presión del VI acaba generando una dilatación de la AI, lo que podría desencadenar una ICC. El aumento del tamaño ventricular no se ve correlacionado con un incremento de perfusión coronaria, por lo que podrían aparecer fenómenos hipóxicos que generarían focos arritmogénicos. Por último, la incidencia de tromboembolia arterial debe ser considerada, a causa de la estasis sanguínea a nivel de la AI.
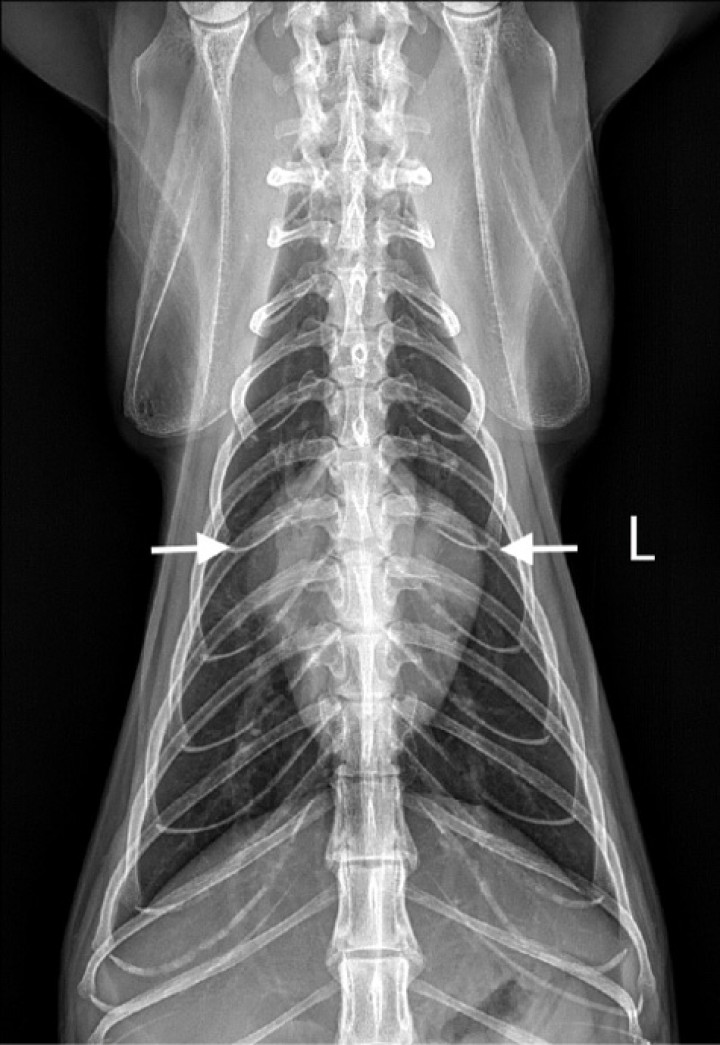
Figura 4
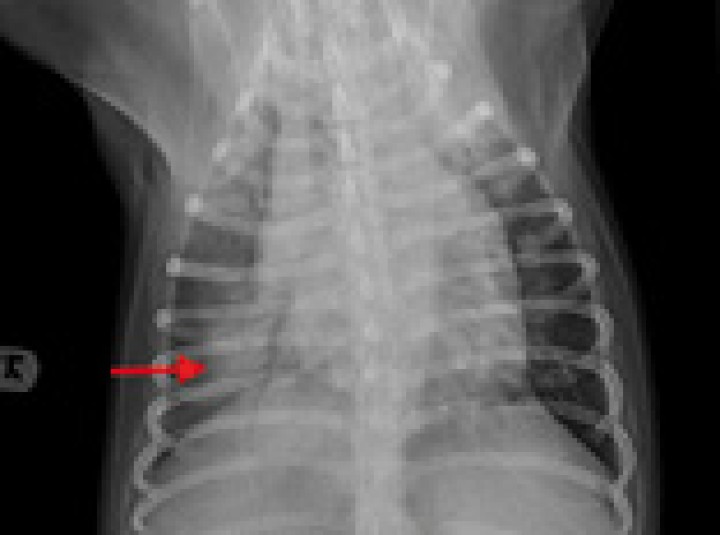
Radiografía dorsoventral (DV) de tórax de un gato con cardiomiopatía hipertrófica. Se observa un ensanchamiento de la región de la base cardiaca (flechas blancas), adquiriendo una imagen denominada de “corazón de San Valentín”.
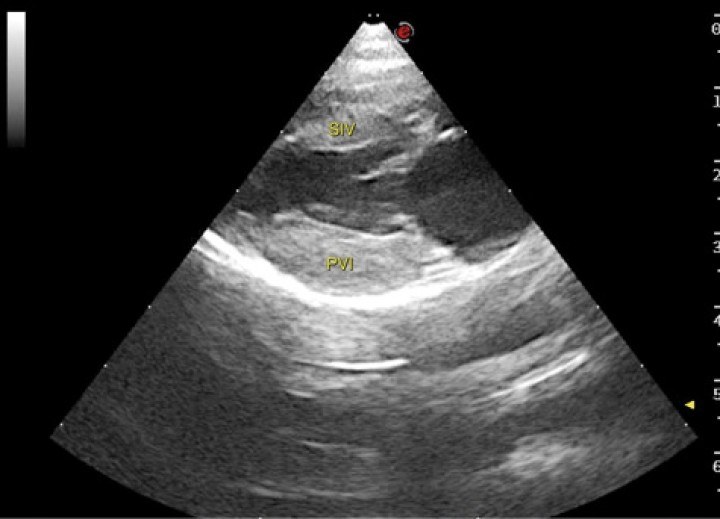
Figura 5
Imagen ecocardiográfica paraesternal derecha en eje largo cuatro cámaras de un gato con cardiomiopatía hipertrófica. En la imagen se observa engrosamiento de la pared libre del ventrículo izquierdo (PVI) (0,81 cm) y del septo interventricular (SIV) (0,73 cm). Valores > 0,6 cm son sugestivos de CMH.
Centrándonos en la anestesia de estos pacientes, consideraremos las siguientes cuestiones:
- La reducción de la activación simpática debería ser crucial, puesto que un incremento de la FC, de la contractilidad y de la presión arterial generaría un incremento en la demanda de oxígeno miocárdico a la par que una reducción en el tiempo diastólico. Es por ello que debemos considerar al estrés como nuestro peor enemigo y a la sedación como un valioso aliado.
- El aumento de la contractilidad cardiaca, la disminución del volumen ventricular y la reducción de la postcarga cardiaca generarán el empeoramiento de la obstrucción del tracto de salida del VI. A causa de esto, el uso de la ketamina podría estar relativamente contraindicado en estos pacientes por su acción simpaticomimética.
- El uso de dexmedetomina a dosis bajas (5-10 µg/kg IV o IM) se postula como una buena alternativa en estos pacientes. Las principales ventajas de su uso se basan en una buena sedación, minimizando el estrés, y producen un descenso en la FC, la cual resulta en un incremento en el tiempo de llenado ventricular y en una reducción de la gravedad de la obstrucción dinámica del tracto de salida izquierdo. Aunque en general disminuye el GC, la demanda miocárdica de oxígeno también disminuye y esto puede beneficiar al tejido miocárdico isquémico y fibrótico. Por último, la presencia de un antagonista (atipamezol) también resulta ser una ventaja clara del uso de estos fármacos.
- El uso de opioides resulta beneficioso. En este caso evitaremos el uso de petidina puesto que su uso supondrá un incremento de la FC.
- En el caso de necesitar tratar la hipotensión, debida a la vasodilatación asociada a la anestesia general (agentes inhalatorios), se puede contrarrestar con fenilefrina, la cual en estos casos es preferible frente a un fármaco con acción inotrópica positiva.
Cardiomiopatía dilatada
La cardiomiopatía dilatada (CMD) es una de las patologías cardiacas más frecuentes en la especie canina, suponiendo aproximadamente el 21 % de la incidencia total de cardiopatías en el paciente canino.36 La incidencia de CMD en gatos es mucho menos frecuente, pero es posible observarla de manera ocasional.
La CMD se caracteriza por una dilatación ventricular cuya contractilidad se ve claramente disminuida (Fig. 6). Esta disfunción genera un gran descenso en el VS, por lo que el GC se ve claramente comprometido. Según avanza la enfermedad, se genera una dilatación de la AI por presencia de regurgitación mitral debido a la separación de las valvas mitrales por la distensión ventricular, lo que puede llegar a producir una insuficiencia cardiaca izquierda, así como ocasionar problemas arrítmicos.
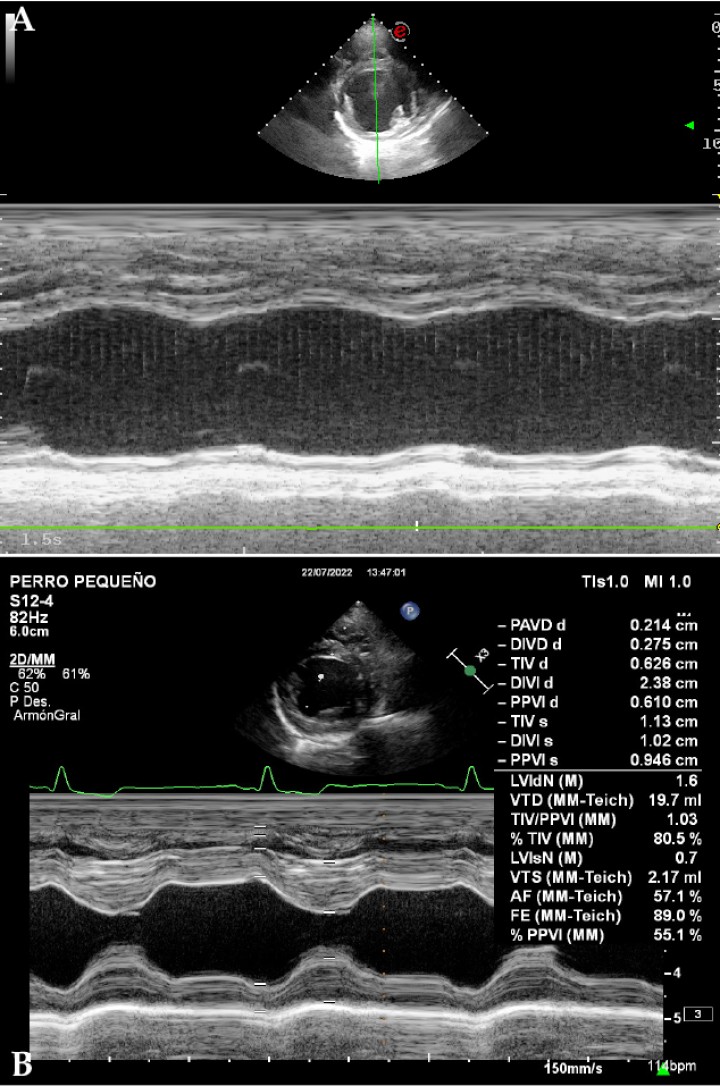
Figura 6
(A) Imagen ecocardiográfica en modo M, paraesternal derecha en eje corto a la altura de los músculos papilares del ventrículo izquierdo de un perro con cardiomiopatía dilatada. Nótese la ausencia de contracción ventricular en comparación con la misma imagen en un paciente sano. (B) Imagen ecocardiográfica en modo M, paraesternal derecha en eje corto a la altura de los músculos papilares del ventrículo izquierdo de un perro sano. Se observa el diámetro del ventrículo izquierdo en diástole normalizado (LVIDn) con un valor de 1,6. Este es un valor normalizado del diámetro de ventrículo izquierdo en diástole (LVIDD) en función del peso mediante la siguiente fórmula: LVIDn= LVIDD / Peso 0,294. El valor de referencia se sitúa por debajo de 1,7 cm.
En los pacientes con CMD que vayan a ser sometidos a anestesia, tendremos en cuenta los siguientes aspectos:
- El GC se verá muy disminuido por el descenso grave de la contractilidad cardiaca. Fármacos como la dobutamina deberán ser considerados en caso de observar un déficit de presión arterial.
- La FC ayudará a mantener el GC, por lo que deberemos evitar la bradicardia. Fármacos como los agonistas α2 adrenérgicos están contraindicados. La acepromacina a dosis bajas (2-10 µg/kg) puede tolerarse correctamente siempre y cuando no haya una hipotensión previa ni el paciente esté bajo tratamiento con vasodilatadores.
- Los opioides son una buena opción como analgésicos y su uso puede ser útil como parte del protocolo anestésico también en estos pacientes, siempre que no se obtenga una bradicardia excesiva. En tal caso se pueden usar fármacos anticolinérgicos para aumentar la FC.
- Las arritmias, como la fibrilación atrial o las arritmias de origen ventricular, pueden ser frecuentes. Estos pacientes ya presentan un GC bajo y la tolerancia a estos problemas arrítmicos es baja. La administración de lidocaína puede resultar de utilidad en estos pacientes por su efecto antiarrítmico, pero también por su capacidad de reducir los requerimientos de agentes inhalados y de producir analgesia, contribuyendo a una anestesia equilibrada.
- Al igual que en la enfermedad degenerativa de la válvula mitral, la utilización de una fluidoterapia agresiva estaría contraindicada. Velocidades de cristaloides de 2-3 ml/kg/h deberían ser bien toleradas, pudiendo modificar estos valores según las pérdidas quirúrgicas o fallo cardiaco congestivo claro (Fig. 7).
Figura 7
Radiografía dorsoventral de tórax de un perro con fallo cardiaco congestivo secundario a una cardiomiopatía dilatada. Se observa cardiomegalia y patrón alveolar en el lóbulo caudal derecho compatible con edema pulmonar de origen cardiogénico (flecha roja).
Conclusión
Las buenas prácticas para la anestesia del paciente con patología cardiaca conllevan un entendimiento de los conceptos hemodinámicos básicos, de la repercusión de la propia enfermedad y de la acción de los principales fármacos anestésicos.
Aunando esta información, el procedimiento anestésico puede ser un reto al que el lector podría enfrentarse con mayores garantías de éxito.
Fuentes de financiación: este trabajo no se realizó con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran la inexistencia de conflicto de intereses.
Bibliografía
- 1.
Abbott JA: Acquired valvular disease. En Tilley LP (Fourth ed): Manual of Canine and Feline cardiology, St Louis, Missouri, Saunders, 2008; 110-138.
- 2.
Grubb T, Sager J, Gaynor JS, et al: AAHA Anesthesia and Monitoring Guidelines for Dogs and Cats. J Am Anim Hosp Assoc 2020; 56: 59-82.
[pubMed] - 3.
Matthews NS, Mohn TJ, Yang M, et al: Factors associated with anesthetic-related death in dogs and cats in primary care veterinary hospitals. J Am Vet Med Assoc 2017; 250: 655-665.
[pubMed] - 4.
Warne LN, Bauquier SH, Pengelly J, et al: Anaesthesia guidelines for dogs and cats. Aust Vet J 2018; 96: 413-427.
[pubMed] - 5.
Brodbelt DC, Blissitt KJ, Hammond RA, et al: The risk of death: the confidential enquiry into perioperative small animal fatalities. Vet Anaesth Analg 2008; 35: 365-373.
[pubMed] - 6.
Brodbelt D. Perioperative mortality in small animal anaesthesia. Vet J 2009; 182: 152-161.
[pubMed] - 7.
Bille C, Auvigne V, Libermann S, et al: Risk of anaesthetic mortality in dogs and cats: an observational cohort study of 3546 cases. Vet Anaesth Analg 2012; 39: 59-68.
[pubMed] - 8.
Gil L, Redondo JI. Canine anaesthetic death in Spain: a multicentre prospective cohort study of 2012 cases. Vet Anaesth Analg 2013; 40: 57-67.
[pubMed] - 9.
Clark L, Kavanagh JA, Pang DSJ, et al: Impact of preanaesthetic echocardiography on the planned anaesthetic management of cats. Vet Anaesth Analg 2020; 47: 614-620.
[pubMed] - 10.
Pouchelon JL, Atkins CE, Bussadori C, et al: Cardiovascular–renal axis disorders in the domestic dog and cat: a veterinary consensus statement. J Small Anim Pract 2015; 56: 537-552.
[pubMed] - 11.
Liang KV, Williams AW, Greene EL, et al: Acute decompensated heart failure and the cardiorenal syndrome. Crit Care Med 2008; 36: 75-88.
[pubMed] - 12.
Robinson R, Borgean K: Cardiovascular disease. En British Small Animal Veterinary Association (Third ed): BSAVA Manual of Canine and Feline Anaesthesia and Analgesia, England, 2016; 283-314.
- 13.
Rioja E: Anestesia en pacientes con enfermedad cardiaca. En Servet: Manual de anestesia y analgesia de pequeños animales con patologías o condiciones específicas. Zaragoza, España, 2016; 2-13.
- 14.
Coleman AE, Shepard MK, Schmiedt CW, et al: Effects of orally administered enalapril on blood pressure and hemodynamic response to vasopressors during isoflurane anesthesia in healthy dogs. Vet Anaesth Analg 2016; 43: 482-494.
[pubMed] - 15.
Rankin DC: Sedatives and tranquilizers. En Lumb and Jones (Fourth ed): Veterinary Anesthesia and Analgesia. Oxford, UK. 2007; 196-206.
- 16.
Grubb T: Cardiovascular Disease as a Co-Morbidity for Anesthesia and Analgesia of Non-Related Emergencies. En Mathews KA: Analgesia and anesthesia for the ill or injured dog and cat. Hoboken, USA. 2018; 244-254.
- 17.
McNally EM, Robertson SA, Pablo LS: Comparison of time to desaturation between preoxygenated and nonpreoxygenated dogs following sedation with acepromazine maleate and morphine and induction of anesthesia with propofol. Am J Vet Res 2009; 70: 1333-1338.
[pubMed] - 18.
Short CE, Bufalari A: Propofol anesthesia. Vet Clin North Am Small Anim Pract 1999; 29: 747-778.
[pubMed] - 19.
Chiu KW, Robson S, Devi JL, et al: The cardiopulmonary effects and quality of anesthesia after induction with alfaxalone in 2-hydroxypropyl-β-cyclodextrin in dogs and cats: a systematic review. J Vet Pharmacol Ther 2016; 39: 525-538.
[pubMed] - 20.
White KL, Yates D. Clinical comparison of alfaxalone, ketamine and propofol following medetomidine and methadone in dogs. Vet Anaesth Analg 2017; 44: 1027-1034.
[pubMed] - 21.
Zapata A, Laredo FG, Escobar M, et al: Effects of midazolam before or after alfaxalone for co-induction of anaesthesia in healthy dogs. Vet Anaesth Analg 2018; 45: 609-617.
[pubMed] - 22.
Muir WW. Side effects of etomidate in dogs. J Am Vet Med Assoc 1989; 194: 1430-1434.
[pubMed] - 23.
Rodríguez JM, Munoz-Rascon P, Vavarrete-Calvo R, et al: Comparison of the cardiopulmonary parameters after induction of anaesthesia with alphaxalone or etomidate in dogs. Vet Anaesth Analg 2012; 39: 357-365.
[pubMed] - 24.
Sinner B, Graf BM. Ketamine. Handb Exp Pharmacol 2008; 182: 313-333.
[pubMed] - 25.
Aroni F, Iacovidou N, Dontas I, et al: Pharmacological aspects and potential new clinical applications of ketamine: reevaluation of an old drug. J Clin Pharmacol 2009; 49: 957-964.
[pubMed] - 26.
Waxman K, Shoemaker WC, Lippmann M. Cardiovascular effects of anesthetic induction with ketamine. Anesth Analg 1980; 59: 355-358.
[pubMed] - 27.
Pagel PS, Kampine JP, Schmeling WT, et al. Influence of volatile anesthetics on myocardial contractility in vivo: desflurane versus isoflurane. Anesthesiology 1991; 74: 900-907.
[pubMed] - 28.
Ambros B, Duke-Novakovski T, Pasloske KS. Comparison of the anesthetic efficacy and cardiopulmonary effects of continuous rate infusions of alfaxalone-2-hydroxypropyl-beta-cyclodextrin and propofol in dogs. Am J Vet Res 2008; 69: 1391-1398.
[pubMed] - 29.
Hellyer PW, Mama KR, Shafford HL, et al: Effect of diazepam and flumazenil on minimum alveolar concentration for dogs anesthetized with isoflurane or a combination of isoflurane and fentanyl. Am J Vet Res 2001; 62: 555-560.
[pubMed] - 30.
Snyder CJ, Snyder LB: Effect of mepivacaine in an infraorbital nerve block on minimum alveolar concentration of isoflurane in clinically normal anesthetized dogs undergoing a modified form of dental dolorimetry. J Am Vet Med Assoc 2013; 242: 199-204.
[pubMed] - 31.
Campagnol D, Teixeira-Neto FJ, Peccinini RG, et al: Comparison of the effects of epidural or intravenous methadone on the minimum alveolar concentration of isoflurane in dogs. Vet J 2012; 192: 311-315.
[pubMed] - 32.
Pypendop BH, Pascoe PJ, Ilkiw JE: Effects of epidural administration of morphine and buprenorphine on the minimum alveolar concentration of isoflurane in cats. Am J Vet Res 2006; 67: 1471-1475.
[pubMed] - 33.
Kudnig ST, Mama K. Perioperative fluid therapy. J Am Vet Med Assoc 2002; 221: 1112-2111.
[pubMed] - 34.
Keene BW, Atkins CE, Bonagura JD, et al: ACVIM consensus guidelines for the diagnosis and treatment of myxomatous mitral valve disease in dogs. J Vet Intern Med 2019; 33: 1127-1140.
[pubMed] - 35.
Luis Fuentes V, Abbott J, Chetboul V, et al: ACVIM consensus statement guidelines for the classification, diagnosis, and management of cardiomyopathies in cats. J Vet Intern Med 2020; 34: 1062-1077.
[pubMed] - 36.
Simpson S, Edwards J, Ferguson-Mignan T, et al: Genetics of Human and Canine Dilated Cardiomyopathy. Int J Genomics 2015; 2015: 204823.
[pubMed]