Neoplasias en aves rapaces. A propósito de 5 casos
Tumours in birds of prey. Five cases
A. Romairone-Duarte, J. Altimira-Palau, G. Ramírez-Rivero, A. Serantes-Gómez
Contacto: adrian@diagnosticoveterinario.com
Resumen
Se comunican 5 casos de neoplasias en aves rapaces diagnosticados en un período de 10 años. Todas las aves permanecían en cautividad en el momento del diagnóstico. Cuatro procedían de aves destinadas a la cetrería y la restante permanecía como irrecuperable en un centro de recuperación de aves. El objetivo del trabajo es la comunicación de los 5 casos, su diagnóstico y la discusión sobre posibles predisponentes del entorno que podrían afectar en mayor medida a las aves de cetrería en contraste con las aves rapaces de vida silvestre.
Palabras clave: Neoplasia, Aves rapaces, Xantoma, Timoma, Mastocitoma uropigial, Carcinoma ductus biliar, Rabdomiosarcoma miocárdico.
Summary
5 cases of tumours diagnosed in birds of prey in a period of 10 years are described. All birds were in captivity at the time of diagnosis. Four were birds for falconry and the fifth remained in a bird recovery center. The aim of this work is the communication of the diagnosis and discussing whether a possible predisposing environment could affect more to falconry birds in contrast to wildlife raptors.
Keywords: Tumours, Birds of prey, Xanthoma, Thymoma, Uropygium mastocitoma, Biliary duct carcinoma, Myocardial rabdomyosarcoma.

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
Se consideran como aves rapaces en cautividad a las aves de cetrería y a todas aquellas que permanezcan bajo alimentación y medio ambiente controlado, sin previsión de ser liberadas en la Naturaleza, y como aves rapaces de vida silvestre aquellas que ingresan a un centro de recuperación de fauna silvestre y que su destino final es ser devueltas a la Naturaleza.
Al contrario de lo que se especulaba (que las neoplasias no eran frecuentes en las aves rapaces),1,2 la revisión realizada por Forbes et al,3 concluyó que los procesos neoplásicos podrían tener un impacto mayor en estas especies de lo que se pensaba. Aunque el número de casos publicados se ha incrementado desde entonces, un registro completo de patología neoplásica en aves rapaces, incluyendo descripción clínica, diagnóstico histopatológico y tratamiento, sigue un desarrollo lento, aunque cada vez con más presencia en publicaciones especializadas.
Material y métodos
En la Tabla 1 se recogen los datos sobre género, especie, sexo, edad y localización del tumor. En todos los animales se completó una anamnesis y exploración física. Posteriormente se les realizó cirugía (casos 1, 2 y 5) o necropsia (casos 3 y 4) y en todos ellos se tomó una biopsia para alcanzar el diagnóstico definitivo.
Resultados
Caso clínico 1
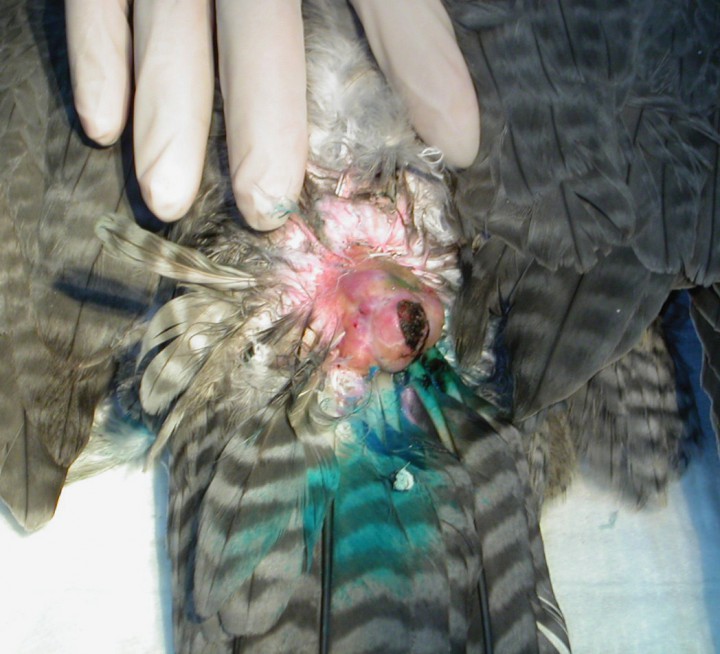
Una hembra de azor (Accipiter gentilis), de 10 años de edad, presentaba un cuadro de debilidad general y postración. En la exploración clínica, una masa de aproximadamente 3 x 2 x 1 cm, de consistencia firme, fue encontrada en dorsal de la base de la cola, coincidiendo con la zona donde se localiza la glándula uropigial (Fig. 1). La extirpación quirúrgica de la masa fue realizada bajo anestesia general con isofluorano. Después de la cirugía, el animal se recuperó favorablemente, logrando sobrevivir durante dos años.
Figura 1
En la zona dorsal, correspondiendo con la base de la cola, se puede apreciar una masa de 3x2x1 cm, de aspecto lobular que protruye sobre la superficie, de consistencia dura y sin plumas.
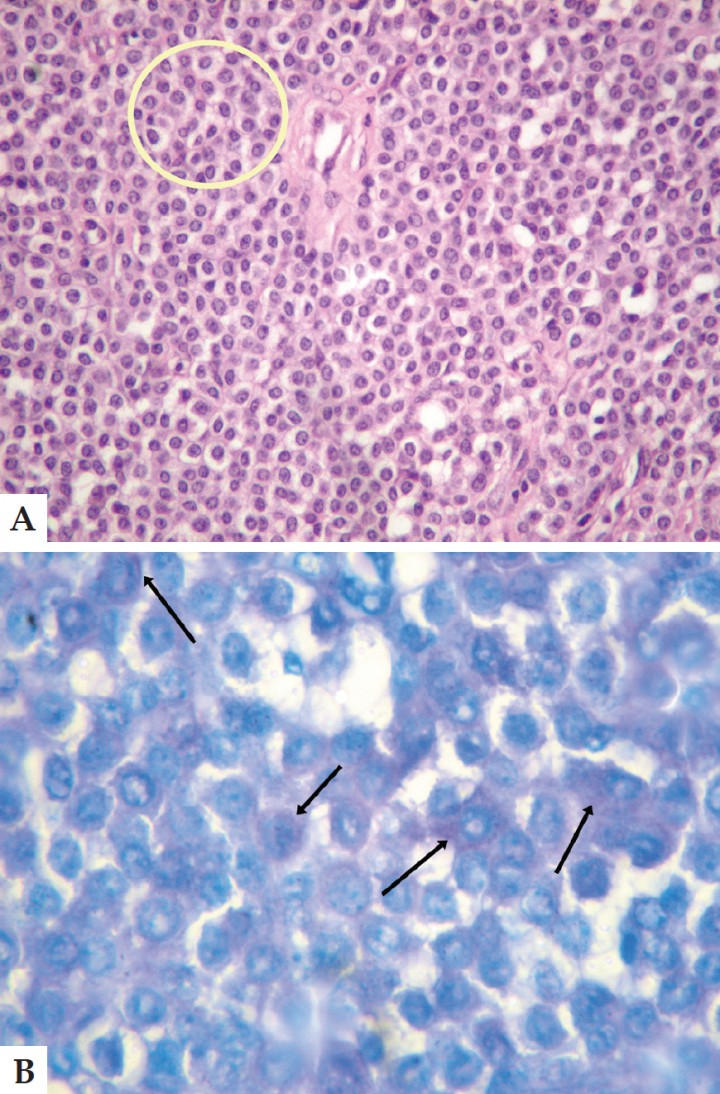
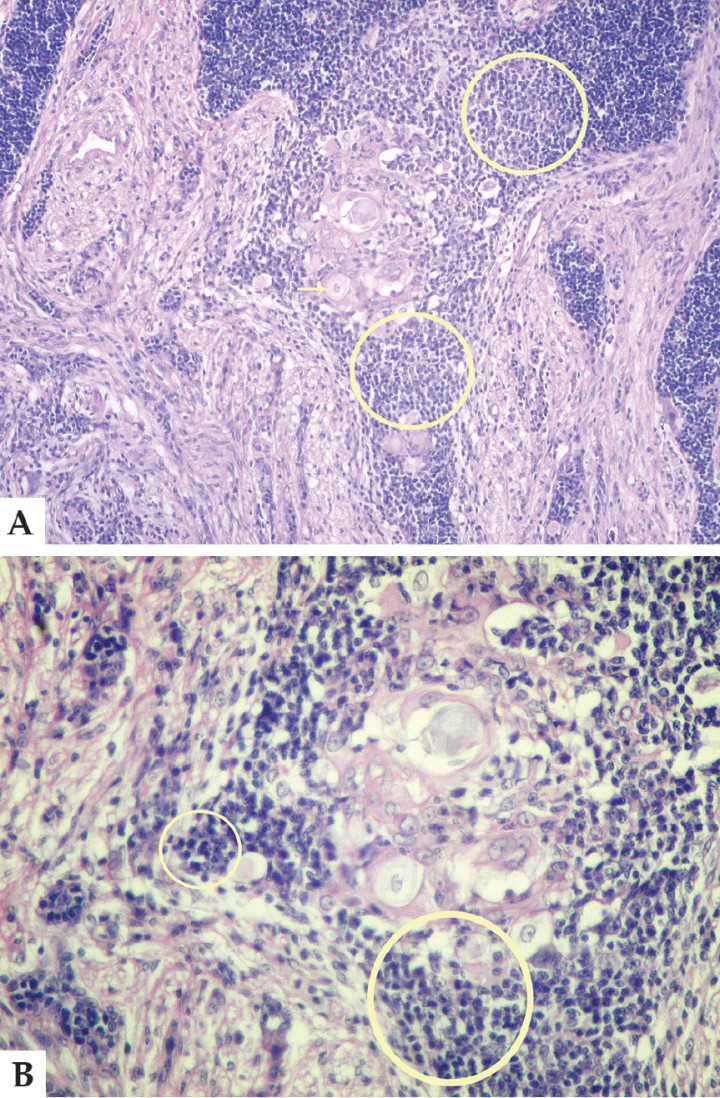
Inicialmente el caso se consideró como un adenoma de la glándula uropigial, pero posteriormente se realizaron pruebas inmunohistoquímicas y tinción con azul de toluidina comprobando la presencia de gránulos metacromáticos que, sumados a las características propias de las células, permitió concluir que estábamos ante un diagnóstico de mastocitoma, descartando el inicial de adenoma de glándula uropigial (Figs. 2 A y B).
Figura 2
A. Corte histológico. Conjunto de células redondas características del proceso (círculo amarillo). Tinción Hematoxilina-Eosina Aumento 40x. B. Corte histológico. Tinción con azul de toluidina, donde es posible apreciar abundantes gránulos metacromáticos (flechas). Aumento 1000x.
Diagnóstico: Mastocitoma en la zona uropigial.
Caso clínico 2
Un macho viejo de águila azor-perdicera (Hieraetus fasciatus), de 15 años de edad, en cautividad al menos durante quince años, en el Centro de Recuperación de Animales Silvestres de Valladolid (CRAS Valladolid).
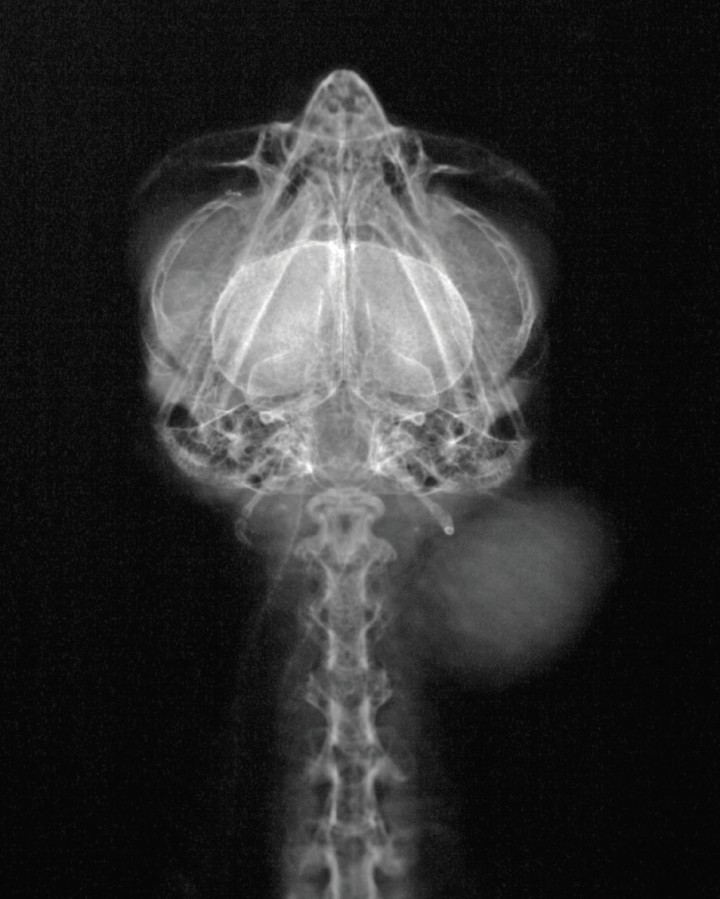
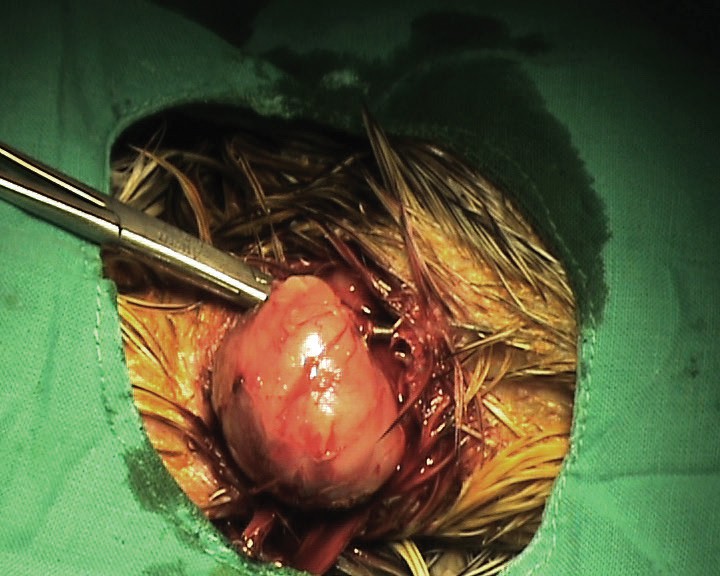
En la exploración física se observó una masa redonda en la cara ventral del cuello (Fig. 3), fluctuante, indolora, de aproximadamente 2 cm de diámetro, localizada en el tejido subcutáneo (Fig. 4), sin afectar ni adherirse a la piel que clínicamente se diagnosticó como un lipoma. Después de la extirpación quirúrgica (Fig. 5), se envió una muestra para histopatología e inmunohistoquímica.
Figura 3
Se puede apreciar la localización subcutánea de la masa, de 2 cm de diámetro aproximadamente, en ventral de la zona mandibular posterior y de aspecto esférico.
Figura 4
Radiografía DV de la cabeza y cuello. Se aprecia una masa de opacidad tejido blando en la zona izquierda.
Figura 5
Aspecto de la masa en el momento de la extracción quirúrgica.
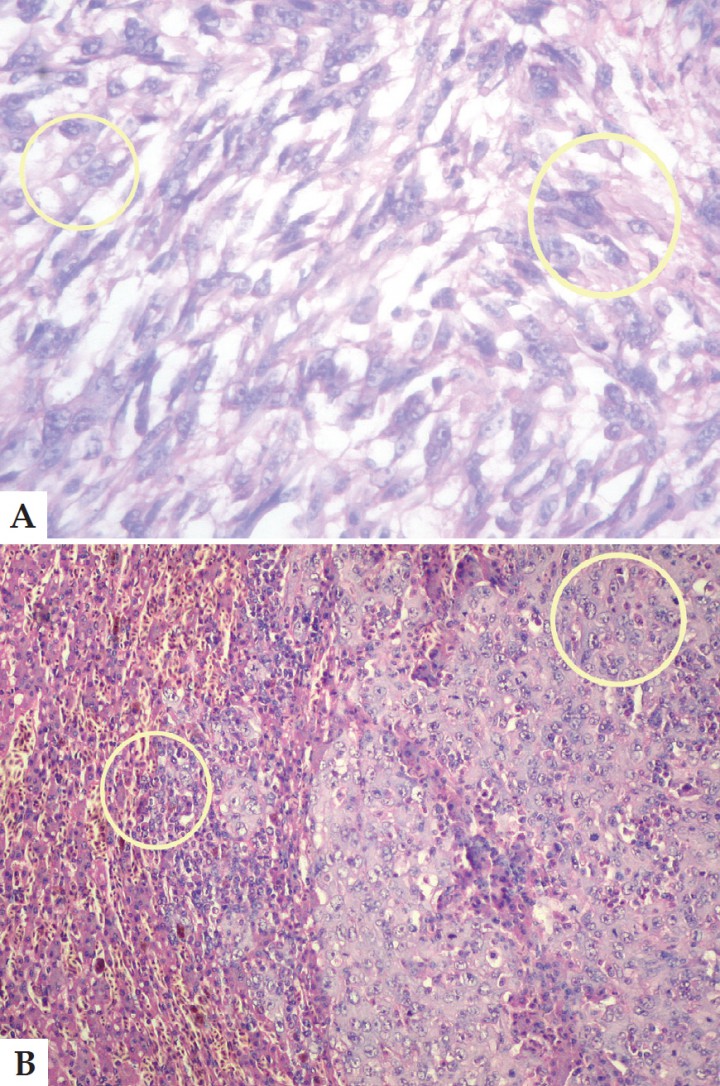
Se puso en evidencia la presencia de una población celular mixta compuesta de células epiteliales grandes, poligonales, pancitoqueratina-positivas, con citoplasma acidófilo y núcleos centrales redondeados con agrupaciones de cromatina y pequeños linfocitos maduros, lo que permitió identificar las células como pertenecientes al timo. De acuerdo con las características clínicas, morfológicas e inmunohistoquímicas, se concluyó un diagnóstico final de timoma. El ejemplar seguía vivo en el momento de escribir este artículo (Figs. 6 A y B).
Figura 6
A. Corte histológico. Población celular mixta (círculo amarillo) compuesta de elementos linfocíticos maduros y células epiteliales grandes, poligonales o alargadas, de citoplasma claro y formación ocasional de corpúsculos de Hassal (flecha). Aumento 40x. Tinción Hematoxilina-Eosina. B. Corte histológico. Imagen a 400x donde se observa dentro de un círculo amarillo, la población celular mixta mencionada en la imagen anterior (A). Tinción Hematoxilina-Eosina.
Diagnóstico: Timoma.
Caso clínico 3
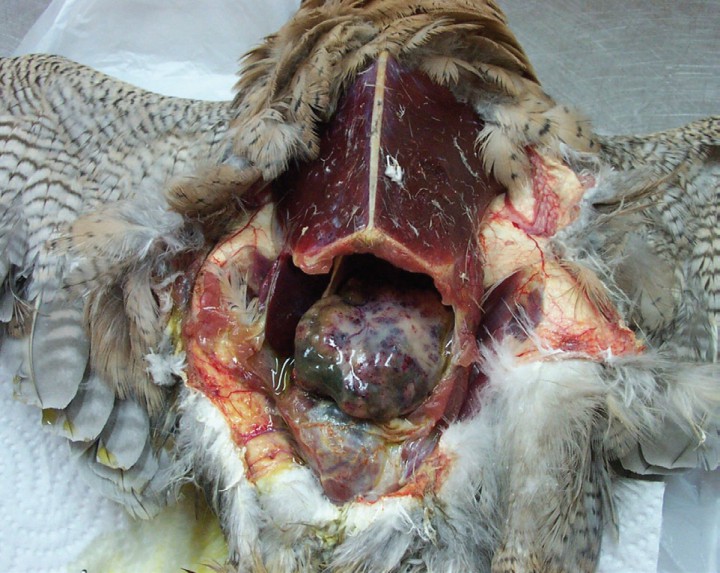
Un macho de halcón peregrino adulto (Falco peregrinus), de 11 años de edad, fue encontrado muerto dentro de su jaula después de un seguimiento clínico por decaimiento y pérdida de peso.
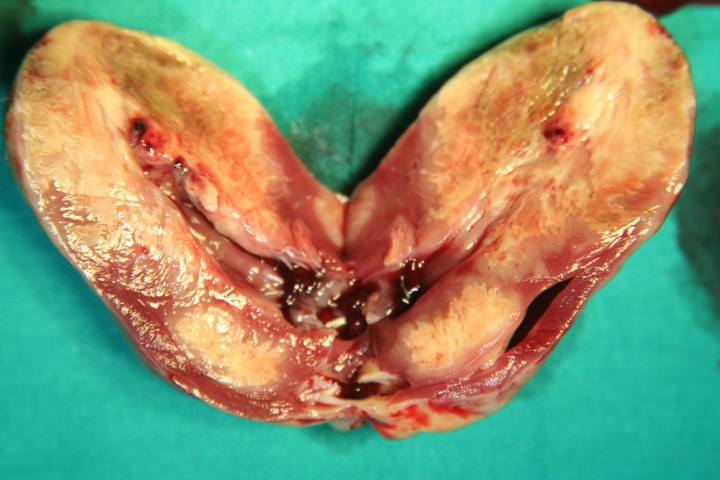
En el examen externo fue posible observar una masa firme, unilateral, que sobrepasaba el borde posterior del esternón. En la necropsia se detectó gran cantidad de líquido, compatible con ascitis, en el interior de la cavidad celómica. Se identificó una masa hepática unilateral que se correspondía con la totalidad del lóbulo hepático izquierdo. El lóbulo afectado presentaba consistencia dura, aspecto marmóreo, pérdida de forma y un aumento de tamaño destacable con respecto al lóbulo derecho (Fig. 7).
Figura 7
Cambios neoplásicos del lóbulo hepático izquierdo. Existe un aumento de tamaño muy marcado con respecto al lóbulo contralateral, así como una pérdida de estructura compatible con tejido hepático sano.
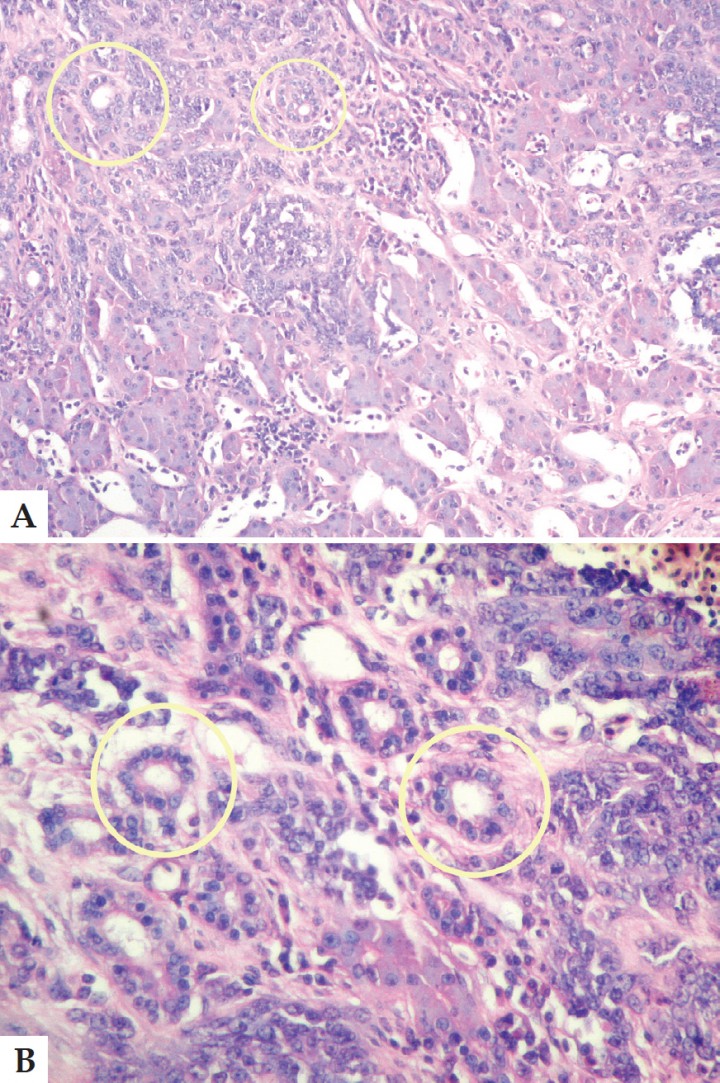
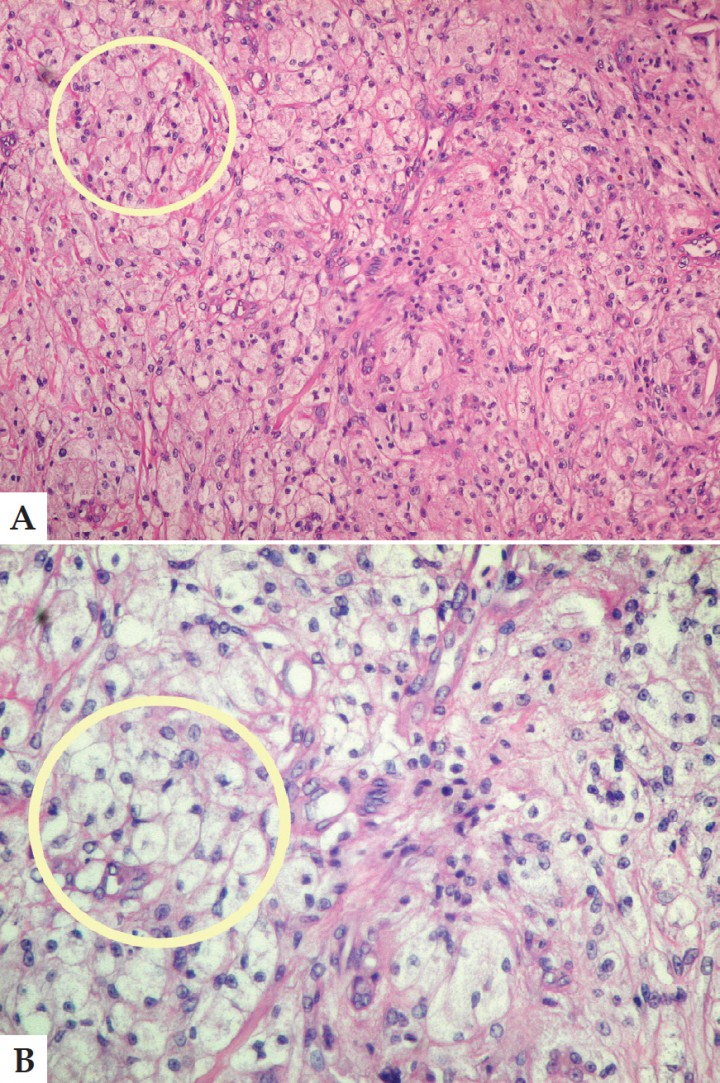
El tejido hepático se encontraba infiltrado por células atípicas poliédricas, con escaso citoplasma y anisocariosis, que crecían infiltrativamente formando túbulos, cordones y láminas con marcada desmoplasia. Las células presentaban citoplasma acidófilo y núcleos vesiculares con 1-2 nucléolos evidentes. Las mitosis eran escasas. Se aprecia invasión de los vasos linfáticos por parte de las células neoplásicas. (Figs. 8 A y B).
Figura 8
A. Corte histológico. Tejido hepático infiltrado por células atípicas poliédricas con escaso citoplasma y anisocariosis. Los conductos con características neoplásicas indican el origen del cambio tumoral (círculo). Aumento 40x. B. Corte histológico. Es posible apreciar que las células presentan citoplasma acidófilo, núcleos vesiculares con 1–2 nucléolos evidentes (círculo). Aumento 400x. Tinción Hematoxilina-Eosina.
Diagnóstico: Carcinoma de ductus biliar.
Caso clínico 4
Hembra adulta de halcón peregrino (Falco peregrinus), de 7 años de edad, que presentaba debilidad general grave y dificultad respiratoria, sumado a una historia de cojera en la extremidad izquierda, con alteraciones en el apoyo, y pododermatitis en la extremidad opuesta. Debido al mal estado general del ejemplar y a las características terminales del proceso, además de que padecía una parasitosis importante de los sacos aéreos (Serratospiculum spp), se decidió la eutanasia.
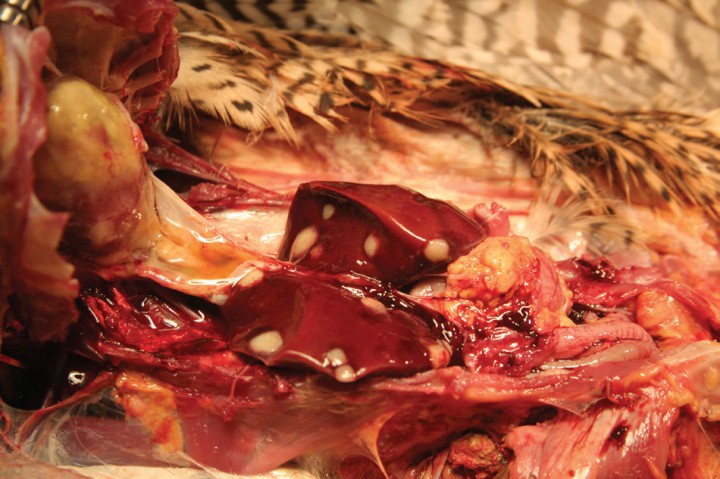
En la necropsia se apreciaron formaciones nodulares de tamaño variable, ligeramente redondas, de un diámetro de entre 30 a 50 mm y color blanco-amarillento, afectando al parénquima hepático (Fig. 9). El corazón presentaba una extensa degeneración de aspecto fibroso y color amarillento, que contrastaba con el color y las características de pequeñas zonas de miocardio aparentemente sano (Fig.10).
Figura 9
Ambos lóbulos hepáticos presentan formaciones nodulares ligeramente redondeadas, de color amarillento y aspecto circular que protruyen levemente sobre la superficie del parénquima, variando entre los 30 a 50 mm de diámetro.
Figura 10
Un corte longitudinal del corazón pone en evidencia el contraste entre el tejido miocárdico sano y el afectado por la neoplasia.
La microscopia de las lesiones del corazón y tejido hepático demostró una proliferación multifocal, infiltrante, de células fusiformes marcadamente pleomórficas dispuestas en láminas o densamente agregadas en paquetes, con un núcleo oval que contenía nucléolos individuales o múltiples de aspecto irregular. Se observaron mitosis atípicas. La inmunohistoquímica demostró proteínas de origen muscular (mioglobina, desmina) en las células neoplásicas de ambas lesiones cardiacas y hepáticas. Se concluye en un diagnóstico de rabdomiosarcoma con metástasis hepáticas. (Figs. 11 A y B).
Figura 11
A. Corte histológico. El objetivo de inmersión ayuda a identificar células fusiformes, pleomórficas (círculo), que permiten confirmar un sarcoma. Aumento 1000x. Tinción Hematoxilina-Eosina. B. Corte histológico. El círculo superior derecho marca la neoplasia y el de la izquierda y abajo, la infiltración de las células sobre el parénquima hepático. Aumento 40x. Tinción Hematoxilina-Eosina.
Diagnóstico: Rabdomiosarcoma miocárdico.
Caso clínico 5
Halcón peregrino (Falco peregrinus), macho, de 5 años de edad, que presentaba un bulto de crecimiento lento y progresivo en la superficie dorsolateral del tibiotarso izquierdo (Fig. 12).
Figura 12
En la imagen se aprecia una masa localizada en la zona del tibiotarso, con un tinte amarillo verdoso, cuya característica a la palpación recuerda un acumulo graso.
A la palpación, se observó una masa blanda, móvil, subcutánea, de bordes poco definidos, con una consistencia similar a grasa. El tamaño era de unos 3 x 5 cm aproximadamente. La piel que recubría la masa tenía un color amarillo-verdoso. Se decidió realizar la extracción quirúrgica de la neoformación.
La falta de piel, una vez extraído el tumor, obliga a plantear una cicatrización por segunda intención. Durante el postoperatorio, se produjo isquemia y necrosis grave de la garra, lo que obligó a realizar la amputación de la misma. El ejemplar se mantuvo con vida al menos dos años después de la cirugía.
Aunque el águila azor-perdicera (Hieraetus fasciatus) procediera de vida libre y no fuera un animal destinado a la cetrería, se le consideró igual que los demás debido a su larga estancia en cautividad y a su condición de irrecuperable para la vida en la Naturaleza.
La imagen histológica mostró en la dermis y el espacio subcutáneo una infiltración difusa de macrófagos con abundante citoplasma eosinófilo claro y vacuolizado, así como células gigantes multinucleadas rodeando o delimitando material cristaloide, acicular (colesterol), imagen característica de xantoma (Figs.13 A y B).
Figura 13
A. Corte histológico. Infiltración difusa de macrófagos con citoplasma vacuolizado (círculo). Aumento 40x. Tinción Hematoxilina-Eosina. B. Corte histológico. Detalle de los macrófagos con citoplasma acidófilo claro y espumoso (lipídico) característicos de esta lesión (círculo). Aumento 400x. Hematoxilina-Eosina.
Diagnóstico: Xantoma cutáneo.
Discusión
En la muestra estudiada, el 100 % de los animales procede de condiciones de cautividad (alimentación y medio ambiente controlado). No existen Strigiformes en la muestra, estando representados los Falconiformes con tres ejemplares, en mayor porcentaje que Accipitriformes, con dos individuos.
Aunque la incidencia de tumores es muy baja, oscilando entre el 1% en aves silvestres en general4 y el 2% de los hallazgos en necropsia de aves rapaces,1 en todo protocolo diagnóstico se deberían considerar los procesos neoplásicos en el diagnóstico diferencial3 y comunicar los diagnósticos confirmados, así como los detalles clínicos asociados al caso.
La extensa revisión3 sobre 122 casos de neoplasias, tanto en aves de vida libre como en aves de cautividad, Falconiformes, Accipitriformes y Strigiformes, incluye comunicaciones entre el año 1923 hasta el año 2000, permitiendo establecer una primera tabla de distribución de neoplasias en aves rapaces, por sistemas y tejidos afectados, así como determinar una primera aproximación de porcentaje de aparición de tumores entre aves de vida silvestre (32%) y aves en cautividad (62%).
En nuestra comunicación, salvo el rabdomiosarcoma miocárdico, todos los tumores mencionados se recogen en la revisión mencionada.3
Las aves rapaces, al igual que todo ser vivo, pueden desarrollar procesos neoplásicos en cualquier sistema del organismo. Probablemente se podría explicar una mayor prevalencia en las destinadas a la cetrería con respecto a las aves rapaces en libertad, debido entre otras cosas, a una mayor probabilidad de diagnóstico en aves controladas que en aquellas que pueden enfermar y morir en la Naturaleza, sin posibilidad de encontrar el cadáver para su estudio.5
La esperanza de vida en las aves de cetrería, al no estar sometidas directamente a procesos de selección natural, podría incrementar la posibilidad de desarrollar una enfermedad neoplásica.3 Si a ello le sumamos la edad como un factor6 que puede predisponer a la aparición de neoplasias, sería mucho más probable encontrar tumores de diferente comportamiento histológico y ubicación en aves en cautividad que en las aves de vida libre.5
La exposición a carcinógenos ambientales es más probable que ocurra en las aves que comparten un ambiente urbano7,8 o procedente de granjas de cría, que se alimentan en alguna fase de su vida con comida industrial, que aquellas que basan sus recursos alimenticios en una cadena trófica natural.
En las aves de cetrería y en las de cautividad en general, a diferencia de las de vida silvestre, cabe esperar un control y seguimiento más estricto de las patologías que les pudieran afectar, debido al mayor contacto y manipulación del ave, permitiendo hacer un diagnóstico precoz en la mayoría de los casos.
El contacto con virus oncogénicos característicos de otro tipo de aves debería ser más probable en rapaces en cautividad, que se alimentan con otras aves procedentes de sistemas industriales de cría4 y engorde como el pollo de carne, codorniz o palomas domésticas, que en las rapaces en libertad, que están dentro de una cadena trófica con menos probabilidad de transmisiones verticales u horizontales de enfermedades.
El seguimiento de las enfermedades que culminan con la muerte del ejemplar sin una causa demostrada debería incluir una necropsia sistemática,4 con el fin de comprobar y describir la coincidencia entre los hallazgos anatomopatológicos y los signos clínicos apreciados, contribuyendo con este procedimiento al diagnóstico etiológico del proceso y al aumento del conocimiento de las enfermedades neoplásicas en estos animales.
Por último, mencionar que la colaboración entre biólogos de campo y veterinarios podría aumentar el flujo de información sobre posibles casos de neoplasias en aves de vida silvestre, ya que procedimientos como el seguimiento de nidos, la captura para colocación de transmisores, etc., puede ser un momento ideal para la detección de enfermedades neoplásicas.
En conclusión, es importante destacar la relevancia medioambiental que podrían tener las aves rapaces, si las consideramos como centinelas de posibles carcinógenos ambientales como el exceso de luz UV y su posible efecto sobre capa de Bowman en el ojo de las mismas,9 así como el estudio del acumulo y efectos de los metales pesados de vertidos urbanos,6 insecticidas agrícolas5 y otros como los gases asociados a la combustión de los hidrocarburos.
Confirmar el origen neoplásico y conocer el porcentaje de neoplasias benignas sobre malignas, especie afectada, edad del individuo, incidencia de las mismas según el tejido afectado y su posible relación con virus oncogénicos propios o de otro tipos de aves (enfermedad de Marek, retrovirus como los del complejo leucosis-sarcoma y virus relacionados con la reticuloendoteliosis aviar), podría contribuir a un mejor conocimiento y comprensión de las diferencias etiológicas y de prevalencia neoplásica entre las aves procedentes de cautividad y las de vida silvestre.
Fuente de financiación: Este trabajo se ha financiado con fondos propios. No ha existido colaboración de fondos públicos ni privados.
Conflicto de intereses: Los autores declaran que no existe conflicto de intereses.
Bibliografía
- 1.
Keymer IF. Diseases of birds of prey. Zoological Society of London. Vet Rec 1972; 90: 579-594.
- 2.
Wadsworth PF; Jones DM. A renal carcinoma in a augur buzzard (Buteo rufofuscus augur). Avian Pathol 1980; 9:219-223.
[PubMed] - 3.
Forbes NA; Cooper JE; Higgins R. Neoplasms of birds of prey. Raptor Biomedicine III, Zoological Educ Network, Inc. Lake Worth, 2000;127-145.
- 4.
Friend M; Franson C. Field Manual of Wildlife Diseases. Miscellaneous diseases. Geological Survey, (U.S.), Biological Resources Division, Washington, DC (1999-2001).
- 5.
Cooper J. Morbidity and mortality in the Mauritius kestrel (Falco punctatus). Recent advances in the study of raptor diseases. Chiron Ltd. Keighley, West Yorkshire, England 1981.
- 6.
Ford SL, Chitty J, Jones MP. Non-infectious diseases of raptors. Neoplasms of raptors. Proceedings of the Annual Conference of the Association of Avian Veterinarians, Seattle, Washington, USA 2011.
- 7.
Cooper J; Wilkens W; Lawrence K. Four cases of neoplasia in birds of prey. Chapter 7. Raptor biomedicine Chiron Ltd. Keighley, West Yorkshire, England 1993.
- 8.
Brodey RS. The use of naturally occurring cancer in domestic animals for research into human cancer: general considerations and a review of canine skeletal osteosarcoma. Yale J of Biol and Med. 1979; 52:345-361.
[PubMed] - 9.
Gonçalves G; Martinez-García MC; Merayo-Lloves J et al. Estudio de la capa de Bowman en diferentes modelos animales y su papel en la protección a radiaciones solares. Trim 2011; 2:31-41
[Dialnet]