Seguridad y eficacia de dos protocolos de pauta de inducción rápida en el tratamiento con inmunoterapia para la dermatitis atópica canina: estudio piloto
Safety and efficacy of two fast escalation protocols of subcutaneous allergen immunotherapy in canine atopic dermatitis: pilot study
L. Ramió-Lluch, C. Bustillo, A. Dalmau, A. Puigdemont
Contacto: lauraramio@gmail.com
Resumen
La inmunoterapia con alérgenos (ITA) consiste en la administración creciente de alérgenos con el fin de ir desensibilizando el sistema inmune y evitar la reacción alérgica. Sin embargo, el protocolo de la ITA es largo y pesado, lo que dificulta el cumplimiento del propietario, que es crucial para su eficacia. El objetivo de este estudio era examinar la eficacia y seguridad de dos protocolos de pauta de inducción rápida. Con este fin, veintisiete perros de propietarios privados con atopia inducida por sensibilización a los ácaros del polvo doméstico fueron vacunados con ITA durante un periodo de 12 meses. Se compararon dos protocolos de inducción rápida de la ITA en términos de eficacia clínica (CADESI-04), reacciones adversas y medicación concomitante. Los niveles de IgE específicas se determinaron al inicio y al final del tratamiento. Se observaron reducciones significativas en el CADESI en ambos protocolos, con una mejoría media del 82 % (intervalo de 26,5 ± 10,2 a 4,8 ± 8,3) para el protocolo A y del 77 % (de 22,2 ± 16,1 a 5,1 ± 6,5) para el protocolo B. La puntuación de medicación concomitante se redujo de forma efectiva, sin observarse diferencias significativas. Además, los niveles de IgE no variaron salvo aquellos frente a Dermatophagoides farinae. Se registró una reacción adversa atribuible a la ITA que consistió en un aumento del prurito y edema. Las tasas de eficacia y seguridad observadas con ambos protocolos sugieren que las pautas de inducción rápida podrían ser una buena opción de ITA para mejorar el cumplimiento de la terapia.
Palabras clave: alergia, atopia, inmunoterapia rápida, canino.
Clin Vet Peq Anim 2023, 43 (1): 19-29
Summary
Allergen immunotherapy (ASIT) is the only aetiological treatment for canine atopic dermatitis. However, the ASIT protocol is long and cumbersome making owner compliance difficult,, which is crucial for its effectiveness. The objective of this study was to examine the efficacy and safety of two fast-escalation protocols. With this aim, twenty-seven private-owned dogs with atopy induced by sensitization to house dust mites were treated with ASIT over a 12-month period. Two protocols were compared in terms of clinical efficacy (CADESI-04), adverse reactions and concurrent medications, which were recorded after each ASIT dose. Specific IgE levels were determined at the beginning and end of treatment. With both protocols, similar CADESI reductions were recorded, translating to mean improvements of 82% (range 26.5 ±10.2 to 4.8 ±8.3) for protocol A, and 77% (22.2 ±16.1 to 5.1 ±6.5) for protocol B. Concurrent medication score was effectively reduced but with no significant differences. In addition, IgE levels did not vary except those against Dermatophagoides farinae. One ASIT-attributable adverse reaction recorded was increased pruritus and oedema during the induction phase in one dog. Efficacy and safety rates observed for both protocols suggest they could be a good ASIT option to improve compliance.
Keywords: allergy, atopy, fast-escalation immunotherapy, canine.
Clin Vet Peq Anim 2023, 43 (1): 19-29

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
La dermatitis atópica canina (DAC) es una enfermedad frecuente en la práctica veterinaria. La única opción de tratamiento curativo e inmunomodificador disponible actualmente, tanto en medicina humana como veterinaria, es la inmunoterapia con alérgenos (ITA). Aunque este tratamiento subcutáneo es prolongado, se ha demostrado eficaz siempre que se observe un buen cumplimiento de una pauta de tratamiento.1,2
La ITA subcutánea (ITAs) se administra siguiendo dos fases: la primera consiste en el aumento progresivo de la dosis de alérgeno hasta llegar a una concentración máxima, para seguir con una fase de mantenimiento en la que se administra mensualmente la misma dosis. Con las pautas convencionales de inmunoterapia, la inducción generalmente consiste en 1-2 inyecciones a la semana durante periodos que oscilan entre los 3 y 8 meses, en función del fabricante. Con las pautas de inmunoterapia subcutánea de aumento rápido o acelerado de la dosis (ITAs-R), los pacientes humanos alcanzan antes los beneficios de la inmunoterapia, y la terapia de mantenimiento puede iniciarse habitualmente al cabo de 4-8 semanas sin provocar una mayor tasa de reacciones adversas.1,3
Para los propietarios de perros con dermatitis atópica, la complejidad del tratamiento está estrechamente relacionada con la carga del cuidador y también con el cumplimiento del tratamiento por parte del propietario.4 Los beneficios de la ITAs-R se derivan de una fase de inducción del tratamiento más corta, que mejora el cumplimiento del tratamiento y, a su vez, conlleva otras ventajas como un mejor control de la enfermedad a largo plazo y una menor transferencia de carga para el veterinario.4,5 Además, las pautas de ITAs-R requieren un menor número de visitas clínicas, con el consiguiente ahorro de tiempo para el propietario y posiblemente una reducción del coste, lo que mejorará el interés en el tratamiento con ITA en general.3
Las pautas de inmunoterapia “rush” o “cluster” son protocolos de aumento ultra-acelerado de la dosis de la inmunoterapia. En una pauta de inmunoterapia “cluster”, el paciente recibe secuencialmente varias inyecciones del extracto (por lo general, de 2 a 4) en un solo día de tratamiento en días no consecutivos. La dosis de mantenimiento suele alcanzarse al cabo de 4-8 semanas. En los protocolos de inmunoterapia “rush”, se administran dosis más altas en intervalos de 15 a 60 minutos durante un periodo de 1 a 3 días, hasta que se alcanza la dosis de mantenimiento.3 Los protocolos “rush” y “cluster” han sido objeto de investigación en medicina veterinaria, pero estas pautas a veces requieren la hospitalización del animal como medida de precaución, o la administración de medicación preventiva para evitar reacciones adversas.6-8 Por el contrario, los protocolos de ITAs-R han demostrado ser seguros en veterinaria pero, hasta la fecha, no se han publicado datos de resultados de eficacia.5
En el presente estudio, evaluamos la eficacia y la seguridad de dos pautas de inducción rápida de ITAs usadas para tratar la dermatitis atópica en perros sensibilizados a los ácaros del polvo doméstico.
Materiales y métodos
Diseño del estudio
Se trata de un estudio piloto, multicéntrico, abierto y prospectivo en el que participaron 13 clínicas veterinarias privadas en España. Los pacientes se incluyeron durante un periodo de 2 años: de julio de 2018 a julio de 2020.
Animales
Los participantes eran perros con propietario privado, sensibilizados a los ácaros del polvo doméstico y con antecedentes de prurito crónico no estacional. El diagnóstico de dermatitis atópica se basó en criterios clínicos y la exclusión de otros diagnósticos como infestación por ectoparásitos, infección microbiana o reacciones adversas alimentarias.9 Los animales tenían más de 12 meses de edad y no se hizo distinción por sexo o raza. Los perros se incluyeron sobre la base de un título elevado de IgE específica frente a Dermatophagoides farinae (>1000 UAE; Greer ELISA Lenoir, EE. UU.). Los resultados positivos para otros ácaros del polvo doméstico (Dermatophagoides pteronyssinus) o para ácaros de almacenamiento (Acarus siro, Tyrophagus putrescentiae o Lepidoglyphus destructor) no se consideraron criterios de inclusión.
Los animales fueron excluidos si no cumplían con los periodos de retirada de la medicación establecidos: 2 semanas para los glucocorticoides orales, 8 semanas para los glucocorticoides inyectados, 6 semanas para la ciclosporina oral y 1 semana para los antihistamínicos. Se excluyó asimismo a los animales que habían recibido inmunoterapia previa.
Determinación de IgE específica
Para diseñar la composición de la ITA, se determinaron los anticuerpos IgE específicos (Greer ELISA Lenoir, EE. UU.) para 24 especies alergénicas (incluidos tanto los alérgenos de interior como de exterior) en el momento del reclutamiento (t0) y al cabo de 12 meses de tratamiento (t12).
Tratamiento y protocolo del estudio
Se utilizaron extractos de alérgenos nativos precipitados con aluminio como componentes de la inmunoterapia subcutánea; se excluyeron los extractos de polen o de hongos alergénicos. La ITAs se diseñó para cada animal en individual y los extractos de ácaros se utilizaron en individual o combinados entre sí, de acuerdo con el perfil de sensibilización de IgE de cada perro (Letivet Retard, LETI Pharma, Barcelona, España).
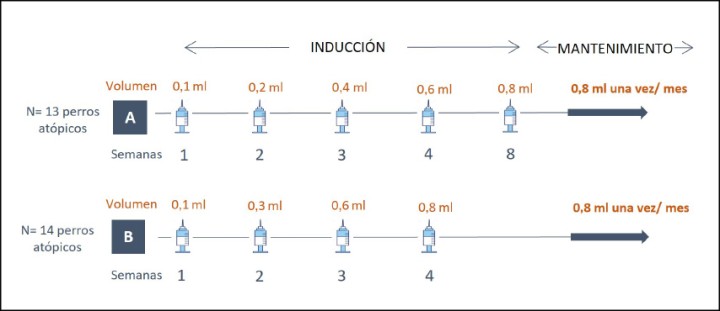
Se evaluaron dos protocolos de aumento de la dosis de ITAs-R similares (Fig. 1). En ambos protocolos, se partía ya desde la primera dosis del vial más concentrado utilizado en el protocolo de inducción convencional (25 µg/ml). La dosis máxima (dosis de mantenimiento) se administró al cabo de 8 semanas tras el primer protocolo (protocolo A) y al cabo de 4 semanas tras el segundo protocolo (protocolo B).
Figura 1
Protocolos de inducción rápida de la inmunoterapia subcutánea. El protocolo A consistía en una fase de inducción de 8 semanas y en el protocolo B era de 4 semanas.
El tratamiento de mantenimiento continuó hasta completar 12 meses de tratamiento. Se registraron las puntuaciones de seguridad y eficacia clínica después de cada inyección.
Los animales no se asignaron al azar, sino que se distribuyeron cronológicamente en cada grupo comenzando por el protocolo A y terminando con el protocolo B.
Eficacia
El veterinario evaluó mensualmente las lesiones cutáneas (eritema, liquenificación, alopecia y excoriaciones) en 20 zonas del cuerpo de acuerdo con el Índice de Extensión y Gravedad de la Dermatitis Atópica Canina (Canine Atopic Dermatitis Extent and Severity Index, CADESI-04).10
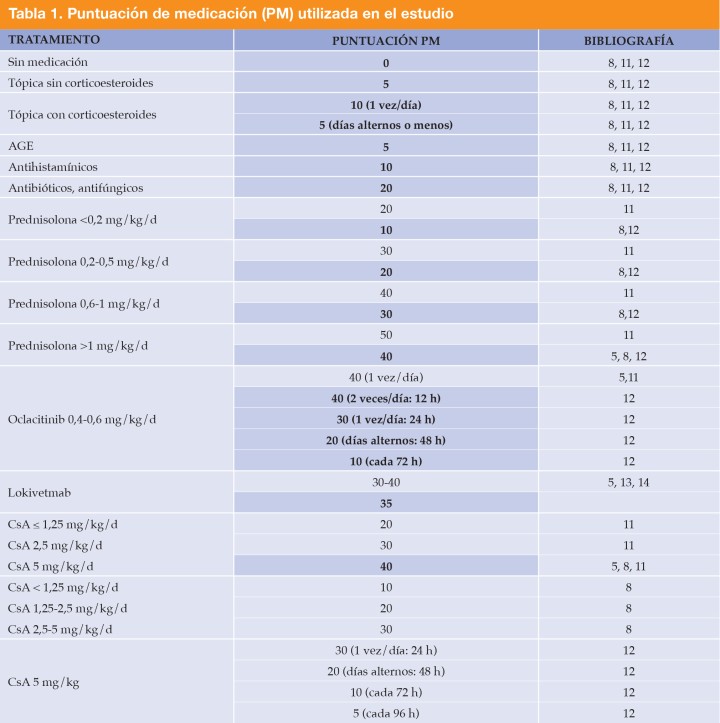
Algunos animales recibieron medicación para controlar la DAC, de modo que se asignó una puntuación de medicación (PM) a cada animal basada en aquellas descritas en estudios previos.5,8,11-14 Esta medicación se adaptó para el objetivo de este estudio al considerar alguna medicación adicional no contemplada en dichos estudios (lokivetmab); véase la Tabla 1.
CsA: ciclosporina; AGE: ácidos grasos esenciales. Se destacan en azul y negrita las puntuaciones asignadas en este estudio basadas en las citas bibliográficas que se mencionan.
Mediciones de seguridad
Durante el periodo de tratamiento, los efectos adversos (EA) se registraron y clasificaron para cada protocolo de ITAs-R. Los veterinarios tenían instrucciones de monitorizar estrechamente a sus pacientes durante las primeras dos horas tras las inyecciones, ya fuera mediante la hospitalización del animal o mediante el contacto estrecho con el propietario. Como en otros estudios,5 se informó a los propietarios sobre los acontecimientos adversos (AA) esperables (p. ej., leve aumento del picor después de la inyección) y recibieron instrucciones para ponerse en contacto inmediatamente con el veterinario si aparecía cualquier AA inesperado. En caso de AA, los veterinarios los clasificaban en función de su intensidad, duración, necesidad de medicación de rescate, desenlace y causa. Los niveles de intensidad de los AA considerados fueron: leve = poco o ningún malestar, signos esporádicos o continuos, estado de salud general y/o basal sin afectación, no es necesaria la intervención médica; moderado = algún malestar, signos esporádicos o continuos, estado de salud general y/o basal moderadamente afectado, puede ser necesaria la intervención médica; e intenso = malestar severo, signos continuos, estado de salud general y/o basal gravemente afectado, intervención médica muy probable. Para describir el desenlace, los AA se clasificaron como (1) resuelto, (2) resuelto con secuelas, (3) no resuelto, (4) muerte y (5) no se conoce. La causa de los AA se describió conforme al sistema ABON (EMA/CVMP/PhVWP/552/2003) como una de las cinco categorías siguientes: Categoría A = probable; Categoría B = posible; Categoría O = no clasificable/evaluable (acontecimientos para los que la información disponible es insuficiente para extraer conclusiones); Categoría O1 = no concluyente (acontecimientos en los que otros factores impiden llegar a una conclusión, pero no se puede descartar su asociación con el producto); Categoría N = relación con el producto improbable.
Estadística
Los datos descriptivos se ofrecen en forma de media y desviación estándar (DE) si siguen una distribución normal, y como mediana e intervalo si no siguen una distribución normal.
Las pruebas estadísticas y las comparaciones de datos para cada mes se relacionaron con los datos del mes 0 para el CADESI, la PM y los valores de IgE mediante la prueba de la "t" para datos emparejados y la prueba de los rangos con signo de Wilcoxon para los datos que no siguen una distribución normal. Se utilizó el programa informático SAS 9.4 (SAS Institute Inc., Cary, NC, EE. UU.) para todas las pruebas estadísticas. La significación se estableció en p <0,05.
Resultados
Animales
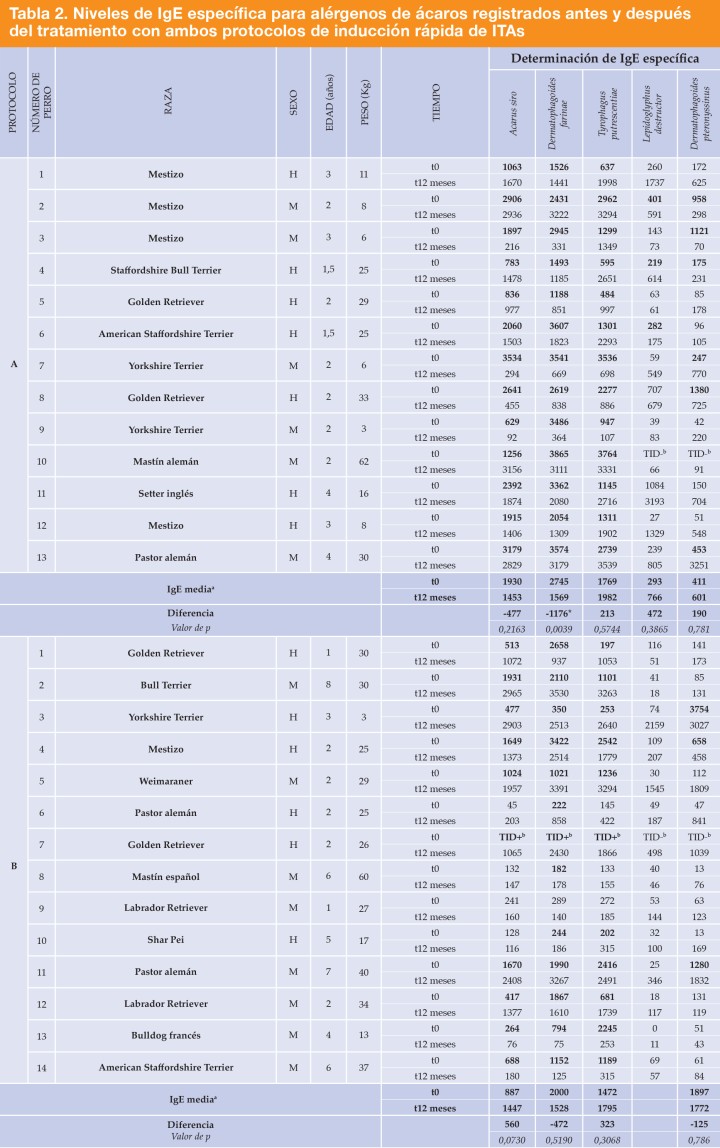
Los pacientes eran 27 perros atópicos sensibilizados al ácaro del polvo (D. farinae): 13 perros fueron asignados al protocolo A y 14 al protocolo B. La raza, la edad, el peso y el sexo de cada animal y los números asignados a cada uno de ellos se presentan en la Tabla 2.
El punto de corte para un resultado positivo de la prueba ELISA se estableció en 150 de acuerdo con las instrucciones del fabricante.
En negrita: niveles de IgE para los animales tratados para ese alérgeno (alérgeno específico incluido en la ITA).
*Diferencia significativa en la prueba de la t para datos apareados (la normalidad de los datos se comprobó con la prueba de Shapiro-Wilk).
aMedia y diferencia de la IgE teniendo en cuenta solamente los datos en negrita.
bDatos no disponibles, muestra no procesada. El test intradérmico fue positivo (TID+) o negativo (TID-) para cada alérgeno. Los datos de este animal no se incluyeron en el estudio estadístico.
Resultados serológicos (IgE alérgeno-específica)
La sensibilización a los diferentes ácaros se evaluó mediante determinaciones de la IgE específica en todos los perros salvo en uno, al que se realizó un test intradérmico. En ese caso, la positividad alta al extracto de Dermatophagoides farinae al test fue el criterio de inclusión. Los anticuerpos IgE específicos para todos los alérgenos analizados se determinaron antes y después de 12 meses de tratamiento con ITAs-R. Los resultados se muestran en la Tabla 2.
La única diferencia detectada fue una reducción significativa (p= 0,0039) de los niveles de IgE anti-Dermatophagoides farinae producidos tras el tratamiento con el protocolo A.
Eficacia
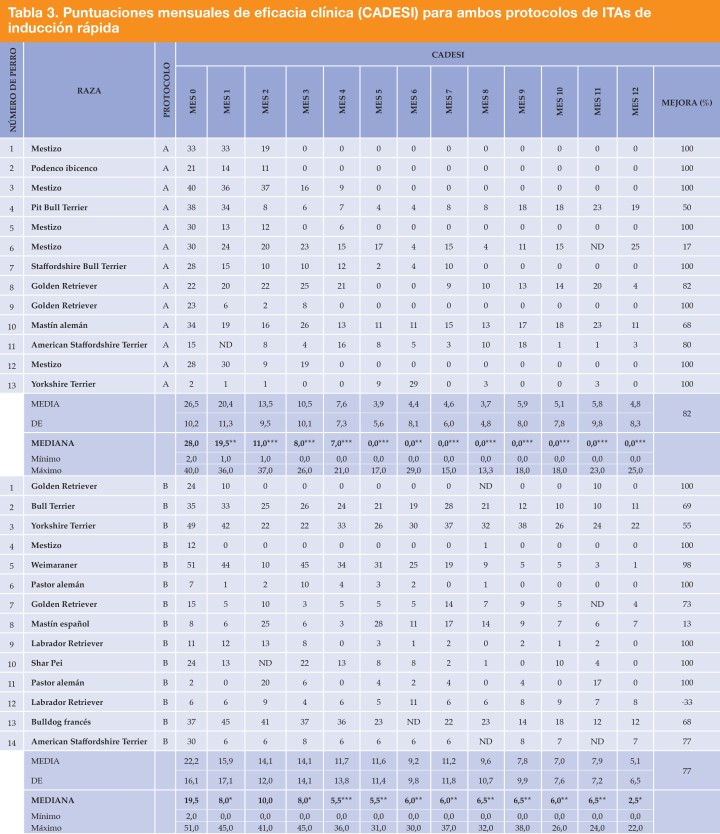
Después de 12 meses de tratamiento, las puntuaciones del índice CADESI se redujeron significativamente en ambos grupos y no se observaron diferencias significativas entre los protocolos (Tabla 3).
Los asteriscos indican una mediana significativamente diferente en comparación con el mes 0 (prueba de rangos con signo de Wilcoxon para datos que siguen una distribución normal). *Valor de p <0,05. **Valor de p <0,01. ***Valor de p <0,001. ND: datos no disponibles. Si una observación tenía un valor omitido para una variable de respuesta, la observación se excluyó del análisis de esa variable.
Se logró una reducción significativa desde el primer mes con ambos protocolos (protocolo A, valor de p= 0,004; protocolo B, valor de p= 0,010). Las puntuaciones al inicio (media ± DE) fueron 26,5 ±10,2 para el protocolo A, y 22,2 ±16,1 para el protocolo B. Después de 12 meses de tratamiento, estas puntuaciones fueron 4,8 ± 8,3 y 5,1 ± 6,5, lo que se traduce en una mejora media del 82 % y 77 %, respectivamente (Tabla 3). Cuando se consideran las mejorías individuales, se observó que con el protocolo A, el 84,6 % (11 de 13) de los animales mejoraron en más del 50 % y el 61,5 % (8 de 13) lograron puntuaciones del CADESI típicas de perros normales. Con el protocolo B, el 85,75 % (12 de 14) de los animales mejoraron en más del 50 % y en el 42,8 % (6 de 14) de los animales las lesiones desaparecieron por completo.
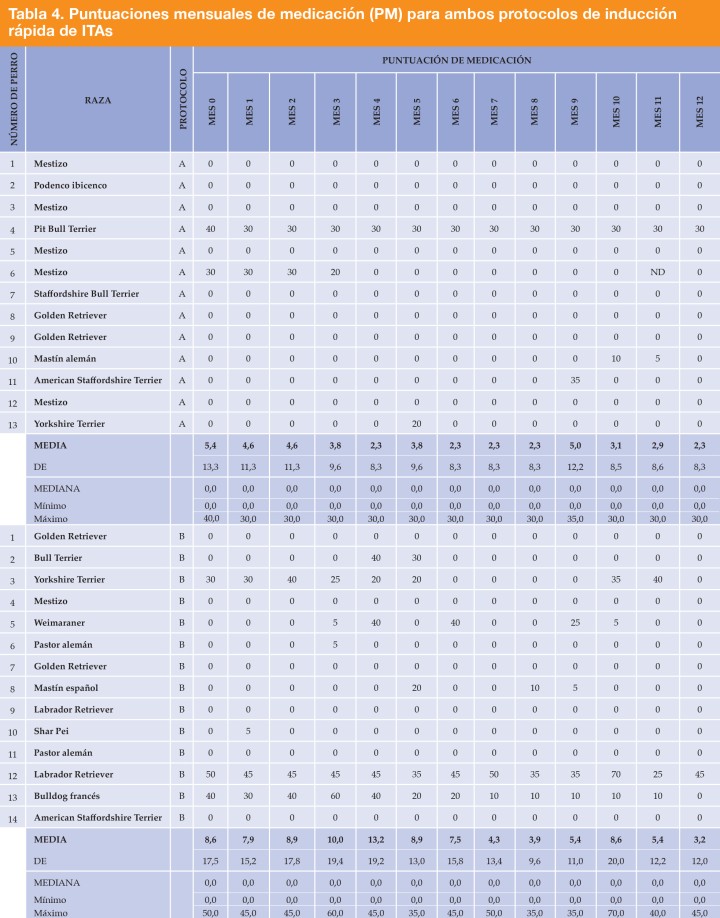
Dos animales del grupo del protocolo A necesitaban medicación al inicio del tratamiento, pero después de 12 meses de tratamiento uno de estos animales eliminó la medicación concurrente y el otro la redujo en un 25 %. En el grupo del protocolo B, tres animales comenzaron el tratamiento necesitando medicación y, después de 12 meses, solo uno de ellos todavía necesitaba medicación adicional. Si bien la PM media se redujo de 5,4 ± 13,3 a 2,3 ± 8,3 con el protocolo A y de 8,6 ± 17,5 a 3,2 ± 12 con el protocolo B, estas diferencias no fueron significativas (Tabla 4).
ND: datos no disponibles. Si a una observación le faltaba un valor para una variable de respuesta, la observación se excluyó del análisis de esa variable. Métodos estadísticos: prueba Wilcoxon de rangos con signo para datos que no siguen una distribución normal.
Seguridad
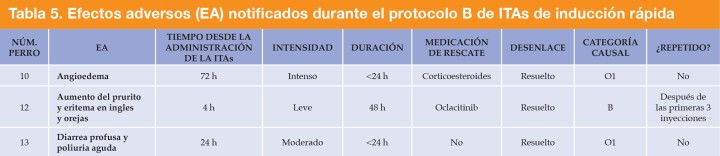
Se notificó que tres de los 27 perros experimentaron AA después de la primera inyección durante la fase de inducción, todos ellos en el grupo del protocolo B. Un AA se clasificó como categoría B, con una causalidad "posible" de la ITA, y consistió en un aumento del prurito y edema de las orejas y las ingles que se resolvió con oclacitinib. Los otros dos AA se clasificaron como categoría O1 (no concluyente), dado que no se pudo establecer ninguna relación entre la administración de la ITA y estos efectos. Estos dos AA de categoría O1 fueron angioedema a las 72 horas después de la inyección de ITA que requirió corticoesteroides como tratamiento de rescate en un perro, y diarrea profusa y poliuria aguda sin necesidad de medicación de rescate en otro perro. Los tres casos se resolvieron sin necesidad de hospitalización ni modificación del protocolo de ITAs-R (Tabla 5).
Discusión
En este estudio se evaluaron la eficacia y la seguridad de dos protocolos de inducción rápida de la ITAs. Se obtuvieron índices de eficacia superiores al 75 % en ambos casos y unos índices de seguridad aceptables.
Los protocolos de aumento rápido de la inducción se han estudiado en el pasado tanto en la medicina veterinaria como en la humana.15,16 Estos protocolos incluyen la inmunoterapia “rush” en la que la fase de inducción se reduce a 24/48 horas y las inyecciones se administran cada 30-60 minutos. Los protocolos “rush” han demostrado ser seguros y eficaces en varios estudios.6,8,17,18 Sin embargo, estos protocolos tienen el inconveniente de requerir premedicación y/o hospitalización preventiva de los animales para poder monitorizarlos durante esas 24/48 horas.8,18
Los protocolos utilizados en nuestro estudio fueron de inducción rápida de la inmunoterapia subcutánea (ITAs-R), pero no “rush”, dado que la fase de inducción se completó en un mes, frente a los 5 meses de la inmunoterapia convencional. Aunque algunos estudios en veterinaria han sugerido que la ITAs-R es segura, hasta donde sabemos no había datos de eficacia disponibles en la literatura para la ITAs-R.5
En este estudio piloto no controlado observamos tasas medias de mejora del índice CADESI del 82 % (protocolo A) y del 77 % (protocolo B) durante 12 meses de tratamiento, con una mejora significativa observada desde el primer mes (Tabla 3). Ciertamente, según los resultados de este estudio, no podemos afirmar que una inducción más rápida permita alcanzar un beneficio más rápido del tratamiento, ya que no se incluyó un grupo control que siguiera el protocolo convencional.5 Sin embargo, cabe destacar que en un estudio retrospectivo que estudiaba el mismo tratamiento junto con el protocolo convencional la mejora se observó más tarde, después de una media de 5 meses de tratamiento.2 Por lo tanto, aunque no podamos afirmarlo parecería que la ITAs-R añade al tratamiento con ITAs los beneficios de las terapias “rush”, tales como un procedimiento más sencillo y un menor tiempo hasta alcanzar la eficacia, al tiempo que evita los inconvenientes como la necesidad de hospitalización preventiva y otras cuestiones de seguridad. Como en nuestro protocolo, otros autores han podido reducir el tiempo hasta alcanzar la eficacia, pero con otros tipos de extractos más complejos, como los alergoides conjugados con manano, Der f 2 conjugado con pululano o incluso inmunoterapias con tirosina como adyuvante.19 En el presente estudio, solo se empleó inmunoterapia con extractos nativos precipitados con aluminio. Por tanto, parece que los protocolos de ITAs-R podrían ayudar a optimizar el uso de extractos nativos convencionales.
Dado que la ITA es una intervención modificadora de la alergia mediada por IgE, varios estudios han abordado las dinámicas de la IgE durante el tratamiento con ITA. En tres de esos estudios, los niveles de IgE descendieron durante el tratamiento, aunque la reducción solo fue significativa en dos de los estudios.20-22 Por contraste, no se observaron cambios después de 7 meses de inmunoterapia específica de ácaros vía oral.23 En nuestro caso, los niveles de IgE específica de Dermatophagoides farinae descendieron durante los 12 meses de tratamiento con ITA, pero solo se redujeron significativamente con el protocolo A. No obstante, para los otros ácaros, no se observó ningún patrón específico de cambio tras el tratamiento (Acarus siro, Tyrophagus putrescentiae, Lepidoglyphus destructor y Dermatophagoides pteronyssinus). El estudio de los niveles de IgE durante la ITA es importante para la búsqueda de un biomarcador adecuado para el éxito del tratamiento. Nuestros resultados, sin embargo, indican que otras moléculas podrían ser más apropiadas para este propósito. En efecto, la IL-10 también se ha estudiado como posible biomarcador pero todavía no se han obtenido resultados concluyentes.21,22,24
Varios investigadores también han sugerido el efecto de reducción de la medicación concurrente que tiene la ITA.2,8,12,24-27 En nuestro caso, la PM se redujo de forma efectiva tras el tratamiento con ITA, si bien los resultados no fueron significativos debido al gran número de animales que no recibían medicación concomitante. En un estudio retrospectivo previo de nuestro mismo equipo, constatamos un considerable efecto ahorrador de medicación en el 87 % de los animales tratados durante 12 meses y otros han descrito reducciones similares de la PM.2,8,12,25-27
La mayoría de las limitaciones del presente estudio se deben a su condición de estudio piloto, tales como el pequeño tamaño de la muestra. Otra limitación evidente es que se trata de un estudio abierto sin un grupo de control, o sin un grupo que siguiera un protocolo convencional. Por desgracia, esto no era posible a causa del diseño del estudio. No obstante, utilizamos las puntuaciones CADESI-04 y PM como puntuaciones validadas que deberían proporcionar resultados precisos comparables. El uso de medicación quedaba al criterio del veterinario, ya que no se disponía de un protocolo establecido, como, por ejemplo, según la intensidad de las lesiones, que podría dar lugar a resultados de PM más objetivos. Este punto parece relevante cuando se considera que algunos perros con un índice CADESI >35 no recibieron medicación durante varios meses. Asimismo, nos gustaría señalar que la puntuación PM utilizada en este estudio se basaba en los resultados de estudios previos, excepto para el lokivetmab, que se administró a un único perro durante dos meses consecutivos (perro 3 del protocolo B durante los meses 10 y 11).5,8,11-14 Otra limitación consiste en la ausencia de evaluación del prurito, principalmente porque la evaluación por parte de los propietarios no estaba incluida en este estudio piloto. Como signo distintivo de la dermatitis atópica, el prurito es difícil de evaluar en una visita clínica en medicina veterinaria. Por ello, generalmente es evaluado por el propietario utilizando una escala visual analógica del prurito. En cambio, el índice CADESI lo evalúa el veterinario mediante el examen de las lesiones producidas por el prurito (eritema, excoriación, alopecia y liquenificación). Por tanto, podría considerarse que en este estudio no evaluamos el prurito en sí mismo, sino sus consecuencias.
En resumen, la ITA convencional, aunque es efectiva, tiene varios inconvenientes asociados al periodo de inducción prolongado que hace peligrar el cumplimiento del protocolo terapéutico. Los protocolos de ITAs-R facilitaron la finalización exitosa del tratamiento aportando un protocolo más sencillo, reduciendo el tiempo de inducción y logrando tasas elevadas de eficacia y seguridad. Esto debería contribuir sin duda a mejorar el cumplimiento, la disposición y la satisfacción del propietario. Para confirmar nuestros resultados, deberían realizarse estudios aleatorizados controlados y ciegos con una población más numerosa.
Agradecimientos
Los autores desean expresar su agradecimiento a todos los veterinarios que han participado en el estudio: Marcos Fernández de C.V Navia, Sabina Artal de ADN Veterinaris, Alicia Cozar de C.V. Ciudad de los Ángeles, Anna Olivar de OM Veterinaris, Laura Cano de Vicalcan, Juan Francisco Cárdenas de Mascoderm, Monica Moré de H.V. Lauro, Iria Castro de Bichos Negreira, Eneida González de C.V. Lesseps, Patricia Ramon de C.V. El Castell e Isaac Carrasco de Vetland.
También queremos agradecer a Ana Burton su asistencia editorial y lingüística, y al Dr. Lluís Ferrer la revisión del manuscrito.
Fuente de financiación: El estudio fue financiado por LETI Pharma.
Conflicto de intereses: Laura Ramió-Lluch era empleada de LETI Pharma en el momento de la redacción del manuscrito.
Bibliografía
- 1.
Feng S, Xu Y, Ma R, et al. Cluster subcutaneous allergen specific immunotherapy for the treatment of allergic rhinitis: a systematic review and meta-analysis. PLoS One 2014; 9:e86529.
[PubMed] - 2.
Ramió-Lluch L, Brazís P, Ferrer L, Puigdemont A. Allergen-specific immunotherapy in dogs with atopic dermatitis: is owner compliance the main success-limiting factor? Vet Rec 2020; 187: 493.
[PubMed] - 3.
Calabria CW. Accelerated immunotherapy schedules. Curr Allergy Asthma Rep 2013; 13: 389-398.
[PubMed] - 4.
Spitznagel MB, Hillier A, Gober M, Carlson MD. Treatment complexity and caregiver burden are linked in owners of dogs with allergic/atopic dermatitis. Vet Dermatol 2021; 32: 192-e50.
[PubMed] - 5.
Herrmann I, Loft KE, Olivry T. Shortened immunotherapy dose-escalation saves time, but is it safe? A case-control study comparing the rates of adverse reactions between conventional and fast-escalation subcutaneous immunotherapy protocols during the induction phase. Vet Dermatol 2020; 31:454-e120.
[PubMed] - 6.
Mueller RS, Bettenay SV. Evaluation of the safety of an abbreviated course of injections of allergen extracts (rush immunotherapy) for the treatment of dogs with atopic dermatitis. Am J Vet Res 2001; 62:307-310.
[PubMed] - 7.
Trimmer AM, Griffin CE, Boord MJ, Rosenkrantz WS. Rush allergen specific immunotherapy protocol in feline atopic dermatitis: a pilot study of four cats. Vet Dermatol 2005; 16: 324-329.
[PubMed] - 8.
Hobi S, Mueller RS. Efficacy and safety of rush immunotherapy with alum-precipitated allergens in canine atopic dermatitis. Tierarztl Prax Ausg K Kleintiere Heimtiere 2014; 42: 167-173.
[PubMed] - 9.
Favrot C, Steffan J, Seewald W, Picco F. A prospective study on the clinical features of chronic canine atopic dermatitis and its diagnosis. Vet Dermatol 2010; 21: 23-31.
[PubMed] - 10.
Olivry T, Saridomichelakis M, Nuttall T, et al. International Committee on Allergic Diseases of Animals (ICADA). Validation of the Canine Atopic Dermatitis Extent and Severity Index (CADESI)-4, a simplified severity scale for assessing skin lesions of atopic dermatitis in dogs. Vet Dermatol 2014; 25: 77-85.
[PubMed] - 11.
Timm K, Mueller RS, Nett-Mettler CS. Long-term effects of intralymphatic immunotherapy (ILIT) on canine atopic dermatitis. Vet Dermatol 2018; 29: 123-e49.
[PubMed] - 12.
Fischer N, Tarpataki N, Leidi F, Rostaher A, Favrot C. An open study on the efficacy of a recombinant Der f 2 (Dermatophagoides farinae) immunotherapy in atopic dogs in Hungary and Switzerland. Vet Dermatol 2018; 29: 337-e118.
[PubMed] - 13.
Michels GM, Ramsey DS, Walsh KF, et al. A blinded, randomized, placebo-controlled, dose determination trial of lokivetmab (ZTS-00103289), a caninized, anti-canine IL-31 monoclonal antibody in client owned dogs with atopic dermatitis. Vet Dermatol 2016; 27: 478-e129.
[PubMed] - 14.
Saridomichelakis MN, Favrot C, Jackson HA, et al. A proposed medication score for long-term trials of treatment of canine atopic dermatitis sensu lato. Vet Rec 2021; 188: e19.
[PubMed] - 15.
Kim ME, Kim JE, Sung JM, et al. Safety of accelerated schedules of subcutaneous allergen immunotherapy with house dust mite extract in patients with atopic dermatitis. J Korean Med Sci 2011; 26: 1159-1164.
[PubMed] - 16.
Mueller RS, Jensen-Jarolim E, Roth-Walter F, et al. Allergen immunotherapy in people, dogs, cats and horses - differences, similarities and research needs. Allergy 2018; 73: 1989-1999.
[PubMed] - 17.
Mueller RS, Fieseler KV, Zabel S, Rosychuk RAW. Conventional and rush immunotherapy in canine atopic dermatitis. In: Hillier A, Foster AP, Kwochka KW, eds. Advances in Veterinary Dermatology V. Oxford: Blackwell Publishing, 2005: 60-69.
- 18.
Fujimura M, Ishimaru H. Rush sublingual immunotherapy in canine atopic dermatitis: a prospective pilot study. Pol J Vet Sci 2016; 19: 3-6.
[PubMed] - 19.
Tham HL, Olivry T. Determination of the efficacy rate and time-to-efficacy of subcutaneous immunotherapy in dogs with atopic dermatitis. Vet Dermatol 2022; 33: 155-e44.
[PubMed] - 20.
DeBoer DJ, Verbrugge M, Morris M. Clinical and immunological responses of dust mite sensitive, atopic dogs to treatment with sublingual immunotherapy (SLIT). Vet Dermatol 2016; 27: 82-7e23.
[PubMed] - 21.
Keppel KE, Campbell KL, Zuckermann FA, et al. Quantitation of canine regulatory T cell populations, serum interleukin-10 and allergen-specific IgE concentrations in healthy control dogs and canine atopic dermatitis patients receiving allergen-specific immunotherapy. Vet Immunol Immunopathol 2008; 123: 337-344.
[PubMed] - 22.
Olivry T, Paps JS, Dunston SM. Proof of concept of the preventive efficacy of high-dose recombinant mono-allergen immunotherapy in atopic dogs sensitized to the Dermatophagoides farinae allergen Der f 2. Vet Dermatol 2017; 28: 183-e40.
[PubMed] - 23.
Marsella R. Tolerability and clinical efficacy of oral immunotherapy with house dust mites in a model of canine atopic dermatitis: a pilot study. Vet Dermatol 2010; 21: 566-571.
[PubMed] - 24.
Martini F, Rostaher A, Favrot C, Fischer N. Interleukin 10 and transforming growth factor-beta 1 plasma levels in atopic dogs before and during immunotherapy. Vet Rec 2022; Jun 190(12): e1270.
[PubMed] - 25.
Kawano K, Mizuno T. A pilot study of the effect of pullulan-conjugated Der f 2 allergen-specific immunotherapy on canine atopic dermatitis. Vet Dermatol 2017; 28: 583-e141.
[PubMed] - 26.
González JL, Zalve V, Fernández-Caldas E, et al. A pilot study of immunotherapy in dogs with atopic dermatitis using a mannan-Dermatophagoides farinae allergoid targeting dendritic cells. Vet Dermatol 2018; 29: 449-e152.
[PubMed] - 27. [PubMed]
Fischer NM, Rostaher A, Favrot C. A comparative study of subcutaneous, intralymphatic and sublingual immunotherapy for the long-term control of dogs with nonseasonal atopic dermatitis. Vet Dermatol 2020; 31: 365-e96.