Staphylococcus multirresistentes a los antibióticos y su importancia en medicina veterinaria
Antibiotic multiresistant Staphylococcus and their importance in veterinary medicine
A. M. Ríos, M. R. Baquero, G. Ortiz, T. Ayllón, L. Smit, M. Rodríguez-Domínguez, A. Sánchez-Díaz
Contacto: ariosboe@uax.es
Resumen
Staphylococcus intermedius ha sido durante los últimos años el principal Staphylococcus coagulasa positivo patógeno aislado de la piel y de las mucosas del perro. Sin embargo, hallazgos recientes han cambiado nuestro conocimiento del termino “S. intermedius”, y han conducido a los bacteriólogos a asegurar una identificación correcta de las especies de Staphylococcus patógenas en pequeños animales. En primer lugar, el aumento del reconocimiento de cepas de Staphylococcus aureus resistentes a la meticilina (SARM) en la práctica de pequeños animales y su implicación en la salud humana, ha demandado una adecuada identificación de estas especies. Segundo, la aplicación de técnicas moleculares ha llevado a la revisión taxonómica de los S. intermedius, que han sido renombrados como pseudintermedius. Por ultimo, el rápido y reciente surgimiento de cepas de Staphylococcus pseudintermedius resistentes a la meticilina (SPRM) y a otras familias de antibióticos, constituyen un reto terapéutico en la práctica veterinaria de todo el mundo. Este artículo resume los recientes conocimientos en relación con los cambios taxonómicos del género Staphylococcus, revisando los aspectos más importantes de los SPRM y su implicación en el diagnóstico de laboratorio y en el manejo clínico y prevención de este patógeno en la clínica veterinaria diaria.
Palabras clave: SPRM, Staphylococcus pseudintermedius, Staphylococcus multirresistentes.
Summary
Staphylococcus intermedius has been the predominant coagulase-positive Staphylococcus isolated from canine skin and mucosae and the most commonly reported staphylococcal pathogen in small animal practice for the last years. However, recent developments have changed our understanding of the term “S. intermedius” and have challenged bacteriologists to ensure correct species identification of pathogenic staphylococci from small animals. First, the increasing recognition of meticillin-resistant Staphylococcus aureus (MRSA) in small animal practice and its human health implications, demand accurate species identification. Secondly, the application of molecular techniques has led to a revised taxonomy of canine isolates of S. intermedius, being re-named S. pseudintermedius. Thirdly, the recent, rapid emergence of meticillin- and multi-drug-resistant strains of Staphylococcus pseudintermedius (MRSP), has become a major therapeutic challenge in veterinary practice worldwide. This article discusses the background of the recent taxonomic changes within the genus Staphylococcus and reviews the key features of MRSP and its implications for day-to-day laboratory diagnosis, clinical management and prevention in small animal practice.
Keywords: RMSP, Staphylococcus pseudintermedius, Multi-drug-resistant Staphylococcus.

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
Staphylococcus aureus es fundamentalmente un comensal humano, mientras que Staphylococcus pseudintermedius es la bacteria comensal más frecuente en piel y mucosas de la especie canina, pudiendo convertirse en un patógeno ocasional.1
Los recientes cambios en la taxonomía del Staphylococcus y el surgimiento de cepas resistentes a la meticilina y a otras familias de antibióticos, ha complicado el tratamiento de las infecciones por este tipo de bacterias de forma considerable, renovando el interés de la comunidad científica en el Staphylococcus pseudintermedius. En los últimos años se han desarrollado nuevas herramientas de diagnóstico, que han permitido obtener un conocimiento más extenso de la ecología, epidemiología, y virulencia de esta especie.1
Las bacterias del género Staphylococcus resistentes a la meticilina (SRM), principalmente S. aureus y S. pseudintermedius (SARM y SPRM), constituyen un reto para la profesión veterinaria, ya que pueden ser una causa de morbilidad y mortalidad en animales de compañía y de abasto. Estas bacterias, además, pueden constituir un riesgo zoonótico. Independientemente del riesgo de transmisión, el miedo a una situación de contagio puede afectar a los lazos de unión entre las personas y sus mascotas. Por otra parte, la colonización en animales domésticos por este tipo de microorganismos puede constituir un riesgo sanitario para los profesionales veterinarios.
Otro factor de preocupación en este momento, estriba en la diseminación geográfica y la transmisión horizontal de genes de resistencia desde los SPRM a bacterias patógenas pertenecientes a la especie humana. Por lo tanto, es de vital importancia la implantación de rigurosas medidas de higiene y educación sanitaria en propietarios y personal sanitario que estén en contacto con mascotas infectadas con SRM.2
Debido, además, a que la aparición de los SPRM parece estar relacionada con la utilización de antibióticos, la restricción legal del uso de antimicrobianos en medicina veterinaria es una medida que está en el horizonte, al menos en algunos países de nuestro entorno.2 Por lo tanto, la investigación de estrategias terapéuticas óptimas con los antibióticos existentes, y las alternativas a los tratamientos convencionales, incluyendo las terapias tópicas, requieren de estudios científicos urgentes. Todos los esfuerzos deben estar dirigidos a la utilización responsable de los antibióticos por el profesional veterinario, evitando el uso de aquellos que estén reservados para su utilización en personas gravemente enfermas.
En la actualidad hay una evidencia comprobada de que los hospitales veterinarios juegan un papel en la trasmisión de organismos multirresistentes, no sólo debido a la administración de antibióticos, sino también por el estrecho contacto que se establece entre personas y animales.1,2 Por lo tanto, las medidas de control y bioseguridad ambiental, son otras de las asignaturas pendientes en clínicas y hospitales veterinarios (utilización juiciosa de los antibióticos, medidas de asepsia en los procedimientos quirúrgicos y médicos, aislamiento de pacientes infectados con SRM).
Otro aspecto importante, es el relacionado con la variabilidad fenotípica de las bacterias pertenecientes al “Grupo S. intermedius” (GSI) y la necesidad de una diferenciación fiable entre los SARM y los SPRM, los cuales representan un reto para los laboratorios de diagnóstico veterinario, donde los procedimientos rutinarios de diagnóstico microbiológico deberán ser revisados y actualizados.1
Introducción al Staphylococcus spp
El género Staphylococcus está constituido por cocos, Gram-positivos, catalasa positivos, anaerobios facultativos, que generalmente se encuentran formando agrupaciones cuando se observan al microscopio.2,3 Las especies más patógenas poseen coagulasa, una enzima que coagula el plasma, ya que convierte el fibrinógeno en fibrina. Los Staphylococcus coagulasa negativos (SCoN) son patógenos menores que generalmente causan infecciones oportunistas en pacientes inmunocomprometidos.
Las bacterias del género Staphylococcus son bacterias patógenas oportunistas en la mayoría de las especies animales. Las especies coagulasa positivas con mayor significación clínica son: Staphylococcus pseudintermedius, Staphylococcus aureus, Staphylococcus hyicus y Staphylococcus schleiferi subsp. coagulans (SSCoP) . S. aureus es el patógeno más frecuente en el hombre, mientras que S. pseudintermedius y S. schleiferi son los principales patógenos en el perro.4-6
Diversidad genética del Staphylococcus. Reclasificación de la especie
S. pseudintermedius fue descrito en el año 2005, tras realizar análisis moleculares de muestras de gatos, perros, caballos y loros. Su fenotipo era similar al S. intermedius y al S. delphini, especies descritas procedentes de delfines en 1988.7 En el año 2007, dos grupos de investigación publicaron detalles del análisis filogenético de muestras de S. intermedius de Japón8 y Europa,9 con hallazgos similares. Estos autores demostraron que todas las cepas provenientes de perros, gatos y seres humanos fueron muestras de S. pseudintermedius. La mayoría de las cepas provenientes de paloma torcaz fueron S. intermedius, y la mayoría de las cepas derivadas de caballos y palomas domésticas fueron ejemplos de S. delphini.
Los recientes estudios moleculares, consolidan la aparición del término “Grupo S. intermedius” (GSI), el cual comprende tres grandes subgrupos: S. intermedius, S. delphini y S. pseudintermedius.8-11
Se ha propuesto que todas las cepas provenientes de perros pertenecen a S. pseudintermedius, a menos que futuras investigaciones del genoma evidencien nuevas especies relacionadas.12
Patogenicidad de las especies de Staphylococcus
Las infecciones superficiales son consecuencia de alteraciones de los mecanismos de defensa de barrera de la piel y membranas mucosas, secundarias a alteraciones físicas o inmunológicas. Las infecciones invasivas son consecuencia de la ascensión a lo largo de los tractos epiteliales, a través de heridas penetrantes o mediante propagación hematógena. Las bacterias del género Staphylococcus son habitantes normales de la piel y de las membranas mucosas de todos los mamíferos y aves. En consecuencia, definir qué es “patógeno” puede suponer todo un desafío clínico. Tradicionalmente, se ha considerado como patógenos “verdaderos” a los Staphylococcus coagulasa positivos (SCoP), tales como S. aureus, S. pseudintermedius y S. hyicus, mientras que los Staphylococcus coagulasa negativos (SCoN) se han considerado como residentes o comensales transitorios no patógenos. Sin embargo, es probable que este punto de vista sea demasiado simple, y el paradigma esté cambiando en medicina humana.13 Esto ocurre, en parte, por el aumento de la prevalencia de situaciones de inmunosupresión en la población humana, lo que ha permitido una mayor susceptibilidad a organismos menos virulentos. Para agravar el problema, los SCoN suelen expresar unos patrones de amplia resistencia a antibióticos.14
En perros sanos, S. pseudintermedius es parte de la microflora cutánea y coloniza la piel, el pelo y en particular las uniones mucocutáneas como la nariz, boca y ano (Fig 1).1,4,5,15,16 La piel de los cachorros está colonizada por el S. pseudintermedius poco después de nacer, posiblemente por una transmisión vertical a través de la madre.17
Figura 1
Porcentaje de colonización de Staphylococcus pseudintermedius en las diferentes partes del cuerpo del perro (Datos obtenidos de: Bannoehr J, Guardabassi L. Staphylococcus pseudintermedius in the dog: taxonomy, diagnostics, ecology, epidemiology and pathogenicity. Vet Dermatol 2012; 23(4):253–66, e51–2).
S. pseudintermedius constituye el 90% de los Staphylococcus aislados de los portadores sanos y de los perros con problemas cutáneos.6,18-20
S. pseudintermedius no coloniza de forma habitual al ser humano, pero la transmisión entre el perro y su dueño es posible y se ha descrito recientemente en varios estudios. El S. pseudintermedius tiene una prevalencia que oscila entre el 0% en personas sanas, al 0,05% en personas hospitalizadas, y del 3,7% en propietarios de perros sanos, al 31% de propietarios con perros atópicos.20-24
Parecen existir marcadas diferencias en la ecología del S. pseudintermedius comparado con S. aureus. Por ejemplo, las fosas nasales de las personas es el principal nicho del S. aureus, mientras que S. pseudintermedius coloniza principalmente la cavidad oral y la zona perianal del perro (Fig. 1). Además, la presencia de S. pseudintermedius en el perro es más frecuente y más heterogénea que su homólogo en el ser humano. Esta colonización frecuente y heterogénea puede ser el reflejo de los patrones de comportamiento y aseo de la especie canina.1
S. pseudintermedius es un patógeno oportunista y no causa enfermedad, a menos que falle la resistencia del hospedador o que la barrera cutánea se altere por factores como: dermatitis atópica, procedimientos médicos, quirúrgicos o factores ambientales. Se desprenden de la piel y el pelo hacia el ambiente y pueden sobrevivir durante meses.3 En general, la infección bacteriana no suele ser contagiosa entre animales infectados y animales sanos.
De forma similar a lo que sucede con la infección por S. aureus en personas, la colonización parece ser un factor de riesgo y, en la mayoría de las situaciones, los perros se infectan con cepas que colonizan su propio cuerpo.1
S. pseudintermedius se adhiere a los queratinocitos de la piel en perros sanos, pero su capacidad de adherencia es mayor en perros atópicos25-28. S. pseudintermedius es el principal patógeno en las piodermas superficiales y profundas. Además, se aísla frecuentemente en otitis externas, heridas infectadas e infecciones del tracto urinario del perro.1,18
Comparado con S. aureus, conocemos relativamente poco sobre la patogénesis de la infección por S. pseudintermedius. Sabemos que produce factores de virulencia similares al S. aureus como coagulasas, proteasas, termo nucleasas, y toxinas como la hemolisina, toxinas exfoliativas y enterotoxinas.29 S. pseudintermedius tiene la capacidad para unirse al fibrinógeno, fibronectina y citoqueratina, indicando la presencia de adhesinas superficiales similares a otras bacterias Gram-positivas. Además, una proteína captadora de inmunoglobulinas, similar a la proteína A producida por el S. aureus, se ha secuenciado y caracterizado parcialmente.29
Identificación fenotípica y genotípica de las especies de Staphylococcus
Antes del surgimiento de los SARM como patógenos en el perro, la identificación de especie de los Staphylococcus coagulasa positivos (SCoP) aislados en perros no tenía importancia clínica; sin embargo, la identificación de la especie y la diferenciación entre S. aureus y S. pseudintermedius es esencial actualmente, ya que existen diferencias sustanciales en cuanto al potencial zoonótico entre estas dos especies, y sus puntos de corte en las pruebas de sensibilidad in vivo pueden ser diferentes.3
En la actualidad, la diferenciación entre los miembros del GSI requiere tests moleculares.8,30 Sin embargo la diferenciación entre S. aureus y S. pseudintermedius es factible mediante la realización cuidadosa de test fenotípicos.3
S. pseudintermedius contiene más de 60 genotipos diferentes, lo cual indica una gran diversidad genética; sin embargo, se han aislado los mismos genotipos en diferentes países, lo que sugiere una amplia distribución de los clones predominantes. La diversidad clonal y su amplia distribución geográfica, sugieren que S. pseudintermedius ha evolucionado con su hospedador durante un largo periodo de tiempo en términos evolutivos.11 Los genotipos de S. pseudintermedius asociados a enfermedad en los seres humanos son idénticos a los de los comensales aislados en perros, lo que sugiere que las infecciones humanas son debidas a una transmisión zoonótica por parte del perro.31
Resistencia a los antibióticos del género Staphylococcus. Aparición de SARM y SPRM
Desde el punto de vista histórico, las infecciones por bacterias del genero Staphylococcus estaban asociadas a una gran morbilidad y mortalidad.32 Con el descubrimiento de la penicilina, este panorama cambió. La penicilina y otros antibióticos β-lactámicos actúan inhibiendo las trans-peptidasas, necesarias para la formación de peptidoglicanos en la pared celular de la bacteria.33 Algunos Staphylococcus producen una enzima β-lactamasa que destruye el anillo β-lactámico de las penicilinas, haciéndolas ineficaces.33
La meticilina fue desarrollada como un antibiótico resistente a las β-lactamasas. Un año después de la introducción de la meticilina en 1960, se aisló la primera cepa de S. aureus resistente a la misma.34
Pese a que la meticilina fue rápidamente descartada como medicamento debido a sus efectos adversos, algunos Staphylococcus resistentes a los antibióticos β-lactámicos todavía son denominados en la actualidad como resistentes a la meticilina.32,35
Los Staphylococcus resistentes a la meticilina son resistentes a todos los antibióticos β-lactámicos, incluyendo las cefalosporinas, las penicilinas, las combinaciones con ácido clavulánico y los antibióticos carbapenémicos, aunque se han descrito Staphylococcus resistentes a la meticilina sensibles a las cefalosporinas de cuarta y quinta generación.36,37 Actualmente, se utiliza la oxacilina en los laboratorios microbiológicos para comprobar la sensibilidad de una bacteria a la totalidad de esta clase de antibióticos.38
La resistencia a la meticilina tiene una importancia relevante debido a la presencia del gen mecA, el cuál codifica una proteína fijadora de penicilinas alterada (PBP2a) que tiene una afinidad baja por todos los antibióticos beta-lactámicos.39 Entre los Staphylococcus, el gen mecA se localiza en un elemento genético móvil conocido como SCCmec. Este gen ha sido identificado en S. aureus, S. schleiferi subsp. coagulans, S. schleiferi subsp. schleiferi (SSCoN) y S. pseudintermedius.40,41 La evolución y el origen del gen mecA es desconocido, aunque se ha sugerido que podría haber surgido a partir del Staphylococcus sciuri, una bacteria coagulasa negativa que se aísla frecuentemente en animales.42
El gen mecA, transportado en el “cassette” cromosómico móvil SCCmec, puede ser transferido de un Staphylococcus a otro de la misma o diferente especie.43 Por lo tanto, un Staphylococcus sensible a los antibióticos β-lactámicos puede volverse resistente a dichos antibióticos a través de la transferencia horizontal del SCCmec de una cepa resistente, creando una nueva cepa de S. pseudintermedius resistente a la meticilina.43
Otro factor preocupante es la aparición de organismos multirresistentes. La multirresistencia fue definida (por Coombs y colaboradores) como la resistencia mostrada in vitro al menos a tres clases diferentes de antibióticos, además de a los antibióticos β-lactámicos.35,44,45 Un estudio realizado por Bemis y colaboradores, observó que más del 90% de los SPRM eran resistentes a más de 4 familias de antibióticos.46
Resistencia a los antibióticos del SPRM
En el pasado, la mayoría de las infecciones por S. pseudintermedius eran tratadas con éxito con antibióticos elegidos de forma empírica o en base a un antibiograma. La resistencia a múltiples antibióticos, descrita por Coombs, así como la resistencia al menos a tres clases diferentes de antibióticos, además de a los β-lactámicos, ha sido extremadamente rara.45,47-50 De hecho, la resistencia a cualquier tipo de cefalosporinas de primera generación, hace unos años no estaba documentada.47 En Europa se describió por primera vez en el año 2005 un S. pseudintermedius procedente de un perro asistido en una clínica dermatológica del centro de Alemania, resistente a la meticilina y a otros tipos de antibióticos.41
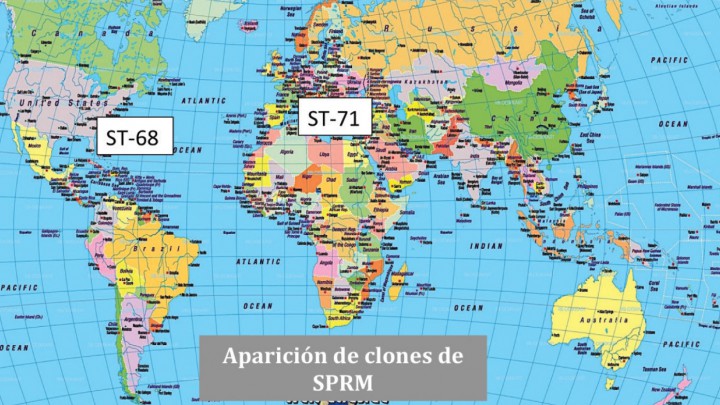
En los últimos años se han identificado un número creciente de SPRM en Europa, principalmente durante los años 2005 y 2006.41,51-53 A semejanza del S. pseudintermedius, la sensibilidad a los antibióticos del SPRM también parece tener variación geográfica.50,52,54-56 El clon predominante de SPRM en America del Norte es el ST-68, mientras que en Europa y Asia el clon predominante es el ST-71 (Fig. 2).18
Figura 2
Epidemiología del SPRM. Distribución geográfica de los clones ST-68 y ST-71.
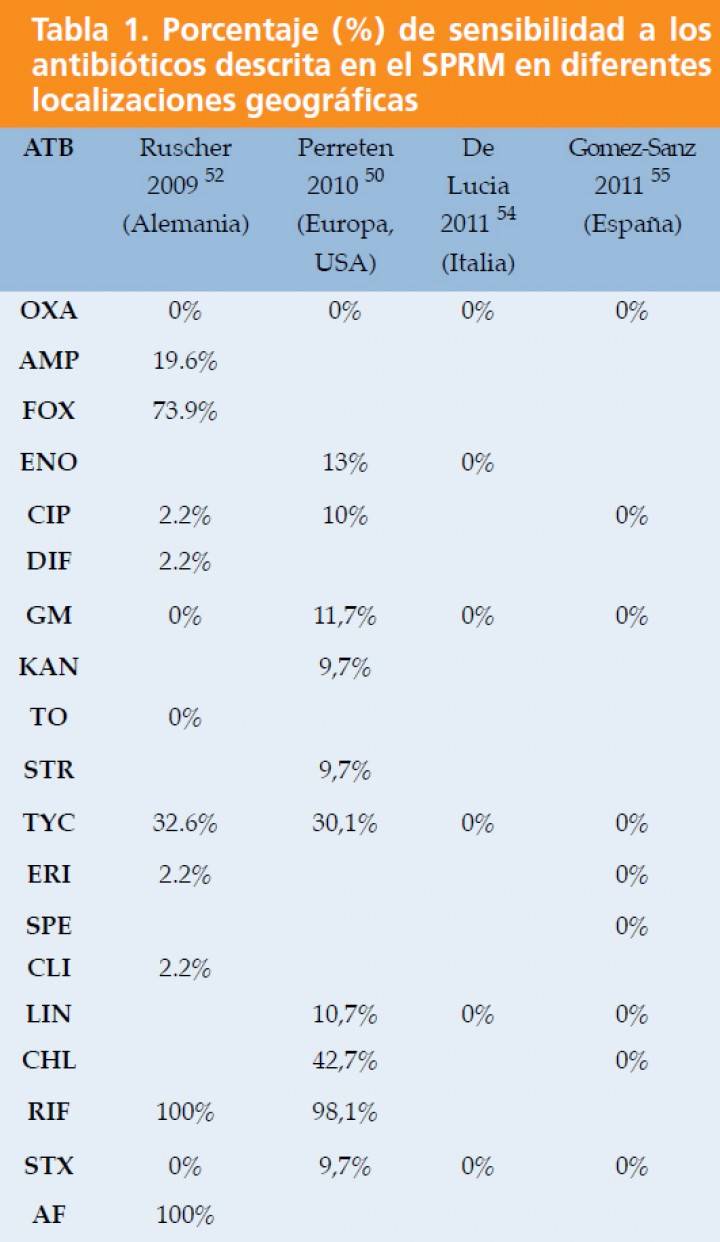
Según los datos disponibles en América del Norte, la mayoría de los SPRM son sensibles al cloranfenicol, la rifampicina y la amikacina; mientras que en Europa, los organismos son resistentes al cloranfenicol, pero sensibles a la minocilina, lo cual puede indicar diferencias en los patrones de sensibilidad de los SPRM en diferentes localizaciones geográficas (Tabla 1).18
ATB: antibiótico. Siglas antibióticos: Oxacilina (OXA); Ampicilina (AMP); Cefoxitina (FOX); Enrofloxacina (ENO); Ciprofloxacina (CIP); Difloxacino (DIF); Gentamicina (GM);Kanamicina (KAN); Tobramicina (TO);Tetraciclina (TYC); Eritromicina (ERI); Espiramicina (SPE); Clindamicina (CLI); Lincomicina (LIN); Cloranfenicol (CHL); Rifampicina (RIF); Sulfametoxazol-Trimetroprim (STX); Acido Fusídico (AF).
SPRM en los animales, en el ser humano y en el ambiente
Colonización e infección por SPRM en el perro
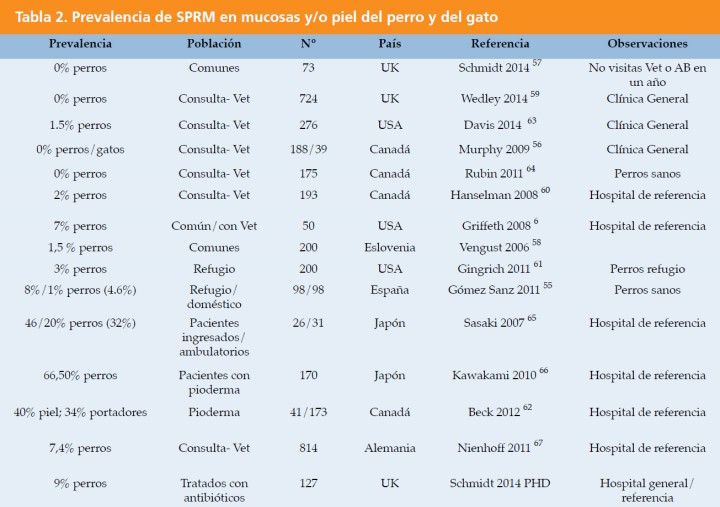
La prevalencia de SPRM en perros sanos oscila del 0 al 7%, del 3 al 8% en perros de refugio, y del 7 al 66% en perros con piodermas (Tabla 2).6,13,55,57-68
La prevalencia de SPRM en mucosas de perros parece variar también con la localización geográfica. Estudios realizados en Japón en el 2010 señalan una prevalencia del 66,7 % en perros con pioderma.66
En Europa la prevalencia en perros descrita es menor, pero se ha incrementado en los últimos años.41,52,55,57-59,69
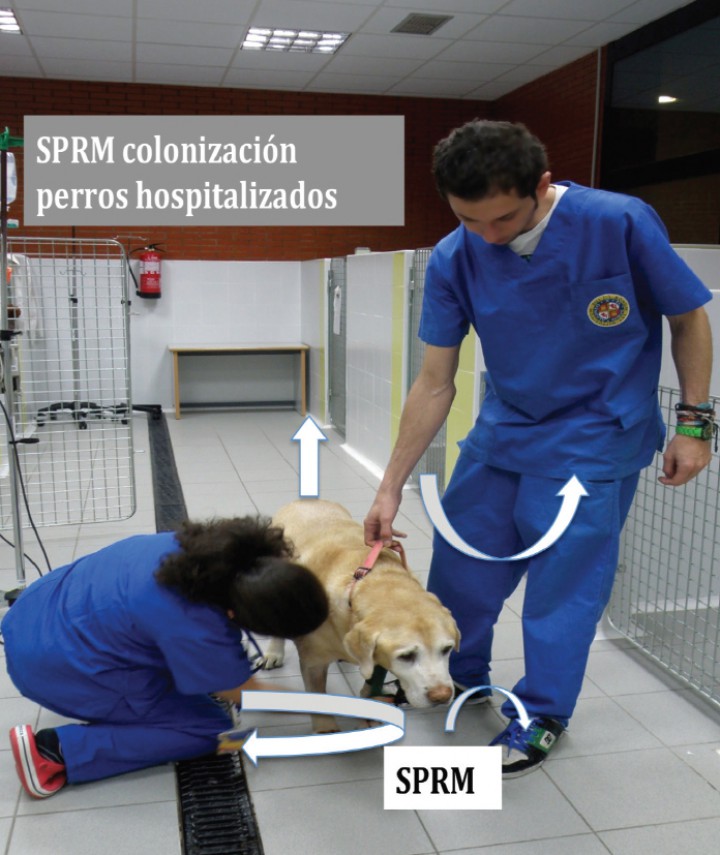
Los factores de riesgo en el perro, de padecer infecciones o colonizaciones por SPRM descritos en la literatura científica son: haber estado hospitalizado, haber recibido tratamiento con antibióticos y, en menor medida, haber sido tratado con glucocorticoides y recibido medicación tópica para el oído (Fig. 3).67,70-73
Figura 3
Colonización por SPRM en animales hospitalizados. Los perros que permanecen hospitalizados y/o han recibido antibióticos tienen más riesgo de padecer colonizaciones o infecciones por SPRM. A su vez, pueden contaminar a los profesionales veterinarios, a los enseres y al ambiente.
Colonización e infección por SPRM en personas
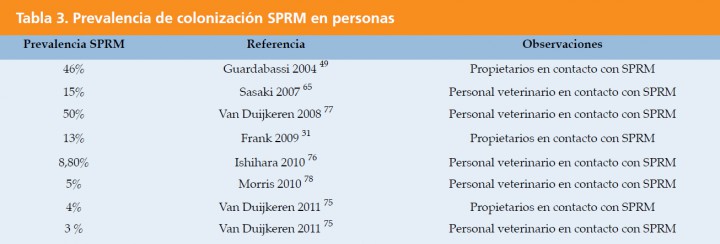
La colonización en personas por SPRM aumenta si están en contacto con una mascota con SPRM, oscilando entre el 3-50% en propietarios y veterinarios clínicos.49,66,71,73-75 En la actualidad se considera que los veterinarios y el personal de hospitales y clínicas veterinarias son portadores nasales de SPRM con una frecuencia de un 3-5,3% (Tabla 3).61,64,74-76
Varios trabajos demuestran que existe un intercambio de Staphylococcus entre animales en contacto, pero que la colonización en personas es poco frecuente y transitoria.61,75,79,80 Aunque la colonización sin sintomatología por S. pseudintermedius procedentes del perro sucede en raras ocasiones, puede acarrear dificultades terapéuticas si se trata de un SPRM.81 Por lo tanto, el SPRM canino debe considerarse como una fuente potencial de transmisión del SCCmec y de otros elementos móviles que determinen la resistencia a los antibióticos de Staphylococcus en piel y mucosas de personas.49
Presencia de SPRM en el ambiente y en los enseres
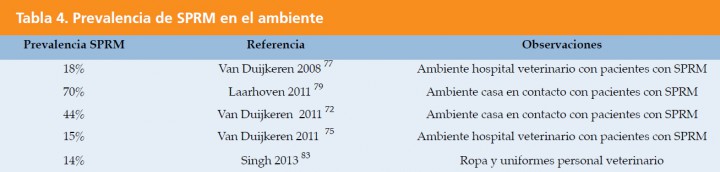
La dispersión del S. pseudintermedius procedente de la piel del perro y del gato es la causa de la aparición de esta bacteria en el medio ambiente, y puede servir como reservorio de patógenos multirresistentes.77,82 La siguiente tabla resume la prevalencia de SPRM descrita en diferentes ambientes que han estado en contacto con pacientes colonizados o infectados por SPRM (Tabla 4).
Los SPRM se han aislado en hogares seis meses después de la resolución de la infección en el perro y en lugares inaccesibles a la mascota.79
En los hospitales de personas, la permanencia en unidades de cuidados intensivos (UCIs) representa un factor de riesgo para ser colonizado por SRM.84 Este incremento en el riesgo parece producirse a causa de la utilización de grandes dosis de antibióticos y de muchos procedimientos diagnósticos y terapéuticos agresivos, como catéteres intravenosos y urinarios. Estos factores de riesgo no están bien definidos en veterinaria, pero teniendo en cuenta que el área de hospitalización de los hospitales veterinarios es un lugar donde coinciden un alto número de personas trabajando y animales confinados, es bastante probable que las zonas de hospitalización sean las áreas con mayor colonización ambiental por SRM.
Los SRM parecen sobrevivir durante meses en el ambiente y pueden ser aislados de cualquier superficie hospitalaria, incluyendo mesas de tratamiento, jaulas, tiradores de puertas y suelos, permaneciendo en el ambiente durante largos períodos de tiempo (Fig. 3).18,82,83,85-90
Tratamiento de las infecciones por SPRM e importancia en la salud pública
Aunque las bacterias del género Staphylococcus resistentes a la meticilina no están siempre asociadas a la resistencia a múltiples antibióticos, la mayoría de los SPRM descritos en la literatura científica son resistentes a gran parte de los medicamentos más relevantes en veterinaria.
El clon Europeo dominante de SPRM, el ST-71, presenta resistencia a los antibióticos β-lactámicos, aminoglicósidos, macrólidos, lincosamidas, tetraciclinas, cloranfenicol, trimetroprim y fluoroquinolonas; y solo es sensible a la amikacina, ácido fusídico, rifampicina, minocilina, vancomicina, teicoplanina y linezolid. La mayoría de estos medicamentos no tienen licencia para utilizarse en animales de compañía en algunos países Europeos.45,91
En el año 2009, el Grupo Integrado de Vigilancia en Resistencia Antimicrobiana (AGISAR), perteneciente a la Organización Mundial para la Salud (WHO), editó un documento para ayudar a formular y priorizar riesgos y establecer estrategias para luchar contra la resistencia antimicrobiana.92 Los agentes antibacterianos fueron clasificados como importantes, altamente importantes, y de importancia crítica teniendo en cuenta su papel como única terapia o como parte de una serie de alternativas para tratar enfermedades humanas de carácter grave, o enfermedades causadas por organismos transmitidos por una fuente no-humana, o por organismos que tuvieran capacidad de adquirir resistencias en fuentes no-humanas.92
La amikacina y la rifampicina son mencionadas como de importancia crítica para el tratamiento de las infecciones por micobacterias en medicina humana, mientras que la vancomicina, la teicoplanina y el linezolid son de importancia crítica en el manejo de los SARM y Enterococcus multirresistentes. El ácido fusídico es el único antibiótico activo contra los SPRM caninos que está fuera de esta categoría, siendo altamente importante en relación con el tratamiento de los SARM.92
Las infecciones cutáneas superficiales y algunas heridas provocadas por SPRM pueden ser tratadas con terapia tópica combinada con la corrección de las causas subyacentes, además de la eliminación de material extraño como suturas e implantes. Loeffler y colaboradores resolvieron cinco casos de siete, en perros con pioderma superficial causada por SPRM, utilizando ácido fusídico, clorhexidina tópica o champú de lactato de etilo41. Un estudio reciente, que compara la eficacia in vitro de champús antibacterianos, ha demostrado que la clorhexidina es más efectiva, tanto para el SPRM como para el SARM, que el peróxido de benzoilo y el lactato de etilo.93 El tiempo de contacto recomendado es de 10 minutos, con una frecuencia de tres lavados semanales.93,94 Para lesiones focales se ha recomendado la clorhexidina en spray, la mupirocina en crema, el gel de peróxido de benzoilo, el ácido fusídico o la nisina.95,96
La rifampicina es un antibiótico bactericida activo contra la mayoría de los SPRM.35 Puede administrarse de forma oral, pero tiene un alto riesgo de crear resistencias durante el tratamiento, especialmente si se utiliza en solitario; además produce hepatotoxicidad, por lo que se debe seguir un estricto seguimiento médico.97 Se han descrito SPRM que de forma individual son resistentes a la rifampicina.45,97
La resistencia a la vancomicina, a la teicoplanina y al linezolid no ha sido descrita hasta el momento,45,52 aunque la comunidad científica ha cuestionado si es apropiado utilizar estos medicamentos en animales, por las razones expuestas previamente.51
La literatura científica recomienda la descolonización como terapia adyuvante en las infecciones por SRM, aunque su eficacia es controvertida. Agentes tópicos como la mupirocina, el ácido fusídico o la clorhexidina se aplican en las localizaciones portadoras con el objetivo de erradicar los SRM y permitir la colonización de otros Staphylococcus menos resistentes. Hasta el momento no se han realizado estudios relacionados con la descolonización nasal/anal en perros con SPRM, aunque se ha demostrado que el ácido fusídico reduce la colonización de S. pseudintermedius en perros de raza Beagle sanos.98 La terapia sistémica con cefpodoxima no elimina los SCoP en lugares de colonización,99 además de que las cefalosporinas de tercera generación son de importancia crítica en medicina humana.
Medidas de prevención y control de las infecciones por SRM
Existe una amplia documentación del control de las infecciones por SARM en medicina humana que puede ser aplicable en medicina veterinaria. Sin embargo, algunas medidas no se pueden extrapolar, ya que existen diferencias epidemiológicas.100 A semejanza de la medicina humana, la higiene de las manos es una parte fundamental para la prevención de la diseminación de SARM y SPRM entre animales, y entre animales y personas.101 El lavado de las manos y la desinfección de las superficies de trabajo entre pacientes con productos de base alcohólica, suele ser un método adecuado (Fig. 4).18,37,102,103 Otras medidas de prevención incluyen el vestir uniformes que puedan ser lavados en la empresa, la utilización de guantes y mascarillas desechables, así como la utilización de gafas si se utilizan aerosoles (Fig. 4). El uso de técnicas quirúrgicas estrictamente asépticas es fundamental para el control de los SARM y SPRM. Aunque la desinfección de los suelos no parece ser importante en medicina humana, no sucede lo mismo en medicina veterinaria.103
Figura 4
Medidas recomendadas por la Federación de Asociaciones Veterinarias de Animales de Compañía Europeas (FECAVA) para el mantenimiento de la higiene y el control de las infecciones en la practica veterinaria. (Imagen reproducida con la autorización de la FECAVA).
La identificación de animales con colonización o infección es importante, pero el análisis rutinario a los pacientes antes de su admisión en clínicas veterinarias es probablemente poco práctico. Por lo tanto, es probable que un número bajo de pacientes presenten colonización, pero que ésta no sea detectada. Sin embargo, la identificación de los organismos en casos sospechosos de infección por SARM o SPRM, es prioritario. Se deben realizar cultivos microbiológicos en animales con heridas complicadas, en infecciones que no respondan a los antibióticos o en las infecciones nosocomiales.104 Además, los pacientes hospitalizados deberán ser testados, en el caso de que se haya diagnosticado algún caso de transmisión de SARM o SPRM o si se conociera la existencia de personal veterinario colonizado.3,104
Los animales identificados o sospechosos de ser positivos deben ser admitidos directamente en la consulta, para evitar el contacto con otros pacientes en la sala de espera. Si han de ser admitidos en hospitalización, deben tener medidas especiales de aislamiento,89,105 ya que los animales sanos que han estado en contacto con mascotas infectadas con SPRM tienen incidencias mayores de ser colonizados por la misma.75 La terapia antibiótica deberá estar basada en los antibiogramas e ir acompañada de otras medidas como la retirada de implantes.106
No se ha estudiado específicamente la utilización de agentes descontaminantes ambientales contra el SPRM. La concentración mínima inhibitoria de biocidas utilizados para la eliminación de SPRM en la piel fue una concentración baja, en un estudio que investigó la clorhexidina, la povidona yodada y el triclosan.107 De manera preocupante, un estudio reciente reveló el fracaso de los procedimientos rutinarios de limpieza en un hospital veterinario en la eliminación de SPRM contaminantes, lo que indica que se necesitan estudios de investigación sobre métodos estandarizados para control de contaminación bacteriana y sobre la utilización correcta de biocidas en las instalaciones sanitarias veterinarias.18,86
La vigilancia del personal veterinario es un aspecto controvertido, ya que puede ir contra la confidencialidad y provocar estigmatización. La cooperación entre la profesión médica y veterinaria es fundamental para identificar a las personas portadoras e instaurar medidas de control efectivas en la práctica veterinaria.104
Fuente de financiación: Este trabajo no se ha realizado con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: Los autores declaran que no existe conflicto de intereses en los datos publicados.
Bibliografía
- 1.
Bannoehr J, Guardabassi L. Staphylococcus pseudintermedius in the dog: taxonomy, diagnostics, ecology, epidemiology and pathogenicity. Vet Dermatol 2012;23(4):253–66, e51–2.
[PubMed] - 2.
Noble WC. Staphylococci on the skin. En: Cambridge University Press, editor. The Skin Microflora and Microbial Skin Disease. Cambridge; 1992. p. 135–52.
- 3.
Bond R, Loeffler A. What’s happened to Staphylococcus intermedius? Taxonomic revision and emergence of multi-drug resistance. J Small Anim Pract 2012; 53(3):147–54.
[PubMed] - 4.
Devriese LA, De Pelsmaecker K. The anal region as a main carrier site of Staphylococcus intermedius and Streptococcus canis in dogs. Vet Rec 1987 26;121(13):302–3.
[PubMed] - 5.
Cox HU, Hoskins JD, Newman SS, Foil CS, Turnwald GH, Roy AF. Temporal study of staphylococcal species on healthy dogs. Am J Vet Res 1988;49(6):747–51.
[PubMed] - 6.
Griffeth GC, Morris DO, Abraham JL, Shofer FS, Rankin SC. Screening for skin carriage of methicillin-resistant coagulase-positive staphylococci and Staphylococcus schleiferi in dogs with healthy and inflamed skin. Vet Dermatol 2008;19(3):142–9.
[PubMed] - 7.
Devriese L a, Vancanneyt M, Baele M, Vaneechoutte M, De Graef E, Snauwaert C, et al. Staphylococcus pseudintermedius sp. nov., a coagulase-positive species from animals. Int J Syst Evol Microbiol 2005;55 (4):1569–73.
[PubMed] - 8.
Sasaki T, Kikuchi K, Tanaka Y, Takahashi N, Kamata S, Hiramatsu K. Reclassification of phenotypically identified staphylococcus intermedius strains. J Clin Microbiol 2007;45(9):2770–8.
[PubMed] - 9.
Bannoehr J, Ben Zakour NL, Waller AS, Guardabassi L, Thoday KL, van den Broek AHM, et al. Population genetic structure of the Staphylococcus intermedius group: insights into agr diversification and the emergence of methicillin-resistant strains. J Bacteriol 2007;189(23):8685–92.
[PubMed] - 10.
Ghebremedhin B, Layer F, König W, König B. Genetic classification and distinguishing of Staphylococcus species based on different partial gap, 16S rRNA, hsp60, rpoB, sodA, and tuf gene sequences. J Clin Microbiol 2008;46(3):1019–25.
[PubMed] - 11.
Fitzgerald JR. The Staphylococcus intermedius group of bacterial pathogens: species re-classification, pathogenesis and the emergence of meticillin resistance. Vet Dermatol 2009; 20:490–5.
[PubMed] - 12.
Devriese LA, Hermans K, Baele M, Haesebrouck F. Staphylococcus pseudintermedius versus Staphylococcus intermedius. Vet Microbiol 2009;133: 206–7.
[PubMed] - 13.
Huebner J, Goldmann DA. Coagulase-negative staphylococci: role as pathogens. Annu Rev Med 1999;50:223–36.
[PubMed] - 14.
Kloos WE, Bannerman TL. Update on clinical significance of coagulase-negative staphylococci. Clin Microbiol Rev 1994 ;7(1):117–40.
[PubMed] - 15.
Allaker RP, Lloyd DH, Simpson AI. Occurrence of Staphylococcus intermedius on the hair and skin of normal dogs. Res Vet Sci 1992;52(2):174–6.
[PubMed] - 16.
Allaker RP, Lloyd DH, Bailey RM. Population sizes and frequency of staphylococci at mucocutaneous sites on healthy dogs. Vet Rec 1992; 130(14):303–4.
[PubMed] - 17.
Saijonmaa-Koulumies LE, Lloyd DH. Colonization of neonatal puppies by Staphylococcus intermedius. Vet Dermatol 2002;13(3):123–30.
[PubMed] - 18.
Frank L a, Loeffler A. Meticillin-resistant Staphylococcus pseudintermedius: clinical challenge and treatment options. Vet Dermatol 2012;23(4):283–91, e56.
[PubMed] - 19.
Fazakerley J, Nuttall T, Sales D, Schmidt V, Carter SD, Hart CA, et al. Staphylococcal colonization of mucosal and lesional skin sites in atopic and healthy dogs. Vet Dermatol 2009;20(3):179–84.
[PubMed] - 20.
Hanselman BA, Kruth SA, Rousseau J, Weese JS. Coagulase positive staphylococcal colonization of humans and their household pets. Can Vet J 2009;50(9):954–8.
[PubMed] - 21.
Talan D a, Staatz D, Staatz a, Goldstein EJ, Singer K, Overturf GD. Staphylococcus intermedius in canine gingiva and canine-inflicted human wound infections: laboratory characterization of a newly recognized zoonotic pathogen. J Clin Microbiol 1989;27(1):78–81.
[PubMed] - 22.
Mahoudeau I, Delabranche X, Prevost G, Monteil H, Piemont Y. Frequency of isolation of Staphylococcus intermedius from humans. J Clin Microbiol 1997;35(8):2153–4.
[PubMed] - 23.
Goodacre R. HR. An epidemilogical study of Staphylococcus intermedius strains from dogs, their owner and veterinary surgeons. J Anal Appl Pyrolisis 1997; 44:49–64.
- 24.
Ohara-Nemoto Y, Haraga H, Kimura S, Nemoto TK. Occurrence of staphylococci in the oral cavities of healthy adults and nasal oral trafficking of the bacteria. J Med Microbiol 2008;57(1):95–9.
[PubMed] - 25.
McEwan NA, Mellor D, Kalna G. Adherence by Staphylococcus intermedius to canine corneocytes: a preliminary study comparing noninflamed and inflamed atopic canine skin. Vet Dermatol 2006;17(2):151–4.
[PubMed] - 26.
Mcewan NA. Adherence by Staphylococcus intermedius to canine keratinocytes in atopic dermatitis. Res Vet Sci 2000;68(3):279–83.
[PubMed] - 27.
McEwan NA, Kalna G, Mellor D. A comparison of adherence by four strains of Staphylococcus intermedius and Staphylococcus hominis to canine corneocytes collected from normal dogs and dogs suffering from atopic dermatitis. Res Vet Sci 2005;78(3):193–8.
[PubMed] - 28.
Simou C, Thoday KL, Forsythe PJ, Hill PB. Adherence of Staphylococcus intermedius to corneocytes of healthy and atopic dogs: effect of pyoderma, pruritus score, treatment and gender. Vet Dermatol 2005;16(6):385–91.
[PubMed] - 29.
Hajek V. Staphylococcus intermedius, a new species isolated from animals. Int J Syst Evol Microbiol 1976; 26:401–8.
- 30.
Bannoehr J, Franco A, Iurescia M, Battisti A, Fitzgerald JR. Molecular diagnostic identification of Staphylococcus pseudintermedius. J Clin Microbiol 2009;47(2):469–71.
[PubMed] - 31.
Frank L a, Kania S a, Kirzeder EM, Eberlein LC, Bemis D a. Risk of colonization or gene transfer to owners of dogs with meticillin-resistant Staphylococcus pseudintermedius. Vet Dermatol 2009; 20:496–501.
[PubMed] - 32.
Gold RM, Adam P. Reference Point Understanding meticillin resistance with pyoderma. JAVMA 2013, 74:817-24.
- 33.
Walsh C. Molecular mechanisms that confer antibacterial drug resistance. Nature. 2000; 406(6797):775–81.
- 34.
Hiramatsu K, Cui L, Kuroda M, Ito T. The emergence and evolution of methicillin-resistant Staphylococcus aureus. Trends Microbiol 2001;9(10):486–93.
[PubMed] - 35.
Papich MG. Antibiotic treatment of resistant infections in small animals. Vet Clin North Am Small Anim Pract; 2013;43(5):1091–107.
[PubMed] - 36.
Papich MG. Selection of antibiotics for meticillin-resistant Staphylococcus pseudintermedius: time to revisit some old drugs? Vet Dermatol 2012;23(4):352–60, e64.
[PubMed] - 37.
Allen J, Abraham L, Thompson K, Browning G. Methicillin-resistant Staphylococcus aureus: an issue for veterinary hospitals. Aust Vet J 2013; 91(6):215–9.
[PubMed] - 38.
Cain CL. Antimicrobial resistance in staphylococci in small animals. Vet Clin North Am Small Anim Pract; 2013;43(1):19–40.
[PubMed] - 39.
Chambers HF. Methicillin resistance in staphylococci: molecular and biochemical basis and clinical implications. Clin Microbiol Rev 1997;10(4):781–91.
[PubMed] - 40.
Cain CL, Morris DO, Rankin SC. Clinical characterization of Staphylococcus schleiferi infections and identification of risk factors for acquisition of oxacillin-resistant strains in dogs: 225 cases (2003-2009). J Am Vet Med Assoc 2011; 239(12):1566–73.
- 41.
Loeffler A, Linek M, Moodley A, Guardabassi L, Sung JML, Winkler M, et al. First report of multiresistant, mecA-positive Staphylococcus intermedius in Europe: 12 cases from a veterinary dermatology referral clinic in Germany. Vet Dermatol 2007;18(6):412–21.
[PubMed] - 42.
Wu S, Piscitelli C, de Lencastre H, Tomasz A. Tracking the evolutionary origin of the methicillin resistance gene: cloning and sequencing of a homologue of mecA from a methicillin susceptible strain of Staphylococcus sciuri. Microb Drug Resist 1996;2(4):435–41.
[PubMed] - 43.
Black CC, Solyman SM, Eberlein LC, Bemis DA, Woron AM, Kania SA. Identification of a predominant multilocus sequence type, pulsed-field gel electrophoresis cluster, and novel staphylococcal chromosomal cassette in clinical isolates of mecA-containing, methicillin-resistant Staphylococcus pseudintermedius. Vet Microbiol 2009; 139(3-4):333–8.
[PubMed] - 44.
Gortel K, Campbell KL, Kakoma I, Whittem T, Schaeffer DJ, Weisiger RM. Methicillin resistance among staphylococci isolated from dogs. Am J Vet Res 1999;60(12):1526–30.
[PubMed] - 45.
Coombs GW, Nimmo GR, Bell JM, Huygens F, O’Brien FG, Malkowski MJ, et al. Genetic diversity among community methicillin-resistant Staphylococcus aureus strains causing outpatient infections in Australia. J Clin Microbiol 2004;42(10):4735–43.
[PubMed] - 46.
Bemis DA, Jones RD, Frank LA, Kania SA. Evaluation of susceptibility test breakpoints used to predict mecA-mediated resistance in Staphylococcus pseudintermedius isolated from dogs. J Vet Diagn Invest 2009;21(1):53–8.
[PubMed] - 47.
Lloyd DH, Lamport AI, Feeney C. Sensitivity to antibiotics amongst cutaneous and mucosal isolates of canine pathogenic staphylococci in the UK. Vet Dermatol 1996;7(3):171–5.
- 48.
Pellerin JL, Bourdeau P, Sebbag H, Person JM. Epidemiosurveillance of antimicrobial compound resistance of Staphylococcus intermedium clinical isolates from canine pyodermas. Comp Immunol Microbiol Infect Dis 1998;21(2):115–33.
[PubMed] - 49.
Guardabassi L, Schwarz S, Lloyd DH. Pet animals as reservoirs of antimicrobial-resistant bacteria. J Antimicrob Chemother 2004;54(2):321–32.
[PubMed] - 50.
Rantala M, Lahti E, Kuhalampil J, Pesonen S, Järvinen a K, Saijonmaa-Koulumies, et al. Antimicrobial resistance in Staphylococcus spp., Escherichia coli and Enterococcus spp. in dogs given antibiotics for chronic dermatological disorders, compared with non-treated control dogs. Acta Vet Scand 2004; 45:37–45.
[PubMed] - 51.
Kadlec K, Schwarz S, Perreten V, Andersson UG, Finn M, Greko C, et al. Clonal spread of methicillin-resistant Staphylococcus pseudintermedius in Europe and North America: an international multicentre study. J Antimicrob Chemother 2010; 65(6):1145–54.
[PubMed] - 52.
Ruscher C, Lübke-Becker A, Wleklinski C-G, Soba A, Wieler LH, Walther B. Prevalence of Methicillin-resistant Staphylococcus pseudintermedius isolated from clinical samples of companion animals and equidaes. Vet Microbiol 2009; 14; 136:197–201.
[PubMed] - 53.
Schwarz S, Kadlec K, Strommenger B. Methicillin-resistant Staphylococcus aureus and Staphylococcus pseudintermedius detected in the BfT-GermVet monitoring programme 2004-2006 in Germany. J Antimicrob Chemother 2008;61(2):282–5.
[PubMed] - 54.
De Lucia M, Moodley a, Latronico F, Giordano A, Caldin M, Fondati a, et al. Prevalence of canine methicillin resistant Staphylococcus pseudintermedius in a veterinary diagnostic laboratory in Italy. Res Vet Sci 2011;91(3):346–8. v
[PubMed] - 55.
Gómez-Sanz E, Torres C, Lozano C, Sáenz Y, Zarazaga M. Detection and characterization of methicillin-resistant Staphylococcus pseudintermedius in healthy dogs in La Rioja, Spain. Comp Immunol Microbiol Infect Dis 2011; 34(5):447–53.
[PubMed] - 56.
Murphy C, Reid-Smith RJ, Prescott JF, Bonnett BN, Poppe C, Boerlin P, et al. Occurrence of antimicrobial resistant bacteria in healthy dogs and cats presented to private veterinary hospitals in southern Ontario: A preliminary study. Can Vet J 2009;50(10):1047–53.
[PubMed] - 57.
Schmidt VM, Williams NJ, Pinchbeck G, Corless CE, Shaw S, McEwan N, et al. Antimicrobial resistance and characterisation of staphylococci isolated from healthy Labrador retrievers in the United Kingdom. BMC Vet Res 2014;10:17.
[PubMed] - 58.
Vengust M, Anderson MEC, Rousseau J, Weese JS. Methicillin-resistant staphylococcal colonization in clinically normal dogs and horses in the community. Lett Appl Microbiol 2006;43(6):602–6.
[PubMed] - 59.
Wedley AL, Dawson S, Maddox TW, Coyne KP, Pinchbeck GL, Clegg P, et al. Carriage of Staphylococcus species in the veterinary visiting dog population in mainland UK: molecular characterisation of resistance and virulence. Vet Microbiol 2014; 170(1-2):81–8.
[PubMed] - 60.
Hanselman BA, Kruth S, Weese JS. Methicillin-resistant staphylococcal colonization in dogs entering a veterinary teaching hospital. Vet Microbiol 2008; 126(1-3):277–81.
[PubMed] - 61.
Gingrich EN, Kurt T, Hyatt DR, Lappin MR, Ruch-Gallie R. Prevalence of methicillin-resistant staphylococci in northern Colorado shelter animals. J Vet Diagn Invest 2011;23(5):947–50.
[PubMed] - 62.
Beck KM, Waisglass SE, Dick HLN, Weese JS. Prevalence of meticillin-resistant Staphylococcus pseudintermedius (MRSP) from skin and carriage sites of dogs after treatment of their meticillin-resistant or meticillin-sensitive staphylococcal pyoderma. Vet Dermatol 2012;23(4):369–75, e66–7.
[PubMed] - 63.
Davis JA, Jackson CR, Fedorka-Cray PJ, Barrett JB, Brousse JH, Gustafson J, et al. Carriage of methicillin-resistant staphylococci by healthy companion animals in the US. Lett Appl Microbiol. 2014 Apr 15;59(1):1–8.
[PubMed] - 64.
Rubin JE, Chirino-Trejo M. Prevalence, sites of colonization, and antimicrobial resistance among Staphylococcus pseudintermedius isolated from healthy dogs in Saskatoon, Canada. J Vet Diagn Invest 2011;23(2):351–4.
[PubMed] - 65.
Sasaki T, Kikuchi K, Tanaka Y, Takahashi N, Kamata S, Hiramatsu K. Methicillin-resistant Staphylococcus pseudintermedius in a veterinary teaching hospital. J Clin Microbiol 2007;45(4):1118–25.
[PubMed] - 66.
Kawakami T, Shibata S, Murayama N, Nagata M, Nishifuji K, Iwasaki T, et al. Antimicrobial susceptibility and methicillin resistance in Staphylococcus pseudintermedius and Staphylococcus schleiferi subsp. coagulans isolated from dogs with pyoderma in Japan. J Vet Med Sci 2010;72(12):1615–9.
[PubMed] - 67.
Nienhoff U, Kadlec K, Chaberny IF, Verspohl J, Gerlach G-F, Kreienbrock L, et al. Methicillin-resistant Staphylococcus pseudintermedius among dogs admitted to a small animal hospital. Vet Microbiol 2011; 150(1-2):191–7.
[PubMed] - 68.
Morris DO, Rook K a, Shofer FS, Rankin SC. Screening of Staphylococcus aureus, Staphylococcus intermedius, and Staphylococcus schleiferi isolates obtained from small companion animals for antimicrobial resistance: a retrospective review of 749 isolates (2003-04). Vet Dermatol 2006;17(5):332–7.
[PubMed] - 69.
Ruscher C, Lübke-Becker A, Semmler T, Wleklinski C-G, Paasch A, Soba A, et al. Widespread rapid emergence of a distinct methicillin- and multidrug-resistant Staphylococcus pseudintermedius (MRSP) genetic lineage in Europe. Vet Microbiol 2010 26;144(3-4):340–6.
[PubMed] - 70.
Hamilton E, Kruger JM, Schall W, Beal M, Manning SD, D P, et al. Acquisition and persistence of antimicrobial resistent bacteria isolated from dogs and cats admitted to a veterinary teaching hospitaladmitted to a veterinary teaching hospital. J Am Vet Med Asoc 2013;243(7):7–9.
[PubMed] - 71.
Eckholm NG, Outerbridge C a, White SD, Sykes JE. Prevalence of and risk factors for isolation of meticillin-resistant Staphylococcus spp. from dogs with pyoderma in northern California, USA. Vet Dermatol 2013;24(1):154–61.e34.
[PubMed] - 72.
Bergström A, Gustafsson C, Leander M, Fredriksson M, Grönlund U, Trowald-Wigh G. Occurrence of methicillin-resistant Staphylococci in surgically treated dogs and the environment in a Swedish animal hospital. J Small Anim Pract 2012;53(7):404–10.
[PubMed] - 73.
Lehner G, Linek M, Bond R, Lloyd DH, Prenger-Berninghoff E, Thom N, et al. Case-control risk factor study of methicillin-resistant Staphylococcus pseudintermedius (MRSP) infection in dogs and cats in Germany. Vet Microbiol 2014; 168(1):154–60.
[PubMed] - 74.
Morris DO, Boston RC, O’Shea K, Rankin SC. The prevalence of carriage of meticillin-resistant staphylococci by veterinary dermatology practice staff and their respective pets. Vet Dermatol 2010; 21(4):400–7.
[PubMed] - 75.
Van Duijkeren E, Kamphuis M, van der Mije IC, Laarhoven LM, Duim B, Wagenaar J a, et al. Transmission of methicillin-resistant Staphylococcus pseudintermedius between infected dogs and cats and contact pets, humans and the environment in households and veterinary clinics. Vet Microbiol 2011; 150:338–43.
[PubMed] - 76.
Ishihara K, Shimokubo N, Sakagami A, Ueno H, Muramatsu Y, Kadosawa T, et al. Occurrence and molecular characteristics of methicillin-resistant Staphylococcus aureus and methicillin-resistant Staphylococcus pseudintermedius in an academic veterinary hospital. Appl Environ Microbiol 2010;76(15):5165–74.
[PubMed] - 77.
Van Duijkeren E, Houwers DJ, Schoormans A, Broekhuizen-Stins MJ, Ikawaty R, Fluit AC, et al. Transmission of methicillin-resistant Staphylococcus intermedius between humans and animals. Vet Microbiol 2008 1;128(1-2):213–5.
[PubMed] - 78.
Morrison-Rodriguez SM, Pacha L a, Patrick JE, Jordan NN. Community-associated methicillin-resistant Staphylococcus aureus infections at an Army training installation. Epidemiol Infect 2010;138(5):721–9.
[PubMed] - 79.
Laarhoven LM, de Heus P, van Luijn J, Duim B, Wagenaar JA, van Duijkeren E. Longitudinal study on methicillin-resistant Staphylococcus pseudintermedius in households. PLoS One. 2011;6(11):e27788.
[PubMed] - 80.
Guardabassi L, Loeber M., Jacobson a. Transmission of multiple antimicrobial-resistant Staphylococcus intermedius between dogs affected by deep pyoderma and their owners. Vet Microbiol 2004;98(1):23–7.
[PubMed] - 81.
Stegmann R, Burnens A, Maranta CA, Perreten V. Human infection associated with methicillin-resistant Staphylococcus pseudintermedius ST71. J Antimicrob Chemother 2010;65(9):2047–8.
[PubMed] - 82.
Hamilton E, Kaneene JB, May KJ, Kruger JM, Schall W, Beal MW, et al. Prevalence and antimicrobial resistance of Enterococcus spp and Staphylococcus spp isolated from surfaces in a veterinary teaching hospital. J Am Vet Med Asoc 2012; 240(12):1463–73.
[PubMed] - 83.
Singh A, Walker M, Rousseau J, Monteith GJ, Weese JS. Methicillin-resistant staphylococcal contamination of clothing worn by personnel in a veterinary teaching hospital. Vet Surg 2013;42(6):643–8.
[PubMed] - 84.
Aksoy E, Boag a, Brodbelt D, Grierson J. Evaluation of surface contamination with staphylococci in a veterinary hospital using a quantitative microbiological method. J Small Anim Pract 2010;51(11):574–80.
[PubMed] - 85.
Loeffler A, Boag AK, Sung J, Lindsay JA, Guardabassi L, Dalsgaard A, et al. Prevalence of methicillin-resistant Staphylococcus aureus among staff and pets in a small animal referral hospital in the UK. J Antimicrob Chemother 2005;56(4):692–7.
[PubMed] - 86.
Murphy CP, Reid-Smith RJ, Boerlin P, Weese JS, Prescott JF, Janecko N, et al. Escherichia coli and selected veterinary and zoonotic pathogens isolated from environmental sites in companion animal veterinary hospitals in southern Ontario. Can Vet J 2010;51(9):963–72.
[PubMed] - 87.
Griffith CJ, Obee P, Cooper RA, Burton NF, Lewis M. The effectiveness of existing and modified cleaning regimens in a Welsh hospital. J Hosp Infect 2007;66(4):352–9.
[PubMed] - 88.
Weese JS, Dacosta T, Button L, Goth K, Ethier M, Boehnke K. Isolation of Methicillin-Resistant Staphylococcus aureus from the Enviroment in a Veterinary Teaching Hospital. J Vet Intern Med 2004; 8: 468–70.
[PubMed] - 89.
Weese JS, Faires MC, Frank LA, Reynolds LM, Battisti A, Weese S. Factors associated with methicillin-resistant versus methicillin-susceptible Staphylococcus pseudintermedius infection in dogs. J Am Vet Med Assoc 2012; 240(12):1450–5.
[PubMed] - 90.
Van Duijkeren E, Catry B, Greko C, Moreno MA, Pomba MC, Pyörälä S, et al. Review on methicillin-resistant Staphylococcus pseudintermedius. J Antimicrob Chemother 2011;66(12):2705–14.
[PubMed] - 91.
Descloux S, Rossano A, Perreten V. Characterization of new staphylococcal cassette chromosome mec (SCCmec) and topoisomerase genes in fluoroquinolone- and methicillin-resistant Staphylococcus pseudintermedius. J Clin Microbiol 2008;46(5):1818–23.
[PubMed] - 92.
World, Health, Organization. Report of the 1 st Meeting of the Who Advisory Group on Surveillamce of Antimicrobial Resistance (AGISAR. AGISAR 1. Copenhagen; 2009.
- 93.
Young R, Buckley L, McEwan N, Nuttall T. Comparative in vitro efficacy of antimicrobial shampoos: a pilot study. Vet Dermatol 2012;23(1):36–40, e8.
[PubMed] - 94.
Murayama N, Terada Y, Okuaki M, Nagata M. Dose assessment of 2% chlorhexidine acetate for canine superficial pyoderma. Vet Dermatol 2011;22(5):449–53.
[PubMed] - 95.
Werner AH, Russell AD. Mupirocin, fusidic acid and bacitracin: activity, action and clinical uses of three topical antibiotics. Vet Dermatol 1999;10(3):225–40.
- 96.
Frank L, Kirzeder EM, Davis J. Nisin impregnated wipes for the treatment of canine pyoderma and surface bacterial colonization. Vet Dermatol 2009;20:219.
- 97.
Kadlec K, van Duijkeren E, Wagenaar JA, Schwarz S. Molecular basis of rifampicin resistance in methicillin-resistant Staphylococcus pseudintermedius isolates from dogs. J Antimicrob Chemother 2011; 66(6):1236–42.
[PubMed] - 98.
Saijonmaa-Koulumies L, Parsons E, Lloyd DH. Elimination of Staphylococcus intermedius in healthy dogs by topical treatment with fusidic acid. J Small Anim Pract 1998; 39(7):341–7.
[PubMed] - 99.
Hillier A, Pinchbeck LR, Bannerman T, Cole LK, York S. Coagulase-positive staphylococci at carriage site post-cefpodoxime therapy in dogs. Vet Dermatol 2007;18:182.
- 100.
Weese JS, Dick H, Willey BM, McGeer a, Kreiswirth BN, Innis B, et al. Suspected transmission of methicillin-resistant Staphylococcus aureus between domestic pets and humans in veterinary clinics and in the household. Vet Microbiol 2006; 115:148–55.
[PubMed] - 101.
Lloyd DH. Recognising and controlling risk factors for antimicrobial resistance. Shweizer Arch für Tierheilkd 2010;152:131–4.
[PubMed] - 102.
Loeffler a, Lloyd DH. Companion animals: a reservoir for methicillin-resistant Staphylococcus aureus in the community? Epidemiol Infect 2010;138(5):595–605.
[PubMed] - 103.
Leonard FC, Markey BK. Meticillin-resistant Staphylococcus aureus in animals: a review. Vet J 2008;175(1):27–36.
[PubMed] - 104.
Weese JS. Staphylococcal control in the veterinary hospital. Vet Dermatol 2012;23(4):292–8, e57–8.
[PubMed] - 105.
Nutall T. Methicillin resistant Spaphylococcus aureus (MRSA): control in veterinary practice. Program and Book of abstract 1 st International Conference of MRSA in Animals, University of Liverpool, UK 2006. p. 13–6.
- 106.
Leonard FC, Abbott Y, Rossney A, Quinn PJ, Mahony RO, Markey BK. Methicillin-resistant Staphylococcus aureus isolated from a veterinary surgeon and five dogs in one practice. Vet Rec. 2006;1(158):155–9.
[PubMed] - 107.
Baines B, Loeffler A, Milson S. Susceptibility of methicillin-resistant and methicillin-susceotible Staphylococcus aureus ans Staphylococcus intermedius isolated from dogs and cats to three antiseptic. Scientific Proceeding 2008, 51st British Small animal Veterinary Association Congress 2008. p. 452.