Síndrome de dilatación-vólvulo gástrico (DVG)
Gastric dilatation-volvulus syndrome (GDV)
J. D. Carrillo, M. Escobar, M. Martínez, J. I. Gil-Chinchilla, P. García-Fernández, M. Jiménez-Peláez
Contacto: juanacs@um.es
Resumen
La dilatación vólvulo gástrico (DVG) es un síndrome frecuente en perros de razas grandes y gigantes, cuya etiología es multifactorial. Se caracteriza por presentarse con un acumulo anormal de gas y contenido en el interior del estómago, una gran distensión y rotación gástrica, resultando en un estado de shock y disfunción multiorgánica en el paciente que puede resultar mortal. Para su resolución es necesaria una terapia médica y quirúrgica, así como una intensiva monitorización tras la cirugía. El objetivo de este artículo es presentar una revisión actualizada de su etiología y manejo.
Palabras clave: Dilatación vólvulo gástrico, gastropexia, perro..
Summary
The gastric dilatation volvulus (GDV) is a common syndrome in large and giant breed dogs whose etiology is multifactorial. It is characterized by an abnormal accumulation of gas and liquid into the stomach, gastric distension and rotation, resulting in a state of shock and multiple organ dysfunction in the patient, which can be fatal. Medical and surgical therapies and intensive monitoring after surgery are necessary for the resolution of this pathology. The aim of this paper is to present an updated review of the etiology and management of this disease.
Keywords: Gastric dilatation-volvulus, gastropexy, dog..

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
El síndrome de DVG es un proceso médico-quirúrgico en el que se produce una distensión y mal-posicionamiento del estómago, dando lugar a efectos fisiopatológicos que ponen en peligro la vida del paciente.1,2 Se describe con mayor frecuencia en razas caninas grandes y gigantes con tórax profundo.1,2 Puede presentarse de forma aguda o crónica, con una sintomatología inespecífica en la que se observan vómitos improductivos y arcadas. En el caso del proceso crónico, su diagnóstico es más complicado dado que la sintomatología es menos llamativa.1,3
El presente trabajo tiene como objetivo presentar una revisión actualizada del síndrome de DVG, incluyendo los últimos conocimientos sobre su etiología, fisiopatología, pruebas diagnósticas y posibilidades de tratamiento (médico y quirúrgico), así como su manejo postquirúrgico.
Etiología
En la bibliografía veterinaria, la DVG aguda ha sido descrita en múltiples ocasiones. Su etiología es poco conocida, aunque se describen diferentes factores de riesgo, no habiéndose demostrado la implicación real de algunos de ellos, como la disminución de la motilidad del estómago,1,4 el incremento de los niveles de gastrina y el retraso en el vaciado gástrico.1
Los factores de riesgo más conocidos son los relacionados con el formato, la complexión física y la edad del animal, teniendo mayor incidencia en pacientes con tórax profundo, sobrepeso y edad media5 o avanzada.1,6 Otros factores que pueden predisponer al desarrollo de la DVG son: el tipo de dieta (asociándose a la ingestión de piensos con una alta concentración en grasas y aceites);7 la toma de grandes volúmenes de comida;8 la administración de una sola toma de pienso al día;8,2 el comportamiento de ansiedad frente al alimento;1,2,6 laxitud del ligamento hepatogástrico;2 historia de DVG en alguno de los progenitores;2 el ejercicio postprandial y el estrés.1,2,6
Por otra parte, se ha descrito que animales con carácter feliz pueden ser menos propensos a padecer DVG.1,2 En la presentación de esta patología puede darse una influencia medioambiental por incremento de la presión atmosférica9,10 y estacional,10,11 a pesar de que en algunos estudios no se hayan observado asociaciones significativas entre la incidencia de DVG y la presión atmosférica, la humedad del ambiente y el mes del año.12
Otro factor que en ocasiones ha sido asociado a su presentación es la existencia de una esplenectomía previa,13 aunque existe controversia entre los autores, no encontrándose asociación alguna en ciertos trabajos.14,15 Sin embargo, en un reciente estudio de Sator y colaboradores (2013) se recomienda realizar siempre una gastropexia profiláctica a pacientes con alto riesgo de padecer DVG, que sean sometidos a esplenectomía, con el objetivo de evitar el vólvulo gástrico.16 Otros trabajos han asociado la DVG a la presencia de hernia de hiato17 y de cuerpos extraños en el estómago.18
Fisiopatología
Se han realizado estudios para confirmar qué se produce primero durante el desarrollo de la DVG: si la distensión abdominal o la rotación gástrica. Sin embargo, aún no está claro si el proceso es debido a la dilatación, y posteriormente el estómago rota; o por el contrario, si primero rota y debido a ello se dilata, dado que ambos procesos pueden ocurrir por separado. No obstante, se ha descrito que la distensión gaseosa que se produce no es debida únicamente a la aerofagia, sino que se origina también en el interior del estómago.6,19
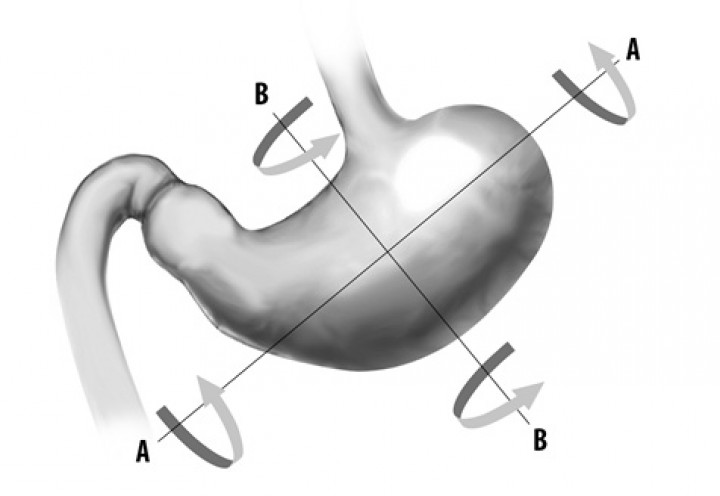
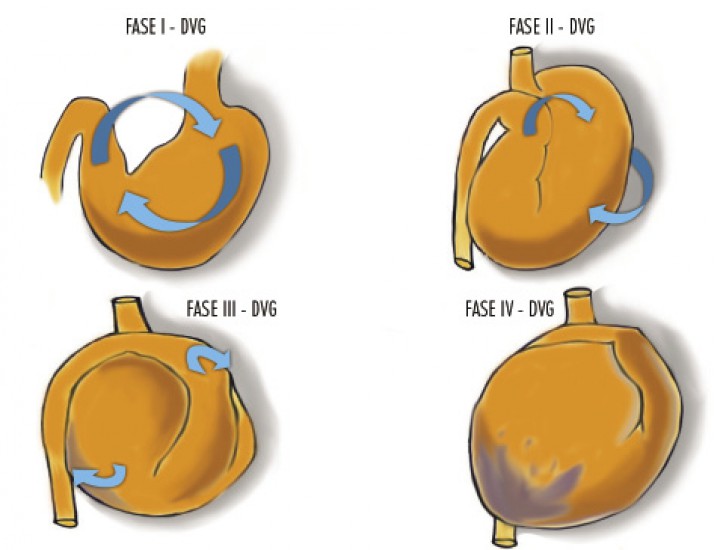
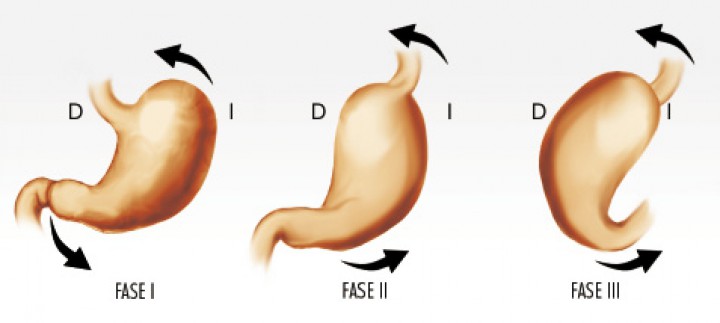
El vólvulo gástrico se origina por una rotación anormal del estómago alrededor de alguno de sus ejes (Fig. 1).20 En la especie canina, la rotación más comúnmente presentada es sobre el eje transversal del estómago, produciéndose un desplazamiento del píloro y duodeno proximal primero hacia ventral y, a continuación, cranealmente (Figs. 2 A y B), cambiando la posición del píloro de ventral y en el lado derecho, hacia una localización dorsal y en el lado izquierdo del animal (Figs. 2 C y D), provocando el plegamiento del estómago.1,2,21 Esta rotación, generalmente, es de 220º a 270º, aunque puede llegar a ser de 360º.22Por otra parte, en el hombre la rotación del estómago observada con mayor frecuencia es sobre su eje longitudinal, que ha sido descrita en medicina veterinaria en un Shar-pei,23 en la cual el píloro se desplaza caudo-dorsalmente y manteniéndose en el lado izquierdo, al mismo tiempo que el fundus gástrico se dirige cráneo-ventralmente y hacia el lado derecho (Fig. 3).
Figura 1
Representación esquemática de los tipos de vólvulo gástrico: (A-A) sobre el eje longitudinal y (B-B) en el eje transversal.
Figura 2
Esquema de la rotación del estómago sobre su eje transversal, observándose un desplazamiento del píloro y duodeno proximal hacía ventral y craneal (Fase I y II) y produciéndose un cambio de posición del píloro a una localización dorsal y hacia el lado izquierdo del animal (Fase III y IV).
Figura 3
Esquema de la rotación del estómago sobre su eje longitudinal, visualizándose como el píloro se desplaza hacia caudal y dorsal, manteniéndose en el lado izquierdo (Fase I y II) y el fundus gástrico se dirige craneal y ventralmente, situándose en el lado derecho del paciente (Fase III).
El mal-posicionamiento del estómago en el síndrome de DVG es lo que va a provocar la oclusión del píloro y el cardias, que asociado a la fermentación producida por las bacterias, va a dar lugar a la distensión gástrica. En los casos de dilatación del estómago sin torsión, a diferencia de lo que ocurre en la DVG, es el exceso de presión ejercida por el gas acumulado sobre la zona caudal del esófago lo que va a impedir la apertura del cardias y la imposibilidad de realizar el eructo.
El síndrome de DVG da lugar a severas complicaciones a nivel de los sistemas cardiovascular, respiratorio, renal y gastrointestinal que pueden tener consecuencias fatales para el animal1,2 si no se actúa con premura.
Alteraciones del sistema cardiovascular
Debido al aumento en la presión de la cavidad abdominal (como consecuencia de la gran distensión gástrica), se produce una compresión de las venas porta y cava caudal, reduciéndose el retorno venoso al corazón, el gasto cardiaco y la presión arterial.1,2
La compresión de la vena porta da lugar a edema y congestión del sistema gastrointestinal y a una disminución del volumen vascular. Este aumento en la presión portal también produce un compromiso sobre la microcirculación visceral y una reducción del aporte de oxígeno en el tracto gastrointestinal. Por ello, el páncreas, como consecuencia de este estado de hipoxia, libera factores depresores del miocardio que, junto con el estado de isquemia y la producción de radicales libres de oxígeno, va a provocar una isquemia miocárdica, reducción de la contractibilidad cardiaca y aparición de arritmias, comprometiéndose de esta forma la función cardiaca.1,2
Por otra parte, para compensar el estado hipovolémico, las glándulas adrenales van a liberar catecolaminas que dan lugar a una intensa vasoconstricción y, de esta manera, el mayor flujo de sangre se dirige hacia los órganos esenciales (cerebro y riñones), en detrimento del resto de vísceras. La liberación de catecolaminas va a inducir también un aumento de la frecuencia cardíaca que, junto con la intensa vasoconstricción, hace que haya una mayor demanda de oxígeno por parte del miocardio y, dado que su llegada se encuentra disminuida debido a la hipovolemia, se produce una reducción del gasto cardiaco y de la perfusión coronaria. Todo ello conlleva a la aparición de una isquemia subendocárdica, áreas de necrosis y arritmias.1,2
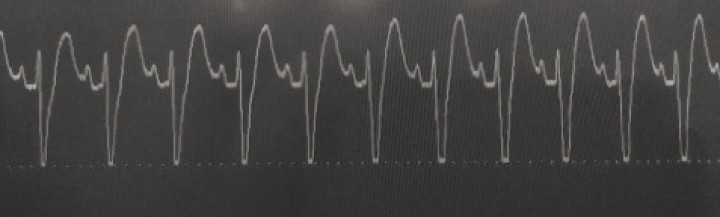
Las arritmias cardíacas, fundamentalmente son ventriculares, y se evidencian en aproximadamente el 40% de los perros con este síndrome. En concreto, la taquicardia ventricular es la arritmia que se presenta con mayor frecuencia (Fig. 4), aunque la fibrilación atrial y la taquicardia supraventricular también han sido descritas en estos pacientes.1,2
Figura 4
Imagen de un electrocardiograma en un paciente con DVG en el que se observa taquicardia ventricular caracterizada por una ausencia de ondas P (o, si se ven, no siempre preceden inmediatamente a un QRS) y anchos complejos QRS.
Alteraciones del sistema respiratorio
El compromiso respiratorio es común en estos perros, siendo un proceso multifactorial que provoca esfuerzos compensatorios generalmente ineficaces que van a culminar con hipercapnia e hipoxemia. La gran distensión abdominal compromete una correcta ventilación, produciéndose un aumento en la presión parcial de CO2, dado que los pulmones no pueden distenderse adecuadamente, por lo que pueden aparecer atelectasias en alguno de los lóbulos pulmonares, contribuyendo a la disminución de la saturación arterial de oxígeno.1,2Este compromiso en la respiración puede verse agravado si el paciente presenta neumonía por aspiración, secundaria a los continuos esfuerzos por vomitar.
Alteraciones del sistema gastrointestinal
La hipoxia, el aumento de la presión intramural gástrica, la compresión y el colapso por presión de los capilares del estómago, así como la trombosis, van a generar una isquemia y necrosis gástrica que va a favorecer la translocación bacteriana, por alteración de su permeabilidad, y consiguiente endotoxemia. Todo ello contribuye al desarrollo de un estado de shock séptico que produce un daño sobre las membranas celulares, activación de la cascada de la coagulación, activación de las plaquetas y aumento de la permeabilidad vascular, siendo los riñones y el hígado los órganos más dañados.1,2
La región más frecuentemente afectada es el fundus, progresando la necrosis desde esta zona hacia el cuerpo del estómago. La oclusión de las arterias y venas gástricas va a originar la manifestación de edema y hemorragias en su pared y, en última instancia, puede resultar en una perforación gástrica y desarrollo de peritonitis.
El riesgo de presentación de estas alteraciones va a depender del grado de dilatación y rotación del estómago, así como del mantenimiento en el tiempo del mismo.
Dada la relación del estómago con el bazo, es frecuente la aparición simultánea de la torsión de ambos órganos, dando lugar a un compromiso vascular esplénico e incluso ruptura de los vasos gástricos cortos, produciéndose hemoabdomen y haciendo necesaria la realización de una esplenectomía.1
Alteraciones del sistema renal
El daño renal se ve favorecido por la reducción de la perfusión periférica, produciéndose una disminución en la tasa de filtración glomerular que se manifiesta inicialmente con una oliguria pre-renal y finalmente con anuria.1,2
Alteraciones metabólicas
Se observan alteraciones mixtas del equilibrio ácido-base, como son el incremento del lactato (debido al aumento del metabolismo anaeróbico), la liberación de endotoxinas, acidosis metabólica, alcalosis metabólica hipoclorémica y/o acidosis respiratoria. Debido a la aparición de desórdenes opuestos, el pH puede ser normal. También se observan alteraciones electrolíticas como hipokalemia (por diferentes mecanismos), daños renales y hepáticos por hipoperfusión, así como la instauración de una coagulación intravascular diseminada.1,2
Diagnóstico
El diagnóstico se consigue normalmente en base a la historia clínica, sintomatología y examen físico. El paciente suele presentarse con vómitos improductivos, arcadas, hipersalivación y una gran distensión abdominal. En otras ocasiones, se presenta postrado y en un estado mental de obnubilación.1,24
La DVG se observa con mayor frecuencia en perros de razas grandes o gigantes, aunque se ha descrito en razas pequeñas y en el gato. La edad de presentación más común es en animales adultos5 o geriátricos,1,6 aunque puede manifestarse desde los 10 meses hasta los 14 años edad,25 sin que existan diferencias en función del sexo.1
En el examen físico, el hallazgo más frecuente es la distensión de la cavidad abdominal, que puede ser dolorosa,24 así como una esplenomegalia por estasis venoso. En ocasiones puede aparecer como un proceso crónico con dilatación gástrica intermitente y vólvulo parcial, manifestándose por una pérdida crónica de peso, malestar abdominal intermitente, distensión, náuseas y vómitos no productivos.3
El paciente puede presentar diferente grado de shock hipovolémico, observándose taquicardia y taquipnea, tiempo de relleno capilar disminuido, mucosas pálidas y extremidades frías. Conforme avanza el proceso, el pulso femoral es más débil, las mucosas aparecen congestivas y se evidencia hipertermia. En los casos más graves o en pacientes descompensados, se manifiesta una severa hipotensión, bradicardia, hipotermia, mucosas blancas y extremidades frías.24
El pronóstico suele estar relacionado con el estado del paciente en el momento de la consulta; así, animales que acuden andando y en alerta, con frecuencia tienen mejor pronóstico que aquellos que se presentan postrados.24
Pruebas diagnósticas
Los hallazgos de laboratorio en estos pacientes son inespecíficos y variables, en función de la severidad del proceso:
- El hemograma puede revelar un leucograma de estrés, trombocitopenia y hemoconcentración.1
- En la bioquímica se suele observar hipokalemia, azotemia, aumento de alanintransaminasa (ALT) y bilirrubina total debido al daño hepatocelular secundario a la hipoxia y al estasis biliar. El incremento de los valores de urea y creatinina, suelen ser consecuencia de la hipotensión.2
- La gasometría suele indicar un aumento o disminución del pH.1
- Las alteraciones en los tiempos de coagulación más frecuentemente encontradas son: el aumento o la disminución de protrombina (PT), tiempo parcial de tromboplastina (PTT) y tiempo de activación del complemento.1
Se han descrito diferentes marcadores de necrosis gástrica, medibles previamente a la cirugía, como son los productos de la degradación de la fibrina, la antitrombina III, el tiempo parcial de tromboplastina y la concentración de lactato.1 De todos ellos, la concentración de lactato se ha mostrado como el más representativo, siendo muy útil para valorar la perfusión de la pared del estómago, decidir las medidas a tomar en la resucitación y las posibilidades de supervivencia.1,2 En pacientes con DVG que presentan una concentración de lactato menor de 6 mmol/L, el porcentaje de supervivencia es de un 99%; cuando la concentración es mayor de 6 mmol/L es indicativo de la existencia de necrosis gástrica, describiéndose que si dicha concentración se encuentra entre 6-9 mmol/L el porcentaje de supervivencia del paciente es del 90%; y a concentraciones mayores de 9 mmol/L, este porcentaje disminuye al 54%, según recientes estudios.26
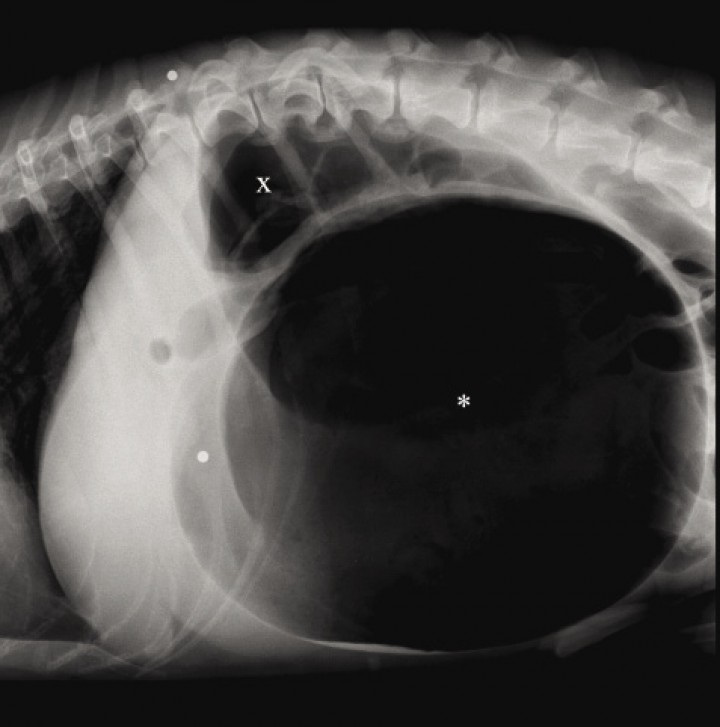
La radiografía es de utilidad para confirmar y diferenciar la dilatación gástrica de la DVG. Antes de realizar el examen radiográfico se debe descomprimir el abdomen por medio de un trocar o una sonda orogástrica.1,2 La radiografía debe realizarse en decúbito lateral derecho. Cuando el vólvulo se produce por la rotación sobre el eje transversal del estómago, se observa una imagen de bicompartimentación debido a la acumulación de aire en el píloro y el fundus (Fig. 5).1,2 Cuando la DVG es debida al giro sobre el eje longitudinal, se puede visualizar el estómago desplazado caudalmente y el fundus localizado en el lado derecho (Fig. 6).23
Figura 5
Radiografía lateral derecha de la cavidad abdominal craneal en un perro con DVG donde puede visualizarse una gran distensión gástrica y el signo de bicompartimentación, indicativo de vólvulo gástrico sobre el eje transversal, observándose el antro pilórico dorsalmente (x) y el fundus ventral (*).
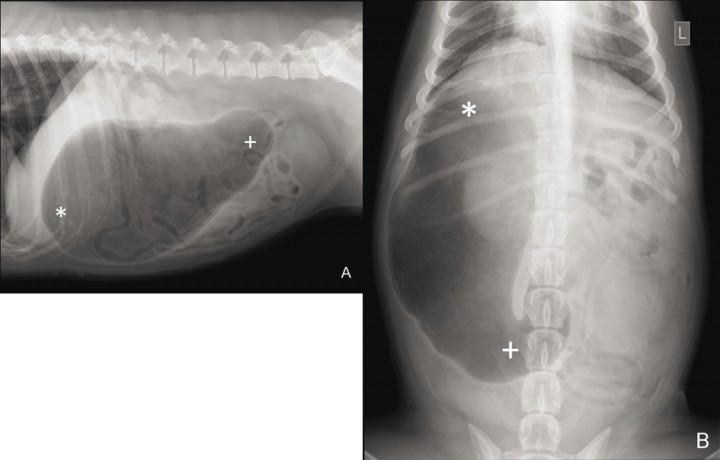
Figura 6
Radiografía lateral derecha (A) y dorso-ventral (B) de la cavidad abdominal tras la descompresión, en un perro con DVG por rotación sobre el eje longitudinal, donde puede visualizarse la lateralización del fundus (*) hacia la derecha y el desplazamiento caudal del antro pilórico (+). (Copyright de AVEPA, utilizado con autorización).
En el examen radiográfico de estos pacientes la presencia de un neumoperitoneo va a evidenciar la existencia de perforación gástrica. En algunos casos se puede observar gas entre las capas de la pared del estómago (neumatosis gástrica), siendo indicativo de un proceso de necrosis gástrica.1,2
Tratamiento
El síndrome de DVG es una urgencia médica y no quirúrgica. El manejo médico de urgencia se centra en la estabilización hemodinámica del paciente y en la descompresión gástrica, con el objetivo de estabilizarlo antes de la cirugía.1,27 Se ha descrito que una vez iniciado el tratamiento médico, si no se ha logrado descomprimir el estómago, la resolución quirúrgica debe realizarse antes de 2-3 horas tras el inicio del mismo, debido a que la persistencia del vólvulo y distensión gástrica pone en peligro la viabilidad de su pared.1 En pocas ocasiones, con la descompresión gástrica, se consigue volver a posicionar correctamente el estómago.
La administración de fluidoterapia a un ritmo elevado se debe instaurar de inmediato mediante la colocación de al menos dos catéteres del mayor calibre posible, en la vena yugular o cefálica. Se inicia el tratamiento con un bolo de cristaloide (90 ml/Kg) aplicando una cuarta parte de su dosis total y reevaluando al paciente para completar el bolo, según sea necesario. La administración de cristaloides isotónicos en bolos de shock puede administrarse junto a coloides (10-20 ml/Kg), para mantener la presión oncótica intravascular, utilizando en ese caso una dosis menor del cristaloide (10-40 ml/Kg). En ocasiones, también puede ser necesaria la combinación con fluidos hipertónicos (5 ml/Kg). La respuesta a la administración de fluidos se evidenciará en el examen físico con una disminución de la frecuencia cardíaca y respiratoria, un pulso femoral más fuerte y un aumento de la presión arterial sistólica.1,2,27
Cuando la respuesta a la fluidoterapia no sea favorable, para mejorar la contractibilidad y el gasto cardiaco se pueden utilizar inotropos positivos como la dobutamina (5-15 µg/Kg/min) y dopamina (3-10 µg/Kg/min), vía intravenosa (IV) en infusión continua, siendo la dopamina el fármaco más beneficioso, pues a bajas dosis mejora la perfusión del bazo y la mucosa gastrointestinal.1 Como última opción, en caso de no obtener respuesta con este tratamiento, se pueden administrar vasopresores para corregir el desequilibrio cardiovascular, del tipo epinefrina (0,05 µg/Kg/min; IV en infusión continua) o norepinefrina (0,1–2 µg/Kg/min; IV en infusión continua).28
La oxigenoterapia es primordial en este tipo de pacientes, así como la administración de una analgesia multimodal y antibioterapia perioperatoria de amplio espectro (cefazolina 22 mg/Kg o amoxicilina – ácido clavulánico, 20 mg/Kg, vía IV).
Existe gran controversia con respecto al uso de antiinflamatorios no esteroideos (AINES) y esteroideos en estos pacientes debido a las alteraciones en la perfusión de los órganos encargados de metabolizarlos, el riesgo de presentación de ulceras gástricas y la no existencia de efectos beneficiosos demostrables en su empleo. Por otra parte, se han realizado estudios del uso de flunixin meglumine (2,2 mg/Kg, IV) para prevenir los efectos endotóxicos que se producen a nivel de la función cardiaca,30 así como de la administración de fármacos antioxidantes y quelantes del hierro (deferoxamina y alopurinol) con el objetivo de incrementar la supervivencia en pacientes con DVG,29 aunque no se ha demostrado la utilidad real de estos productos en la clínica.
El 10-20% de los perros con este síndrome van a presentar arritmias durante el preoperatorio, pudiendo ser tanto supraventriculares como ventriculares y siendo la más común la taquicardia ventricular.1 En la mayoría de los casos, esta arritmia se va a resolver con la corrección de los desequilibrios ácido-base, electrolitos, presión sanguínea y administración de analgesia. Cuando a pesar de la instauración del tratamiento médico se mantiene la arritmia, puede ser tratada mediante la utilización de los siguientes fármacos:
- Lidocaína, en un bolo inicial de 1-2 mg/Kg, IV y mantenimiento en infusión continua de 50-100 µg/Kg/min.31
- Procainamida, en un bolo inicial de 10-15 mg/Kg, IV, administrado lentamente a lo largo de 10 minutos y mantenimiento en infusión continua de 25–50 µg/Kg/min.22
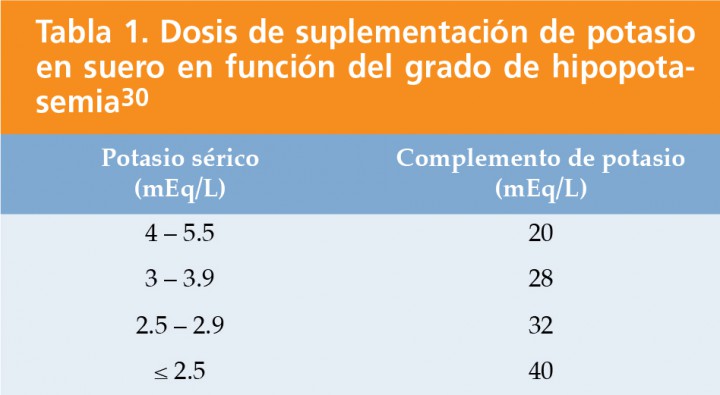
De no responder, se ha de considerar la existencia de hipokalemia o hipomagnesemia, que se solventarán con la suplementación en los fluidos de cloruro potásico (KCl) (Tabla 1)32 y cloruro de magnesio (MgCl) (0,75 mEq/Kg, día), respectivamente.
La alteración electrolítica más grave, es la hipokalemia que debe ser tratada de forma agresiva (Tabla 1). Los casos más severos de acidosis se pueden corregir con el uso de bicarbonato por vía intravenosa (0,3 x peso corporal (Kg) x déficit de base), comenzando con la administración lenta de un tercio de la dosis calculada y realizándose gasometrías sucesivas para determinar si es necesario continuar con la suplementación.1
Simultáneamente a la estabilización hemodinámica, o incluso antes, en el momento de la admisión, se debe realizar la descompresión gástrica de urgencia, que puede hacerse mediante diferentes técnicas que explicamos a continuación.
Descompresión percutánea o gastrocentesis
Es una técnica útil para disminuir la gran distensión gástrica y favorecer la introducción de la sonda orogástrica.1
Se precisa de agujas de gran calibre (al menos 14G) que se introducirán en el estómago a través de la piel y la pared abdominal, localizando la zona con mayor timpanismo mediante la percusión del abdomen. Si el sonido no es claro o la palpación es firme, es probable que el bazo este posicionado entre el estómago y la pared abdominal. Una vez identificada el área donde realizar la descompresión, de manera rápida se rasurará y preparará asépticamente la zona. Se pueden colocar hasta tres agujas de gran calibre, apreciándose inmediatamente la salida de gas con un olor característico.1
Sonda orogástrica
Se empleará un material flexible, de gran calibre (al menos 1,5 cm de diámetro) y con múltiples fenestraciones en su extremo distal, que debe ser romo. Antes del sondaje se medirá la longitud de la sonda a introducir, tomando como referencia la medida desde la trufa hasta la última costilla. Se debe evitar anestesiar al paciente, ya que suele encontrarse en estado de shock y hemodinámicamente inestable. En caso necesario, se puede utilizar una combinación de fentanilo (1-2 µg/Kg; IV) con diazepam (0,1-0,2 mg/Kg; IV),1,2,27 o con midazolan (0,1–0,25 mg/Kg; IV),33 y en las ocasiones que necesitemos un plano más profundo puede administrarse propofol (2–4 mg/Kg) a dosis efecto.34
El extremo de la sonda que queda en la boca debe ser protegido para que el paciente no lo muerda durante su introducción. Con frecuencia, se puede notar cierta resistencia cuando se avanza la sonda a nivel del cardias, si no es así puede significar que exista ruptura de la pared gástrica.1,2,27
En caso de observarse gran dificultad al pasar la sonda orogástrica, puede ser de ayuda colocar al paciente con las extremidades delanteras sobre la mesa de examen mientras se mantienen las extremidades posteriores en el suelo, de esta forma se reduce la presión del estómago sobre el diafragma y se facilita la entrada de la sonda.1
Una vez introducida la sonda se hará el vaciado de la mayor cantidad posible del contenido gástrico (gas, fluido y sólido). Si este contenido es de tipo hemorrágico o con fragmentos oscuros de mucosa, podría indicar la existencia de isquemia y necrosis de la pared del estómago. Posteriormente se han de hacer lavados con agua atemperada (5-10 ml/Kg), asegurándose de dejar el estómago lo más vacío posible al finalizar el procedimiento. Si no fuera posible recuperar el líquido introducido, puede ser un signo de perforación gástrica, recomendándose realizar una radiografía abdominal y abdominocentesis.1
Sonda nasogástrica
Tras la descompresión orogástrica, es recomendable colocar una sonda nasogástrica del mayor calibre posible, para dejar en reposo el estómago y evitar posibles redilataciones durante el periodo de estabilización.
Gastrostomía temporal retrocostal
Es una técnica muy poco utilizada habitualmente; proporciona una descompresión eficiente del estómago durante un período más o menos largo de tiempo, aunque no es una opción recomendada en pacientes con DVG. Se debe realizar sólo como último recurso en caso de no ser posible la descompresión por otro método. Consiste en la realización de una incisión de unos 2 cm en la pared abdominal derecha, a través de la cual se accede y se incide la pared del estómago para fijarla a la piel abdominal, creando una ventana temporal. Para su realización es necesaria la sedación profunda del paciente y aplicación percutánea de un anestésico local, como la lidocaína.1
Tratamiento quirúrgico
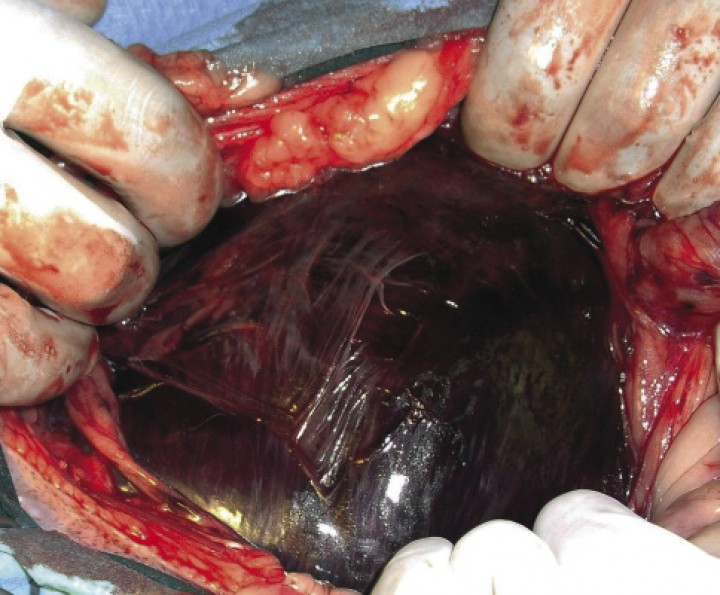
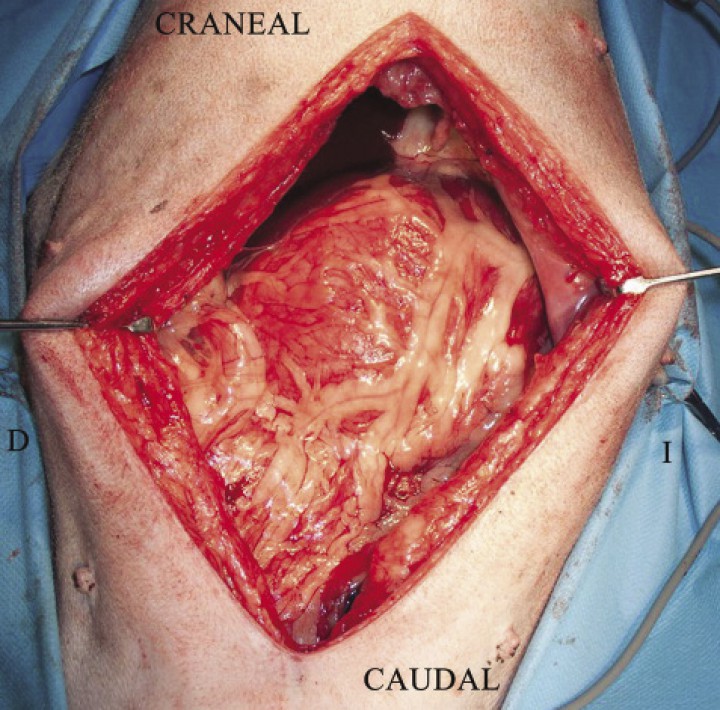
La cirugía no debe realizarse en un paciente hemodinámicamente inestable aunque se haya podido hacer la descompresión gástrica de forma satisfactoria. El objetivo de la cirugía es recolocar el estómago en su posición original, evaluar la viabilidad gástrica (Fig. 7) y esplénica, eliminar el tejido desvitalizado e inviable que esté presente, y crear una adhesión permanente entre el antro pilórico y la pared abdominal retrocostal derecha (gastropexia) para evitar la recidiva de la torsión.1,2,27 En los casos en los que sea necesario, se realizará la gastrectomía de las zonas necróticas y esplenectomía.1,2,27 Una vez preparada la zona abdominal de manera aséptica y con el paciente en decúbito supino, se inicia la laparotomía media, que puede abarcar desde la apófisis xifoides hasta el pubis si fuera necesario. De existir rotación, el omento va a visualizarse nada más abrir la cavidad abdominal, cubriendo ventralmente al estómago (Fig. 8). Si la dilatación gástrica residual o recidivante impide la desrotación, un asistente debe colocar una sonda orogástrica que, con la ayuda del cirujano, se dirigirá a través del esfínter esofágico para poder realizar el vaciado gástrico. La gastrotomía debe evitarse en la medida de lo posible (a no ser que sea imprescindible) debido a la presencia de contenido gástrico con cuerpos extraños de gran tamaño.1,2
Figura 7
Imagen intraoperatoria en un animal con DVG, en el que se evidencia un color anormal de la pared gástrica, indicativo de isquemia y necrosis del estómago (Imagen cedida por Manuel Jiménez Peláez).
Figura 8
Imagen intraoperatoria al realizar la laparotomía por línea media en un animal con DVG, visualizándose el omento cubriendo el estómago, signo indicativo de la presencia de torsión gástrica (Imágen cedida por Manuel Jiménez Peláez).
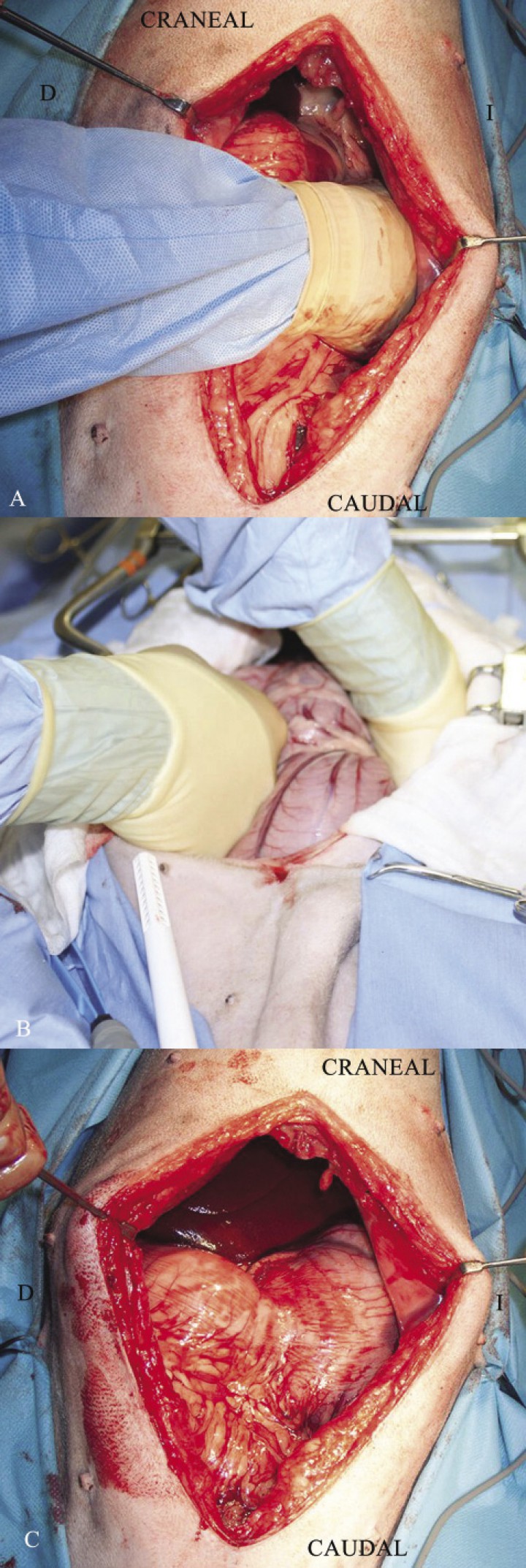
El cirujano ha de identificar el antro pilórico, que debido a la torsión se encontrará en la porción craneal izquierda de la cavidad abdominal, y mediante tracción manual cuidadosa (con la mano derecha) hacia el lado derecho del animal, al mismo tiempo que se presiona con la mano izquierda el cuerpo del estómago dirigiéndolo hacia dorsal, lo colocará en su posición fisiológica (Fig. 9). Para comprobar que se ha realizado correctamente la maniobra se ha de palpar el esófago, el cual debe notarse blando, liso y uniforme.1,2
Figura 9
Secuencia de la maniobra intraoperatoria de la desrotación y recolocación del estómago en un perro con DVG: (A) Localización con la mano derecha del antro pilórico que se localiza de forma anormal en el lado izquierdo y dorsal del paciente. (B) De manera cuidadosa, con la mano izquierda se hará presión sobre el fundus del paciente al tiempo que con la mano derecha se traccionará del antro pilórico para colocarlo en su posición anatómica en el lado derecho del animal. (C) Imagen final tras la desrotación del estómago (Imágenes cedidas por Manuel Jiménez Peláez).
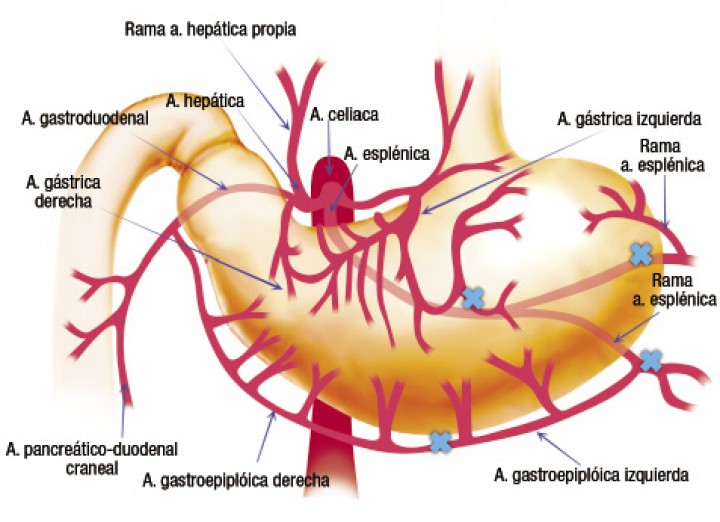
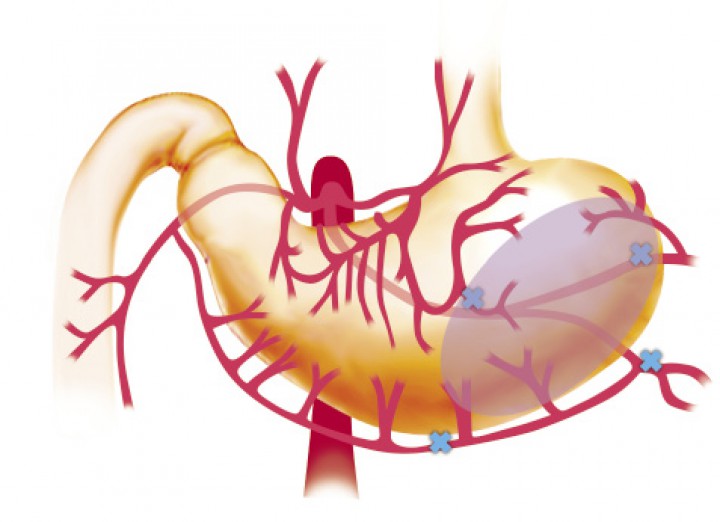
Aproximadamente en el 10% de los casos hay desvitalización de la pared gástrica y es necesaria la realización de una gastrectomía parcial. La zona que suele observarse más afectada es la curvatura mayor del estómago, debido a la frecuente ruptura de los vasos gástricos cortos procedentes de los vasos esplénicos y a la severa dilatación gástrica, que contribuye a la necrosis de esta zona (Figs. 10 y 11).1,2
Figura 10
Esquema representativo de la vascularización del estómago, estando marcados con (X) los vasos sanguíneos que con más frecuencia se dañan durante la DVG.
Figura 11
Esquema representativo de la zona en la que con mayor frecuencia se puede observar la necrosis de la pared gástrica.
La evaluación de la viabilidad de la pared del estómago se hace en base a criterios subjetivos. Los signos de isquemia y necrosis que se pueden observar en la pared gástrica son la disminución de su grosor, su coloración (morado-gris oscuro hasta verdoso claro), ausencia de sangrado en el lugar de la incisión y la disminución o falta de peristaltismo.1,2
Se han descrito experimentalmente diferentes métodos para evaluar de forma objetiva la viabilidad de la pared del estómago, como son la fluoresceína, la flujometría y gammagrafía nuclear. No obstante, la fluoresceína no es un método preciso; y la gammagrafía, aunque aporta mayor precisión, además de no ser una opción práctica en la clínica veterinaria, no establece referencias anatómicas sobre dónde realizar la gastrectomía, además de requerir el aislamiento del paciente.35
Una vez confirmada la presencia de áreas necróticas en la pared del estómago, se puede realizar la resección de dicha zona o su invaginación. En la práctica, estos procedimientos son muy mal tolerados por el paciente, especialmente en estas circunstancias. Tanto la resección como la invaginación gástrica tienen una elevada morbilidad y mortalidad. La invaginación consiste en realizar una sutura continua sobre el tejido gástrico sano adyacente al tejido necrótico, introduciendo éste en el interior del estómago, donde será autodigerido por los jugos gástricos. Esta técnica presenta diferentes complicaciones, como hemorragias y aparición de úlceras gástricas, por lo que no se recomienda su práctica en la actualidad. La gastrectomía parcial es considerada la mejor opción, recomendándose el cierre mediante el uso de la grapadora automática, que se asocia con un porcentaje de mortalidad del 10%, frente a la opción del cierre tradicional con sutura, en el que se ha descrito una mortalidad de hasta el 60%.30
Para completar el procedimiento quirúrgico es imperativo realizar una gastropexia, con el objetivo de conseguir una fijación permanente del antro pilórico a la pared abdominal derecha, caudal a la última costilla, para prevenir la recurrencia de la DVG.1,2 La incidencia de recidiva, si no es realizada, es del 80% frente a un porcentaje de recurrencia inferior al 5% cuando se hace la gastropexia, independientemente de la técnica empleada.36
Se han descrito diferentes técnicas de gastropexia: con balón, incisional, incisional modificada, circuncostal, usando un colgajo seromuscular,1 gastrocolopexia,37 por laparoscopia y laparoscopia asistida.36 La gastropexia por balón es la técnica que ofrece la unión más débil,1 mientras que la incisional es el método ideal y más frecuentemente utilizado, por ser un procedimiento rápido, relativamente fácil de realizar, seguro y efectivo (Fig. 12).36,38,39 Hay diferentes opciones mínimamente invasivas para hacer una gastropexia profiláctica en perros de máximo riesgo, como son la gastropexia asistida por gastroscopia, asistida por laparoscopia y laparoscópica completa.36,38
Figura 12
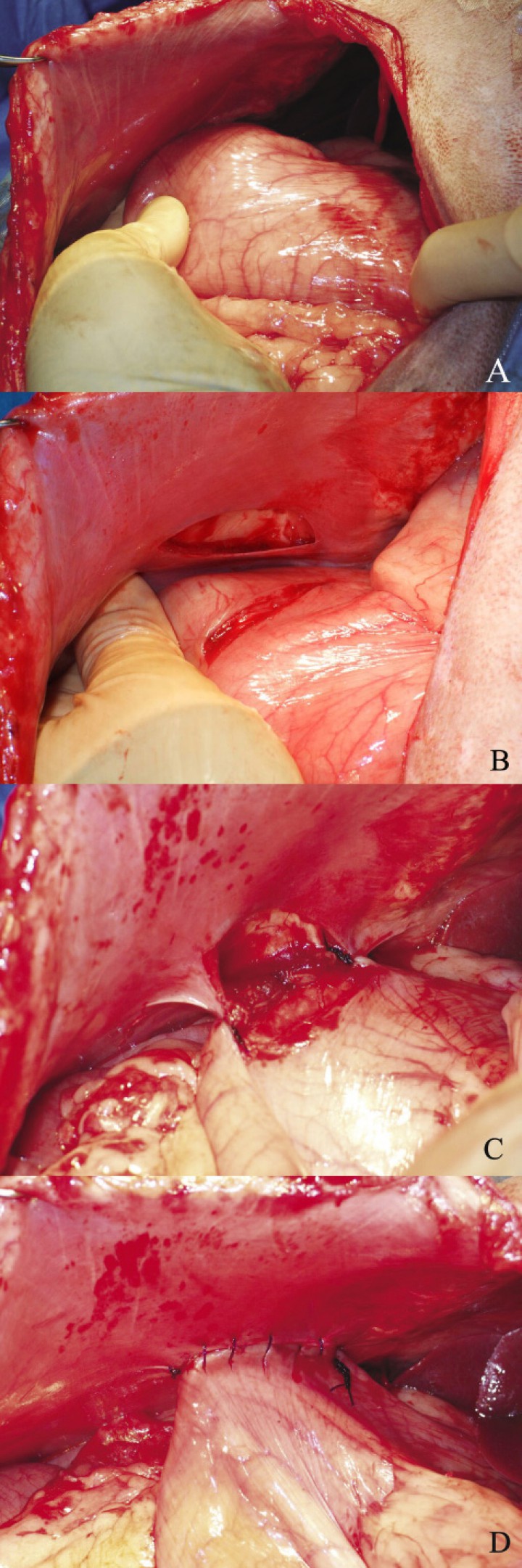
|
Secuencia de realización intraoperatoria de la gastropexia incisional. A. Localizar en la pared abdominal derecha la zona donde realizar la gastropexia, aproximadamente a 2-3 cm caudalmente a la última costilla y aproximar la zona del antro pilórico, para confirmar que la posición de la gastropexia es anatómicamente correcta. B. Realizar una incisión de unos 4 cm sobre la serosa de la pared abdominal y del estómago en su porción cercana al antro pilórico. C y D. Realizar la sutura de ambos bordes de la incisión por independiente, con un patrón de sutura continuo simple (Imágenes cedidas por Manuel Jiménez Peláez). |
Gastropexia incisional
La adhesión permanente entre la pared gástrica y abdominal debe realizarse caudalmente a la última costilla (para evitar penetrar en tórax), y siempre teniendo en cuenta la posición fisiológica de estómago y así limitar las repercusiones negativas de la gastropexia.1,2
Se debe hacer una incisión seromuscular, de unos 4–5 cm, en la pared del antro pilórico, en el punto medio entre la curvatura mayor y menor del estómago. Previamente a realizar la incisión sobre el peritoneo y músculo transverso del abdomen, se aproximará la zona del antro pilórico a la pared lateral derecha del abdomen, para determinar la zona donde incidir, que suele coincidir con unos 2–3 cm caudalmente a la última costilla, y posteriormente se hará una incisión con una longitud similar a la realizada en el estómago, teniendo siempre en cuenta que el estómago quede en una posición fisiológica. Para unir dichas incisiones se ha de utilizar una sutura monofilamento del 2/0 ó 0 y mediante un patrón simple continuo monocapa, comenzando por el borde de la incisión más dorsal de craneal a caudal, y finalizando en el borde más ventral (Fig. 12).2 Es muy recomendable omentalizar la zona de la gastropexia al finalizar el procedimiento. Recientemente se ha descrito, con buenos resultados, la realización de esta técnica mediante el uso de grapadora automática.40
Manejo post-quirúrgico de la DVG
Las actuaciones en el manejo post-operatorio de estos pacientes van dirigidas a mantener una correcta perfusión tisular, con el fin de controlar el daño isquémico por reperfusión, cuyas consecuencias fatales pueden derivar en un síndrome de respuesta inflamatoria sistémica (SIRS) y/o en un síndrome de disfunción multiorgánica (MODS). Las complicaciones asociadas a estos síndromes incluyen disfunción cardiovascular, respiratoria, gastrointestinal, alteraciones en la coagulación, insuficiencia renal aguda (IRA) y daño isquémico por reperfusión.41
Debido al elevado índice de mortalidad descrito en el síndrome de DVG (10-33%), resulta de gran utilidad contar con indicadores o marcadores pronósticos42 que se puedan utilizar como predictores de las posibles complicaciones post-operatorias y, de esta forma, establecer precozmente las oportunas terapias específicas.
Marcadores de pronóstico
Concentración plasmática de lactato
La mayoría de perros con DVG poseen elevados niveles plasmáticos de lactato debido a los distintos grados de hipoperfusión generalizada que pueden sufrir, así como al estado de sepsis, shock séptico o SIRS que pueden presentar.42 Otros factores que contribuyen a este estado de hiperlactatemia son la isquemia de la pared gástrica y/o del bazo.42
La medida de las concentraciones plasmáticas del lactato ha tomado especial importancia en la última década.43 La mayoría de los estudios en veterinaria muestran que la población de animales con DVG que fallece poseen concentraciones de lactato superiores a aquellos que sobreviven; no obstante, se han observado valores elevados en algunos animales que sobreviven, y niveles de lactato ligeramente elevados o incluso dentro del rango de referencia en animales que fallecen. La explicación que se puede dar a estas situaciones aparentemente contradictorias es que la supervivencia del paciente depende directamente del proceso de base causante de la hiperlactatemia;43 por ello, el valor pronóstico de la concentración del lactato no es por la toma de una única medición, sino por su evolución a lo largo del tiempo.44 Por tanto, animales que presentan antes de la cirugía niveles de lactato ≥ 6 mmol/L deben ser monitorizados y se han de realizar medidas repetidas durante su hospitalización, de forma que cuando los valores de lactato persistan elevados en el tiempo, se debe sospechar de la presencia de necrosis gástrica.45,46
Troponinas
Actualmente es el test de elección para determinar el daño cardiaco, basándose en la medida de las concentraciones séricas de troponina I y troponina T.47 La troponina I es más sensible para la detección de daño celular miocárdico, aunque unos valores elevados de troponina T tienen mayor valor pronóstico negativo en perros con DVG.48
En animales con DVG, se ha observado que las troponinas cardiacas aumentan significativamente en las primeras 24-48 horas48 y se ha relacionado esa elevación de su valor con alteraciones en el electrocardiograma y un peor pronóstico.49
11-Deshidrotromboxano B2 (11-dTXB2)
Es un metabolito estable del tromboxano A2, sintetizado por plaquetas, células de músculo liso, hepatocitos, miocitos cardiacos y células endoteliales como respuesta a diversos estímulos, como moléculas de oxígeno reactivo o endotoxinas.50
Se ha descrito una relación directa entre la excreción renal de 11-dTXB2 y la incidencia de complicaciones intra o postoperatorias en animales con DVG.51
Mioglobina
Ante un daño celular causado por una inadecuada perfusión tisular se puede producir una liberación de mioglobina a la circulación.52Aunque existen diversos factores que afectan a la concentración de mioglobina en perros con DVG, se han observado concentraciones superiores en animales fallecidos respecto a los que han sobrevivido a la enfermedad. De esta forma, una concentración de mioglobina en el momento del diagnóstico menor de 168 ng/ml, se asocia a un 90% de supervivencia; y un valor superior, a una del 50%. A pesar de estos datos, no se recomienda tomarlo como único parámetro indicador pronóstico en estos casos, por tener una sensibilidad del 60% y una especificidad del 84.2%.53
Pepsinógeno-A
Se produce y almacena en la mucosa gástrica, por lo que se ha descrito que puede utilizarse como marcador del estado del estómago en perros.54
En perros con DVG, se ha observado que la concentración de pepsinógeno-A se incrementa en un 20% y que valores elevados de esta proenzima se asocian a una mayor incidencia de necrosis gástrica y de muerte. Por ello, su aumento se ha relacionado con la severidad y pronóstico de esta patología.55
Inmunorreactividad de la lipasa pancreática canina (cPLI)
Una de las posibles complicaciones tras la DVG, es la pancreatitis (58% de los casos) debida a la inflamación y edema que se pueden producir como consecuencia de la hipoperfusión e isquemia.55,56 Es por ello que puede ser un test de utilidad en estos pacientes, principalmente cuando se evidencia dolor abdominal y vómitos durante su hospitalización.
Proteína C-reactiva (CRP)
Es una proteína de fase aguda producida por el hígado en casos de lesión traumática, inflamación o neoplasia.57 En el 75% de los perros con DVG se ha visto significativamente elevada; sin embargo, es un predictor poco fiable de lesión de la mucosa gástrica y de mortalidad en estos pacientes.55
Cuidados intensivos
Tras la cirugía, el manejo con cuidados intensivos resulta crucial para la supervivencia. En esta fase, el objetivo es prevenir y tratar las complicaciones potenciales que pueden surgir tales como: dolor, disfunción cardiovascular, alteraciones respiratorias, complicaciones gastrointestinales, coagulopatías, insuficiencia renal aguda o daño isquémico por reperfusión.
Analgesia post-operatoria
El tratamiento multimodal del dolor en estos pacientes es de vital importancia. Los analgésicos de elección son opiáceos agonistas puros del receptor µ tales como la morfina (0,5-1 mg/Kg, vía intramuscular (IM) o 0,1-0,5 mg/Kg, IV), metadona (0,05 mg/Kg, vía subcutánea (SC)), petidina (2-6 mg/Kg, IM/SC) o fentanilo (en infusión continua (0,002-0,02 mg/Kg) o aplicación transdérmica (0,075-0,1 mg/h)).31
El empleo de infusiones continuas, combinando un opiáceo junto con ketamina (3-6 mg/Kg) y/o lidocaína (1-3 mg/Kg) resulta adecuado y ayuda a mantener unas concentraciones plasmáticas constantes de analgésicos.31
Se debe evitar el uso de antiinflamatorios no esteroideos por sus efectos secundarios sobre el sistema gastrointestinal y renal.31
Disfunción cardiovascular
Las manifestaciones cardiovasculares de la DVG, como se describió previamente, son: shock, arritmias cardiacas y disfunción miocárdica.58
El shock que se produce es de tipo obstructivo, por la compresión de la vena porta, vena esplénica y vena cava caudal; distributivo, debido a la congestión esplénica; hipovolémico;59 y cardiogénico, como consecuencia de la disfunción y las arritmias cardiacas.58
En estos pacientes, la fluidoterapia post-quirúrgica se debe mantener con cristaloides isotónicos y a un ritmo de infusión de mantenimiento de 50 ml/Kg las primeras 24 horas, ya que la hipovolemia no suele ser predominante en estos casos.31 Este ritmo se reajustará en base a la monitorización de los distintos parámetros: frecuencia cardiaca, tiempo de relleno capilar, presión arterial y producción de orina. Los electrolitos también deben ser monitorizados y corregidos en caso necesario, principalmente el potasio.
El empleo de soluciones coloidales resulta controvertido por sus efectos secundarios. En casos de hipoalbuminemia severa (<1,5 g/dL), se recomienda el uso de soluciones con albúmina canina o humana. Si se opta por la administración de albúmina humana, los propietarios deben ser informados de sus posibles efectos adversos.60
Hasta en un 42% de los casos aparecen arritmias cardiacas que son principalmente de origen ventricular y debidas a la isquemia miocárdica.61 Es de gran importancia monitorizar el electrocardiograma las primeras 24-48 horas, con el fin de detectar las posibles alteraciones de forma precoz. Si la taquicardia ventricular (≥ 180 latidos/minuto) se mantiene en el tiempo, se recomienda el tratamiento con lidocaína (1-2 mg/Kg en bolo lento inicial e infusión continua a 50–100 μg/Kg/min), o procainamida (10-15 mg/Kg en 10 minutos, e infusión a 25-50 μg/Kg/min).1,62
Disfunción respiratoria
En casos graves se puede producir un aumento de la frecuencia respiratoria, que al resultar ineficiente, puede dar lugar a hipercapnia e hipoxemia.58 En aquellos animales en los que exista evidencia de neumonía por aspiración se instaurará una antibioterapia y oxigenoterapia adecuadas y se realizará una monitorización constante de la pulsioximetría y gasometría. En casos con severa hipoxemia, hipercapnia o fatiga respiratoria puede ser necesario el empleo de ventilación mecánica.31
Disfunción gastrointestinal
La necrosis gástrica es una complicación frecuente en estos pacientes.58 El manejo de los signos gastrointestinales va dirigido al tratamiento de las posibles alteraciones que se pueden producir (úlceras gástricas, nauseas, vómito, anorexia y regurgitación).31
Como protectores gástricos se administrarán antiácidos (antagonistas de los receptores H2, o inhibidores de la bomba de protones) y sucralfato. En caso de íleo paralítico o regurgitación, se emplearán procinéticos y/o antieméticos (metoclopramida, ranitidina, maropitant).31
Es importante el momento en el que se comienza a alimentar a estos pacientes por vía oral. En general, si el estado del animal lo permite, se recomienda un inicio rápido de la alimentación enteral, dentro de las primeras 24 horas postquirúrgicas, para estimular la motilidad intestinal y mantener un estado nutricional adecuado.63 En casos leves, los animales empiezan a comer voluntariamente en un plazo de 1-3 días post-cirugía. Sin embargo, en los casos más complicados puede ser necesario un soporte nutricional a través de sondas nasogástricas, nasoesofágicas o mediante nutrición parenteral central.31
Alteraciones en la coagulación
La coagulación intravascular diseminada (CID) es otra de las complicaciones en casos de DVG (7.8%41-40%64). En numerosas ocasiones, esta coagulopatía resulta autolimitante, aunque si se mantiene en el tiempo debe administrarse plasma fresco congelado para intentar paliarla.31
Manejo de la insuficiencia renal aguda (IRA)
En animales con DVG, la presencia de un incremento de creatinina ≥ 0,3 mg/dL, aunque el valor resultante se encuentre dentro del rango de referencia, es indicativos de IRA.65 Entre los mecanismos potenciales que dan lugar a esta insuficiencia renal se incluyen la hipoperfusión tisular debida al shock, la respuesta inflamatoria y la presencia de coagulopatías causantes de microtrombos renales. El empleo de determinados tratamientos utilizados para la resucitación, tales como las soluciones coloidales, también pueden exacerbar el proceso.58
En estos pacientes se debe controlar el estado de hidratación, peso y producción de orina.65 En animales oligúricos con signos de sobrehidratación se pueden emplear fármacos estimulantes de la producción de orina tales como fenoldopam (0,8 μg/Kg/min), furosemida (1-2 mg/Kg, IV en bolo, seguido de una infusión continua), o manitol (1 g/Kg, IV en 20 minutos).31
Manejo del daño isquémico por reperfusión
Se ha descrito que el uso de lidocaína, principalmente si se emplea antes de la instauración del daño isquémico, puede disminuir la severidad de estos procesos;66 no obstante, no parece que pueda mejorar el pronóstico de manera significativa.
Terapia antibiótica
Con respecto a la terapia antibiótica, en los casos de DVG en los que no se realiza esplenectomía ni gastrectomía parcial, se pueden usar cefalosporinas de primera generación durante cinco días. Sin embargo, si existe perforación gástrica o necrosis, se recomienda administrar asociaciones de antibióticos como amoxicilina-ácido clavulánico y fluoroquinolonas, durante una semana.31
Pautas de manejo para prevenir recidivas
Los propietarios de perros con alto riesgo de padecer el síndrome de DVG deberían ser aconsejados sobre importantes pautas de manejo, como la de favorecer que el perro coma más lentamente (con medidas como por ejemplo separarlo del resto de animales con los que conviva para evitar la competencia por la comida), evitar que ingiera grandes cantidades de alimento repentinamente, o también la conveniencia de realizar una gastropexia profiláctica en animales jóvenes, advirtiendo siempre al propietario que esta técnica va a reducir la incidencia de la rotación gástrica, pero no evitará la manifestación de la dilatación de estómago.
Conclusión
La DVG es un síndrome frecuente en la clínica veterinaria de urgencias que pone en peligro la vida del perro. Su temprano diagnóstico y tratamiento médico-quirúrgico aumenta el porcentaje de supervivencia y disminuye las complicaciones, ya que la presencia de signos clínicos durante más de seis horas, el tener que realizar gastrectomía y/o esplenectomía, la manifestación de hipotensión, necrosis gástrica, arritmias, peritonitis, CID, aumento de las concentraciones de lactato postquirúrgicas y el desarrollo de sepsis, van a aumentar el riesgo de mortalidad en estos pacientes. No obstante, merced al avance en los cuidados intensivos, el porcentaje de supervivencia en la actualidad de perros con síndrome de DVG es de un 73–90%.
Fuente de financiación: Este trabajo no se realizó con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: El autor declara que no existe conflicto de intereses.
Bibliografía
- 1.
Monnet E. Gastric dilatation-volvulus syndrome in dogs. Vet Clin Small Anim Pract 2003; 33: 987-1005.
[PubMed] - 2.
Cornell K. Gastric dilatation and volvulus. En Tobias KM, Johnston SA (ed): Veterinary Surgery Small Animal. Vol. 2. St. Louis, Missouri, Elsevier Saunders, 2012; 1508-1510.
- 3.
Paris JK, Yool DA, Reed N, et al. Chronic gastric instability and presumed incomplete volvulus in dogs. J Small Anim Pract 2011; 52: 651-655.
- 4.
Gazzola KM, Nelson LL. The relationship between gastrointestinal motility and gastric dilatation-volvulus in dogs. Top Companion Anim Med 2014; 29: 64-66.
- 5.
Pipan M, Brown DC, Battaglia CL, Otto CM. An internet-based survey of risk factors for surgical gastric dilatation-volvulus in dogs. J Am Vet Med Assoc 2012; 240: 1456-1462.
[PubMed] - 6.
Bell JS. Inherited and predisposing factors in the development of gastric dilatation volvulus in dogs. Top Companion Anim Med 2014; 29: 60-63.
- 7.
Raghavan M, Glickman NW. The effect of ingredients in dry dog foods on the risk of gastric dilatation-volvulus in dogs. J Am Anim Hosp Assoc 2006; 42 (1): 28-36.
[PubMed] - 8.
Raghavan M, Glickman NW, McCabe G, Lantz G, Glickman LT. Diet-related risk factors for gastric dilatation-volvulus in dogs of high-risk breeds. J Am Anim Hosp Assoc 2004; 40 (3): 192-203.
[PubMed] - 9.
Levine M, Moore GE. A time series model of the occurrence of gastric dilatation-volvulus in a population of dogs. BMC Vet Res 2009; 5: 12.
- 10.
Moore GE, Levine M, Anderson JD, Trapp RJ: Meteorological influence on the occurrence of gastric dilatation-volvulus in military working dogs in Texas. Int J Biometeorol 2008; 52: 219-222.
- 11.
Herbold JR, Moore GE, Gosch TL, Bell BS. Relationship between incidence of gastric dilatation-volvulus and biometeorologic event in a population of military working dogs. Am J Vet Res 2008; 63: 47-52.
[PubMed] - 12.
Dennler R, Koch D, Hassig M, Howard J, Montavon PM. Climatic conditions as a risk factor in canine gastric dilatation-volvulus. Vet J 2005; 169: 97-101.
[PubMed] - 13.
Millis DL, Nemzek J, Riggs C, Walshaw R. Gastric dilatation-volvulus after splenic torsion in two dogs. J Am Vet Med Assoc 1995; 207: 314-315.
- 14.
Goldhammer MA, Haining H, Milne EM, Shaw DJ, Yool DA. Assessment of the incidence of GDV following splenectomy in dogs. J Small Anim Pract 2012; 51: 23-28.
- 15.
Grange AM, Clough W, Casale SA. Evaluation of splenectomy as a risk factor for gastric dilatation-volvulus. J Am Vet Anim Assoc 2012; 241: 461-466.
- 16.
Sartor AJ, Bentley AM, Brown DC. Association between previous splenectomy and gastric dilation-volvulus in dogs: 453 cases (2004-2009). J Am Vet Med Assoc 2013; 242: 1381-1384.
[PubMed] - 17.
Aslanian ME, Sharp CR, Garneau MS. Gastric dilatation and volvulus in a brachycephalic dog with hiatal hernia. J Small Anim Pract 2014; 55: 535-537.
[PubMed] - 18.
Battisti A, Toscano MJ, Formaggini L. Gastric foreign body as risk factor for gastric dilatation and volvulus in dogs. J Am Vet Med Assoc 2012; 241: 1190-1193.
[PubMed] - 19.
Van Kruiningen HJ, Gargamelli C, Havier et al. Stomach gas analyses in canine acute gastric dilatation with volvulus. J Vet Intern Med 2013; 27: 1260-261.
- 20.
Bedioui H, Bensafta Z. Gastric volvulus: diagnosis and management. Presse Med 2008; 37: 67-76.
- 21.
Slatter D. Stomach. En Slatter DH (ed): Textbook of small animal surgery, St Louis, Missouri, Elsiever Saunders, 2003; 602.
- 22.
Radlinsky MG. Surgery of digestive system. En Fossum TW, Dewey CW, Horn CV, Johnson HL, McPhail CM, Radlinsky MG, Schulz KS, Willard MD (eds): Small Animal Surgery, St. Louis, Missouri, ELSEVIER Mosby, 2013; 482-487.
- 23.
Carrillo JD, Escobar M, Soler M, Agut A. ¿Cuál es tu diagnóstico?. Clin Vet Peq Anim 2015; 35: 123-125.
- 24.
Brockman DJ, Schertel ER, Allen DA, Birchard SJ, DeHoff WD. Factors associated with perioperative mortality in dogs with surgically managed gastric dilatation-volvulus: 137 cases (1988-993). J Am Vet Med Assoc 1996; 208: 1855-1858.
- 25.
Monet E. Dilatación y vólvulo gástrico. Vet Med Esp 2013; 7: 5-13.
- 26.
Zacher LA, Berg J, Shaw SP, Kudej K. Association between outcome and changes in plasma lactate concentration during presurgical treatment in dogs with gastric dilatation-volvulus: 64 cases (2002-2008). J Am Vet Med Assoc 2010; 236: 892-897.
[PubMed] - 27.
Lantz GC, Badylak SF, Hiles MC, Arkin TE. Treatment of reperfusion injury in dogs with experimentally induced gastric dilation-volvulus. Am J Vet Res 1992; 53: 1594-1598.
- 28.
Silverstein DC, Santoro Beer KA. Controversies regarding choice of vasopressor therapy for management of septic shock in animals. J Vet Emerg Crit Care 2015; 25: 48–54.
- 29.
Badylak SF, Lantz GC, Jeffries M. Prevention of reperfusion injury in surgically induced gastric dilation-volvulus in dogs. Am J Vet Res 1990; 51: 294-299.
- 30.
Davidson JR, Lantz GC, SalisburySK, Kazacos EA, Bottoms GD. Effects of flunixin meglumine on with experimental gastric dilatation-volvulus. Vet Surg 1992; 21:113-120.
- 31.
Bruchim Y, Kelmer E. Postoperative management of dogs with gastric dilatation volvulus. Top Companion Anim Med 2014; 29: 81-85.
- 32.
Sanchez A, Belda E, Escobar MT, et al. Effects of altering the sequence of midazolam and propofol during co-induction of anaesthesia. Vet Anaesth Analg 2013; 40: 359-366.
- 33.
Watney GC, Pablo LS. 1992. Median effective dosage of propofol for induction of anesthesia in dogs. Am J Vet Res 1992; 53: 2320-2322.
- 34.
Kirby R, Rudloff E. Sueroterapia con cristaloides y coloides. En Ettinger SJ, Feldman EC (eds): Tratado de Medicina Interna Veterinaria, Vol 1, Madrid, Elsevier 2007; 419.
- 35.
Clark GN, Pavletic MM. Partial gastrectomy with an automatic stapling instrument for treatment of gastric necrosis secondary to gastric dilatation-volvulus. Vet Sur 1991; 20: 61-68.
- 36.
Philip A, April P. Gastropexy for prevention of gastric dilatation-volvulus in dogs: History and techniques. Top Companion Anim Med 2014; 29: 77-80.
- 37.
Eggertsdóttir AV, Langeland M, Fuglem B, Mohn A, Stigen O. Long-term outcome in dogs after circumcostalgastropexy or gastrocolopexy for gastric dilatation with or without volvulus. Vet Sur 2008; 37: 809-810.
- 38.
Rawlings CA. Incisional gastropexy to prevent and treat canine gastric dilatation-volvulus. Compendium 2013; 35: E1-E5.
- 39.
Benitez ME, Schmiedt CW, Radljinsky MG, Cornell KK. Efficacy of incisional gastropexy for prevention of GDV in dogs. J Am Anim Hosp Assoc 2013; 49: 185-189.
- 40.
Belandria G, Pavletic M, Boulay J, Penninck D. Gastropexy with an automatic stapling instrument for the treatment of gastric dilatation and volvulus in 20 dogs. Can Vet J 2009; 50: 733-740.
- 41.
.Beck JJ, Staatz AJ, Pelsue DH, Kudnig ST, MacPhail CM et al. Risk factor associated with short-term outcome and development of perioperative complications in dogs undergoing surgery because of gastric dilatation-volvulus: 166 cases (1992-2003). J Am Vet Med Assoc 2006; 229: 1934-1939.
- 42.
Mooney E, Cameron R, Hughes D. Plasma lactate concentration as a prognostic biomarker in dogs with gastric dilation and volvulus. Top Companion Anim Med 2014; 29: 71-76.
- 43.
Mackenzie G, Barnhart M, Kennedy S, DeHoff W, Schertel E. A retrospective study of factors influencing survival following surgery for gastric dilation volvulus syndrome in 306 dogs. J Am Anim Hosp Assoc 2010; 46: 97-102.
[PubMed] - 44.
Zacher LA, Berg J, Shaw SP, Kudej RK. Association between outcome and changes in plasma lactate concentration during presurgical treatment in dogs with gastric dilation-volvulus: 64 cases (2002-2008). J Am Med Assoc 2010; 236: 892-897.
[PubMed] - 45.
Papp E, Drobatz KJ, Hughes D. Plasma lactate concentration as a predictor of gastric necrosis and survival among dogs with gastric dilation-volvulus: 102 cases (1995-1998). J Am Med Assoc 1999; 215: 49-52.
[PubMed] - 46.
Beer KA, Syring RS, Drobatz KJ. Evaluation of plasma lactate concentration and base excess at the time of hospital admission as predictors of gastric necrosis and outcome and correlation between those variables in dogs with gastric dilation-volvulus: 78 cases (2004-2009). J Am Vet Med Assoc 2013; 242: 54-58.
[PubMed] - 47.
Iwan AB, Alan K, G. Neal M, Chirstophe WL. Cardiac troponins as indicators of acute myocardial damage in dogs. J Vet Intern Med 2006; 20: 277-283.
- 48.
Apple FS, Wu AH. Myocardial infarction redefined: role of cardiac troponin testing. Clin Cwhem 2001; 47: 377-379.
- 49.
Schober KE, Cornand C, Kirbach B, Aupperle H, Oechtering G. Serum cardiac troponin I and troponin T concentrations in dogs with gastric dilatation-volvulus. J Am Vet Med Assoc 2002; 221: 381-388.
- 50.
Nanji AA, Rahemtulla A, Maio L. Alterations in thromboxane synthase and thromboxane A2 receptors in experimental alcoholic liver disease. J Pharmacol Txp Ther 1997; 282: 1037-1043.
- 51.
Baltzer WI, McMichael MA, Ruaux CG, et al. Measurement of urinary 11-dehydrothromboxane B2 excretion in dogs with gastric dilatation-volvulus. Am J Vet Res 2006; 1: 78-83.
- 52.
Vaidya HC. Myoglobin. Lab Med 1992; 23: 306-310.
- 53.
Adamik KN, Burgener IA, Kovacevic A, Schulze SP, Kohn B. Myoglobin as a prognostic indicator for outcome in dogs with gastric dilatation-volvulus. Vet Emerg Crit Care Soc 2009; 19: 247-253.
- 54.
Suchodolski JS, Steiner JM, Ruaux CG. Purification and partial characterization of canine pepsinogen A and B. Am J Vet Res 2002; 63: 1585-1590.
- 55.
Israeli I, Steiner J, Segev G, et al. Serum pepsinogen-A, Canine pancreatic lipase inmunoreactivity, and C-reactive protein as prognostic markers in dogs with gastric dilatation-volvulus. J Vet Intern Med 2012; 26: 920-928.
- 56.
Mattiesen DT. Gastric dilatation volvulus. En Slatter D (ed): Textbook of small animal surgery, Philadelphia, WB Saunders, 1993; 580-591.
- 57.
Plikert HD, Einspamier R, Arndt G. Evaluation of a poin-of-care test for canine C-reactive protein. Vet Clin Pathol 2011; 40: 384-388.
- 58.
Sharp CR, Rozanski EA. Cardiovascular and systemic effects of gastric dilatation volvulus in dogs. Top Companion Anim Med 2014; 29: 67-70.
- 59.
Green TI, Tonozzi CC, Kirby R, Rudloff, E. Evaluation of initial plasma lactate values as a predictor of gastric necrosis and initial and subsequent plasma lactate values as a predictor of survival in dogs with gastric-dilation volvulus: 84 dogs (2003-2007). J Vet Emerg Crit Care 2011; 21: 36-44.
[PubMed] - 60.
Martin LG, Luthen TY, AlperinDC. Serum antibodies against human albumin in critically ill and healthy dogs. J Am Vet Med Assoc 2008; 232: 1004-1009.
- 61.
Brockman DJ, Washabau RJ, Drobatz KJ. Canine gastric dilatation/volvulus syndrome in a veterinary critical care unit: 295 cases (1986-1992). J Am Vet Med Assoc 1995; 207: 460-464.
- 62.
Broome CJ, Walsh VP. Gastric dilatation-volvulus in dogs. NZ Vet J 2003; 51: 275-283.
- 63.
Kawasaki N, Suzuki Y, Nakayoshi T. Early postoperative enteral nutrition is useful for recovering gastrointestinal motility and maintaining the nutritional status. Surg Today 2009; 39: 225-230.
- 64.
Millis DL, Hauptman JG, Fulton Jr RB. Abnormal hemostatic profiles and gastric necrosis in canine gastric dilatation-volvulus. Vet Surg 1993; 22: 93-97.
- 65.
Thoen ME, Kerl ME. Characterization of acute kidney injury of hospitalized dogs and evaluation of a veterinary acute kidney injury staging system. J Vet Emerg Crit Care 2011; 21: 648-657.
- 66.
Bruchim Y, Itay S, Shira BH. Evaluation of lidocaine treatment on frequency of cardiac arrhythmias, acute kidney injury and hospitalization time in dogs with gastric dilatation volvulus. J Vet Emerg Crit Care 2012; 22: 419-427.