El endotelio corneal y sus principales enfermedades en el perro
The corneal endothelium and its main diseases in the dog
Contacto: vetnie@gmail.com
Resumen
El endotelio corneal es una monocapa de células poligonales situada en la parte más interna de la córnea, en contacto con el humor acuoso. Esta capa controla el transporte de agua y nutrientes hacia la córnea y preserva la transparencia corneal. Las alteraciones primarias más comunes de esta capa en el perro incluyen la distrofia endotelial corneal, la distrofia polimórfica posterior y la degeneración endotelial senil. Entre las endoteliopatías secundarias encontramos una gran variedad de causas tanto oculares (uveítis anterior, glaucoma…) como sistémicas (diabetes, hepatitis infecciosa canina…). Cualquier alteración del endotelio corneal se traducirá en la aparición de edema corneal difuso, de mayor o menor grado siendo necesario conocer la causa de dicho edema para establecer el tratamiento y pronóstico correcto.
Palabras clave: Edema corneal, microscopía especular, distrofia endotelial, endoteliopatías.
Clin. Vet. Peq. Anim, 2017, 37 (3): 171-180
Summary
The corneal endothelium is a monolayer of polygonal cells on the inner surface of the cornea, in direct contact with the aqueous humor. This layer governs fluid and solute transport across the cornea and preserves corneal transparency. Common primary disorders of this layer include corneal endothelial dystrophy, posterior polymorphous dystrophy and senile endothelial degeneration. Several causes can lead to secondary disorders of the endothelium such as ocular diseases (anterior uveitis, glaucoma…) or systemic diseases (diabetes, infectious canine hepatitis…). Any disturbance of the corneal endothelium will result in different degrees of diffuse corneal edema. Therefore, knowledge of the underlying cause is required in order to establish the proper treatment and prognosis of the disease.
Keywords: Corneal edema, specular microscopy, endothelial dystrophy, corneal endothelium diseases.
Clin. Vet. Peq. Anim, 2017, 37 (3): 171-180

La presencia de este logo en un artículo de la revista indica que se publicará un examen sobre el mismo en la plataforma AVEPA Elearning. Su resolución aporta 0,15 créditos dentro del sistema de acreditaciones de especialidades veterinarias de AVEPA.
Introducción
La córnea es una estructura lisa, avascular y transparente formada por cuatro capas en el perro. La capa más interna de la córnea es el endotelio corneal; se trata de una monocapa de células poligonales (en su mayoría hexagonales) que controla el paso de nutrientes y humor acuoso a través de la córnea. Esta función la desempeña gracias a mecanismos de transporte pasivos y activos (posee una potente bomba sodio-potasio ATPasa) que permiten preservar la transparencia corneal.
En el perro existen tres patologías endoteliales primarias descritas: la distrofia endotelial corneal (muy similar a la distrofia de Fuchs en humanos), la distrofia polimórfica posterior (también presente en humanos) y la degeneración endotelial senil.
Existe una gran variedad de enfermedades y factores que producen alteración endotelial secundaria, tales como el glaucoma, la uveítis anterior, la diabetes, las cirugías intraoculares, la hepatitis infecciosa canina, etc.
El principal signo clínico de una alteración endotelial es el edema difuso corneal, ya que el endotelio no puede ejercer correctamente su función. Este edema corneal puede ser de mayor o menor gravedad en función de la causa que lo produzca y, en diferentes casos, puede producir ceguera. Es necesario, por tanto, detectar la causa subyacente de dicha alteración.
En el presente artículo de revisión, se explicarán en profundidad las enfermedades y causas más frecuentes que pueden producir endoteliopatías, así como los signos clínicos y hallazgos microscópicos que podemos encontrar en cada una de ellas. El tratamiento variará en función de si estamos ante una patología primaria o secundaria, así como el pronóstico.
Anatomía básica de la córnea
La córnea es una estructura lisa, avascular y transparente que forma parte de la túnica fibrosa y se sitúa en la parte más anterior del globo ocular (Fig.1). Entre sus principales funciones cabe destacar proporcionar soporte a las estructuras intraoculares y refractar y transmitir la luz. En el perro, el poder dióptrico de la córnea es de 40-42 dioptrías, y su forma es ligeramente elíptica (diámetro horizontal ligeramente superior al vertical).1
Figura 1 Esquema del globo ocular del perro. La córnea (color rojo) y la esclera (color naranja) conforman la túnica más externa del globo ocular, también llamada túnica fibrosa.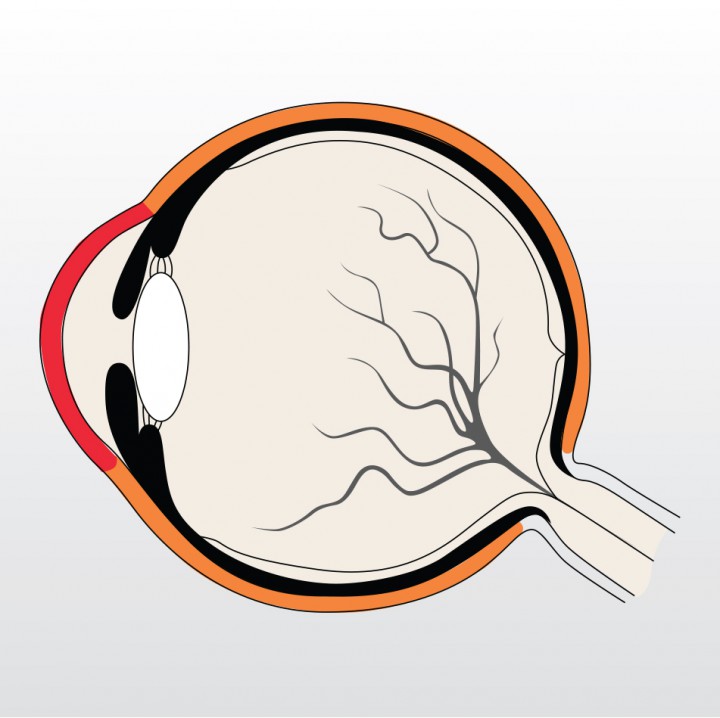
Al ser una estructura avascular, la nutrición corneal depende, en gran medida, del humor acuoso y de la película lagrimal, por lo que alteraciones en alguno de estos medios líquidos pueden inducir enfermedades corneales de diferente severidad. Los párpados y la membrana nictitante tienen un papel importante en la protección corneal.1
El grosor de la córnea varía en función de diferentes variables, tales como la especie, la raza y la edad. En el perro, el grosor corneal es de 0,45-0,55 mm en el centro, y de 0,50-0,65 mm en la periferia, mientras que en el gato oscila entre 0,8-1 mm en el centro y 0,4-0,6 mm en la periferia.1 Diversos estudios demuestran que el grosor corneal aumenta con el paso del tiempo,2-7 pudiendo variar su magnitud según la raza.3,4,7
En el perro, la córnea se compone de cuatro capas diferenciadas que son, de fuera a adentro, el epitelio, el estroma, la membrana de Descemet y el endotelio corneal (Fig. 2). En el ser humano, así como en primates, varias especies de aves, el ciervo y la jirafa, entre otros,8 se aprecia una quinta capa, ubicada entre el epitelio y el estroma corneal, llamada membrana de Bowman (o membrana basal del epitelio). Finalmente, un estudio reciente describe una sexta capa en humanos denominada Dua’s Layer, situada entre el estroma y la membrana de Descemet.9
Figura 2 Imagen histológica de la córnea del perro. Nótense las capas corneales (de fuera a adentro): epitelio (1), estroma (2), membrana de Descemet (3) y endotelio corneal (4).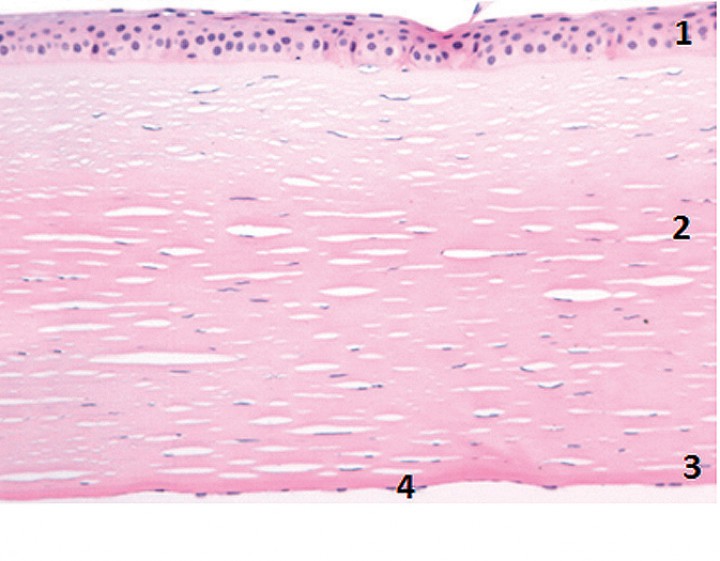
Morfología y fisiología del endotelio corneal
El endotelio corneal es una monocapa de células poligonales, mayoritariamente hexagonales, situada en la parte más interna de la córnea, en contacto directo con el humor acuoso. Su función principal es el control del transporte de agua y nutrientes desde la cámara anterior al estroma corneal, preservando de esa forma la transparencia de la córnea.
A pesar de que la córnea se sitúa entre dos medios líquidos (la lágrima y el humor acuoso), ésta se mantiene en un estado de deshidratación parcial gracias al epitelio y al endotelio. Ambos actúan como barrera física frente a la entrada de agua desde la película lacrimal y el humor acuoso, respectivamente. El endotelio corneal, a diferencia del epitelio, posee uniones intercelulares discontinuas (zonula occludens incompleta), lo que hace que la barrera física que constituye permita un acceso controlado de nutrientes hacia el estroma corneal.10 Además, el endotelio tiene una potente bomba activa sodio-potasio ATPasa que facilita la eliminación del líquido que ya ha entrado en el estroma corneal (Fig. 3). A pesar de que esta bomba se ha estudiado ampliamente, todavía existe controversia en la actualidad acerca de qué iones son los que intervienen en el proceso, aunque se sabe que la bomba sodio-potasio ATPasa requiere bicarbonato y la actividad de la enzima anhidrasa carbónica para su buen funcionamiento.11
Figura 3 Esquema general de la bomba endotelial y los iones que intervienen en el proceso.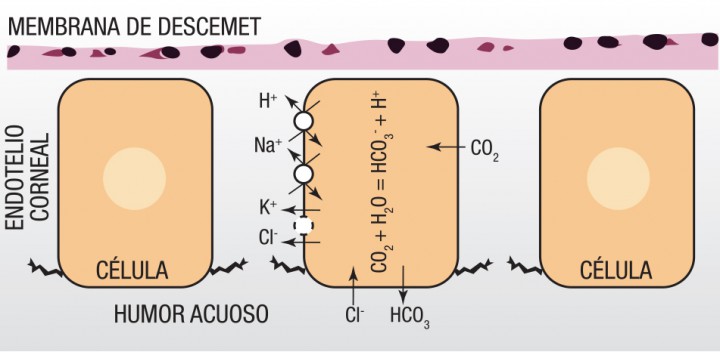
La función del endotelio corneal es decisiva para el mantenimiento de la deshidratación y del grosor corneal.12 Tanto en edemas de origen epitelial como endotelial, al hidratarse el estroma corneal, las fibras de colágeno que lo conforman se engrosan y pierden su equidistancia, haciendo que la luz sea refractada y la córnea pierda su transparencia, dando un aspecto azulado o edematoso característico (Fig. 4) que suele ser difuso si la lesión es de origen endotelial y localizado si es epitelial (Fig. 5).
Figura 4 (A) La transparencia corneal depende en gran medida de la disposición de las fibras de colágeno del estroma (*). (B) En los edemas corneales, el estroma se hidrata y las fibras de colágeno se engrosan y pierden su equidistancia, produciendo un aspecto azulado característico.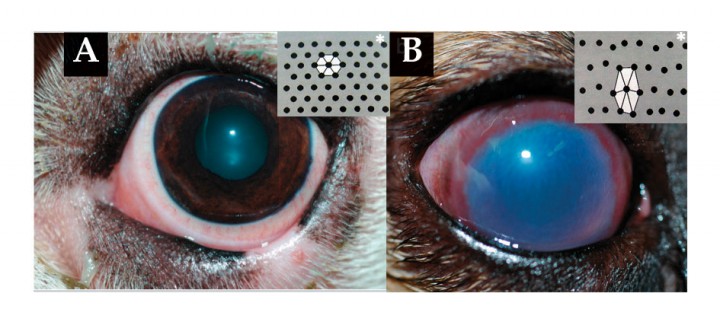
Figura 5 (A) Las lesiones de origen epitelial suelen dar lugar a edemas localizados. (B) Los edemas de origen endotelial suelen ser difusos.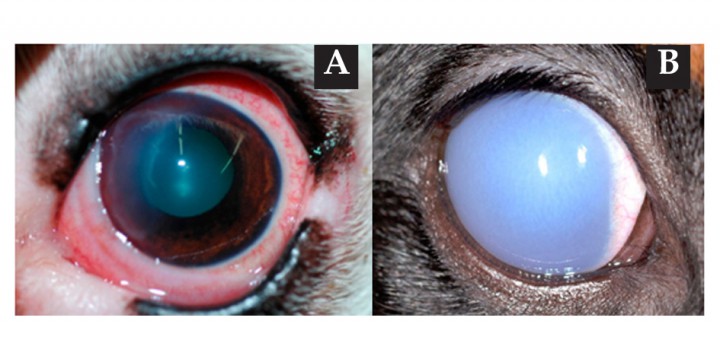
En perros, la densidad celular endotelial media es de 3600 células/mm2,13 pero a medida que el animal envejece, se reduce pudiendo llegar incluso al 50 % de su dotación endotelial inicial.1 En el hombre se ha establecido una velocidad anual media de disminución de la densidad del endotelio corneal del 0,52 %.14 Simultáneamente a la reducción en la densidad celular, el tamaño medio de cada célula aumenta y la forma celular se modifica, siendo menos uniformes y hexagonales. Estos cambios morfológicos se deben principalmente a la ausencia de actividad mitótica de las células endoteliales en la mayoría de especies animales.15 Ello provoca que, al no haber renovación celular, el defecto que dejan las células muertas que se descaman hacia el humor acuoso sea cubierto por la hipertrofia de las células colindantes, que se alargan y adelgazan para cubrir el defecto dejado, cambiando su morfología habitual. Como consecuencia de esta reparación, la hexagonalidad de las células disminuye (aumenta el pleomorfismo) y las diferencias de tamaño entre células son mayores (aumenta el polimegatismo) (Fig. 6). Si, por el contrario, la lesión endotelial es tan extensa que reduce la densidad por debajo de 500 células/mm2, la función endotelial se ve comprometida y se acumula agua en el estroma corneal, produciéndose un edema marcado.15
Figura 6 (A) Si la densidad celular endotelial es adecuada (2000-3000 células/mm2), el humor acuoso (1) que penetra a través de las uniones celulares endoteliales es enviado hacia la cámara anterior (2) mediante la bomba endotelial, manteniéndose de esa forma el equilibrio endotelial. (B) Al empezar a disminuir la densidad endotelial, el endotelio corneal adopta dos mecanismos compensatorios: las células restantes aumentan su tamaño y modifican su forma, y aparecen más bombas endoteliales. Gracias a estas dos adaptaciones la fuga de humor acuoso sigue siendo igual a la devolución. (C) Por el contrario, si la densidad celular endotelial es inferior a 500 células/mm2, la función del endotelio se ve comprometida y el humor acuoso entra en mayor cantidad al estroma y no puede ser evacuado, produciéndose un edema estromal.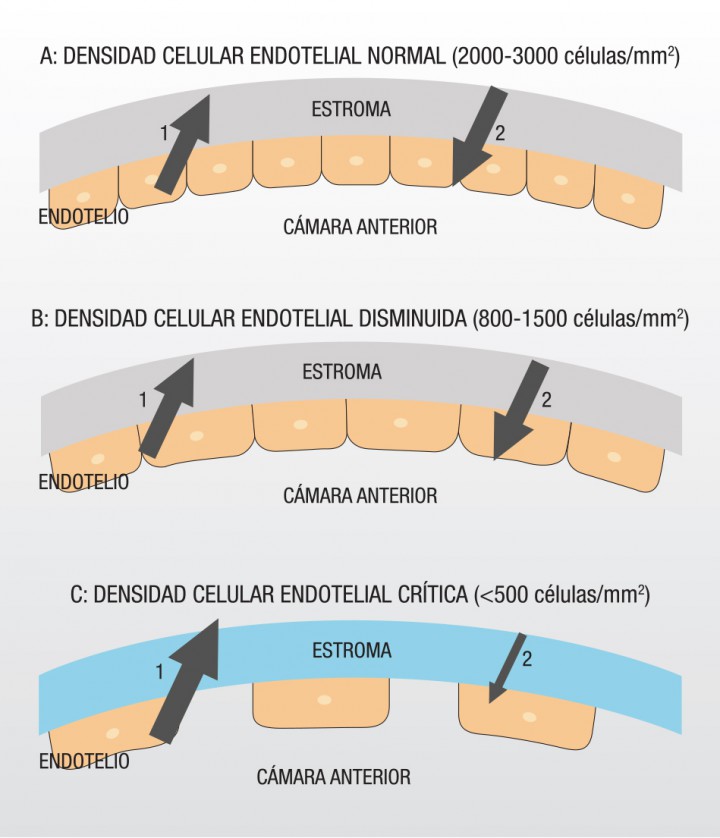
Métodos diagnósticos en casos de sospecha de enfermedad endotelial
La exploración con lámpara de hendidura o biomicroscópica es, sin duda alguna, la primera aproximación diagnóstica en caso de sospecha de alteración del endotelio corneal, pero la información que proporciona es limitada. Este método diagnóstico, en manos de un oftalmólogo experimentado, permite detectar signos de distrofia endotelial en fases tempranas, así como clasificar el grado de transparencia corneal o inflamación secundaria. El endotelio corneal puede observarse mediante el reflejo especular, que se visualiza con hendidura gruesa cuando el ángulo de reflexión es igual al ángulo de incidencia del haz de luz (paralelepípedo).16
En situaciones más específicas de daño endotelial, se puede realizar un estudio morfométrico mediante microscopía especular (ME). La ME se basa en el principio de que un haz de luz proyectado hacia el interior del globo ocular se refleja en el endotelio corneal proporcionando una imagen definida de su anatomía. Esto se produce debido a que el índice refractivo del endotelio es mayor que el del humor acuoso, por lo que un 0,022 % de la luz proyectada se refleja, emitiendo una imagen que es captada y magnificada por el microscopio especular.17,18 (Fig. 7) Mediante esta herramienta, podemos determinar la densidad y la superficie de las células endoteliales, así como el grado de pleomorfismo y polimegatismo. En oftalmología humana, la ME se usa frecuentemente en clínica y en investigación para valorar la evolución de ciertas enfermedades endoteliales. Al tratarse de una técnica diagnóstica no invasiva, rápida y no dolorosa, no requiere anestesia ni sedación en la mayoría de pacientes. En veterinaria su uso es menos frecuente, a pesar de que se han publicado artículos abogando por él.6,19,20
Figura 7 Microfotografía del endotelio corneal normal de un perro cruzado de 2 años de edad, macho castrado, obtenida mediante microscopía especular de no contacto. N = número de células seleccionadas para el análisis, CD = densidad celular endotelial, T = grosor corneal, AVG = área media celular, CV = coeficiente de variación, que hace referencia al polimegatismo de la imagen.
Hay dos tipos básicos de microscopio especular, el de contacto y el de no contacto. En la microscopía especular de contacto la lente del objetivo se sitúa en contacto directo con la superficie corneal, lo que permite eliminar el reflejo de luz epitelial. Por el contrario, en la microscopía de no contacto el examinador debe encontrar el reflejo especular (igual que con la lámpara de hendidura). El microscopio de contacto es más fácil de usar, la magnificación es mayor y también la resolución. Sin embargo, la manipulación de la córnea con este microscopio puede dar lugar a artefactos y molestias para el paciente.21 Con el microscopio de no contacto el campo de visión es menor, pero no provoca molestias para el paciente, lo que lo convierte en una herramienta útil para valorar el endotelio en animales.18
Enfermedades endoteliales descritas en el perro
Las enfermedades endoteliales en el perro pueden clasificarse en primarias o secundarias. Los procesos primarios en esta especie son poco frecuentes e implican mayor dificultad diagnóstica, al no haber otros signos clínicos asociados. Las enfermedades primarias más documentadas incluyen: distrofia endotelial, distrofia polimórfica posterior y degeneración endotelial. Los procesos secundarios son más frecuentes, pudiendo estar asociados a procesos intraoculares tales como uveítis, glaucoma o luxación de cristalino, entre otros.
Endoteliopatías primarias en el perro
Distrofia endotelial corneal
Definición, incidencia y signos clínicos
La Distrofia Endotelial Corneal (DEC) consiste en la aparición de edema corneal espontáneo y progresivo como consecuencia de células endoteliales anormales y distróficas. La clínica de la DEC en el perro es similar a la Distrofia de Fuchs en el ser humano. Esta última se caracteriza por pérdida progresiva de células endoteliales, aumento en el grosor de la membrana de Descemet y deposición de una matriz extracelular en forma de “gotas” (guttae).22 Las células restantes del endotelio no pueden ejercer su función correctamente, generándose un intenso edema estromal que puede llevar a grosores corneales superiores a 1 mm. Cuando el edema es muy intenso, el epitelio puede desprenderse de su membrana basal, creando bullas dolorosas en la superficie anterior de la córnea.23 La enfermedad es bilateral y más frecuente en mujeres a partir de los 50 años de edad con factores de riesgo tales como la radiación ultravioleta, el peso corporal y el tabaco.24
La DEC en el perro se presenta de forma más frecuente en el Boston Terrier, el Chihuahua y el Teckel,25 aunque también se ha descrito en otras razas.2 Se desconoce su heredabilidad, aunque en algunas de las razas afectadas se recomienda no incluir a los animales afectados en programas de cría.26 Los signos clínicos suelen ser también bilaterales (aunque asincrónicos) y más frecuentes en hembras de edad adulta (a partir de los 5 años de edad). Las áreas de la córnea afectadas son azuladas-blanquecinas y no muestran signos de inflamación. La lesión inicial suele ser focal y situada en la zona temporal, aunque progresa durante meses a años y acaba afectando la totalidad de la córnea. Igual que ocurre en la Distrofia de Fuchs, cuando el edema es severo pueden formarse bullas epiteliales que desprenden el epitelio y causan úlceras corneales dolorosas. En casos severos, puede incluso aparecer neovascularización corneal. Los hallazgos microscópicos son los mismos que en la Distrofia de Fuchs: disminución de la celularidad endotelial, abultamientos en la membrana de Descemet (guttae corneal) y pérdida de la hexagonalidad celular.27 En microscopía especular se pueden observar puntos negros o agujeros en el patrón endotelial, lo que indica muerte celular endotelial.2
Diagnóstico, tratamiento y pronóstico
El diagnóstico de la DEC se realiza en base a los signos clínicos observados: opacidad corneal azulada-blanquecina, sin vascularización ni hiperemia conjuntival. Posteriormente, en el examen con lámpara de hendidura puede apreciarse aumento en el grosor corneal, opacidad corneal, bullas epiteliales y cicatrices subepiteliales. El diagnóstico definitivo debe llevarse a cabo mediante microscopía especular.28
El tratamiento inicial se realiza mediante terapia tópica, siendo las sustancias hiperosmóticas (cloruro sódico al 5 %) las más utilizadas. Este tratamiento es paliativo, por lo que deberá mantenerse durante toda la vida o hasta que aparezcan complicaciones que requieran tratamiento quirúrgico (úlceras corneales recidivantes). En oftalmología humana se han descrito diferentes técnicas quirúrgicas para tratar aquellos casos recalcitrantes en los que el edema corneal induce déficits visuales o molestias crónicas que no responden al tratamiento tópico. Entre las técnicas más utilizadas en la actualidad destacan los trasplantes laminares específicos para la zona afectada y el cross-linking.24,29,30 Entre las técnicas de trasplante mínimamente invasivas cabe destacar la Queratoplastia Endotelial Laminar Profunda (Deep Lamellar Endothelial Keratoplasty, DLEK), la Descemet’s Stripping (Automated) Endothelial Keratoplasty (DSEK⁄ DSAEK), la Descemet’s Membrane Endothelial Keratoplasty (DMEK) y la Descemet´s Membrane Automated Endothelial Keratoplasty (DMAEK).31,32
En perros son muy pocas las descripciones de tratamiento quirúrgico paliativo para esta enfermedad, siendo la termoqueratoplastia, el colgajo conjuntival (técnica de letter box) y el cross-linking los más citados. Los perros con queratopatía bullosa persistente o con úlceras recurrentes pueden beneficiarse de la termoqueratoplastia, en la cual se cauterizan diferentes puntos superficiales con el objetivo de crear cicatrices subepiteliales que actúen como barrera al líquido causante de las bullas.33 El colgajo conjuntival (en 360º o en letter box) está indicado en casos de edemas corneales con ulceraciones corneales recidivantes, ya que el aporte vascular reduce el edema, facilitando la cicatrización corneal.34,35 El cross-linking del colágeno corneal (CXL por sus siglas en inglés) es una técnica nueva que aumenta la fuerza mecánica y bioquímica de la córnea. La radiación ultravioleta A en presencia de riboflavina induce la formación de uniones covalentes en la superficie de las fibrillas de colágeno, entre el colágeno y los proteoglicanos, y en la sustancia de proteoglicanos que rodea las fibras de colágeno. Este efecto induce la compactación del estroma corneal, reduciendo el espacio para la acumulación de líquido en córneas edematosas. En oftalmología veterinaria hay varios estudios que abogan por su uso en queratopatías bullosas secundarias a la distrofia corneal.29,30 El tratamiento definitivo es el trasplante corneal, mediante el cual se reemplaza la totalidad del endotelio (siempre y cuando el tejido donante sea fresco), o bien el uso de queratoprótesis (“córneas artificiales”), aunque el uso de estas últimas se realiza de momento de forma experimental.36,37
Distrofia polimórfica posterior
Definición, incidencia y signos clínicos
La Distrofia Polimórfica Posterior (PPD) fue descrita por primera vez en oftalmología humana como una enfermedad autosómica dominante38 sin predisposición racial, sexual o geográfica.39 Se trata de una enfermedad poco frecuente que se presenta en la edad adulta, es en muchos casos asintomática y se caracteriza por alteraciones en el endotelio corneal y la membrana de Descemet. Se pueden observar opacidades polimórficas (algunas de ellas vesiculares), lesiones amplias geográficas y bandas anchas en la membrana de Descemet. Suele ser bilateral, pero puede presentarse de forma asimétrica e incluso en algunos casos de manera unilateral, y los pacientes no suelen desarrollar edema ni neovascularización.39 La PPD puede asociarse a otros hallazgos intraoculares tales como adhesiones iridocorneales, lenticono anterior y glaucoma.40,41
En veterinaria, esta enfermedad se ha diagnosticado recientemente en el Cocker Spaniel Americano, en el que también se ha sugerido un modelo de herencia autosómica dominante.27 Afecta a animales de entre 1 a 7 años de edad y la clínica es extremadamente similar a la descrita en el ser humano: opacidades corneales posteriores multifocales, no pigmentadas y vesiculares o lineales. Estas lesiones son también bilaterales y se limitan al endotelio o la membrana de Descemet, sin alteraciones del estroma o del epitelio, y sin signos de enfermedad del segmento anterior.
Diagnóstico, tratamiento y pronóstico
El diagnóstico de esta enfermedad se realiza también mediante biomicroscopía y microscopía especular. Con biomicroscopía se pueden observar vesículas lineales o múltiples en la córnea posterior que no albergan fluidos en el interior. Estas lesiones pueden rodearse por un halo grisáceo. También pueden observarse bandas en la membrana de Descemet. Histológicamente se ven cambios en las células endoteliales, estando algunas de ellas atenuadas, degeneradas o incluso ausentes. En la microscopía especular pueden apreciarse células endoteliales anormales, más grandes de lo habitual, con opacidades intracelulares. Algunas áreas presentan células degeneradas, mientras que otras simplemente presentan menor densidad celular, pero en todos los casos las células que rodean la lesión son completamente normales. Al contrario que en la distrofia endotelial corneal, en la PPD no hay edema corneal.27
En veterinaria los casos descritos no han requerido tratamiento quirúrgico hasta el momento y se han logrado controlar mediante el uso de sustancias hiperosmóticas tópicas de forma crónica y con un buen pronóstico para la visión.27
Degeneración endotelial senil
Definición, incidencia y signos clínicos
La degeneración endotelial senil (DES) es una enfermedad que cursa con diferentes grados de edema corneal sin otros signos asociados, en pacientes de edades avanzadas. Se trata de una enfermedad de evolución muy progresiva y sin predilección sexual.
La densidad celular endotelial disminuye con la edad en todas aquellas especies animales que no tienen capacidad de replicación endotelial. De forma similar, la capacidad funcional de la bomba endotelial también se ve alterada con el curso de los años.42 Ambos procesos por sí solos no deberían producir sintomatología clínica alguna si partimos de una densidad endotelial adecuada.
En oftalmología humana hay escasa bibliografía sobre la degeneración endotelial senil (DES) y, en la mayoría de casos, se ha asociado a cirugías intraoculares o a glaucoma. La suma de la disminución de la densidad celular endotelial con el paso de los años, la reducción en la función de la bomba (también de forma fisiológica) y cualquier otro factor externo que pueda inducir la muerte de las células endoteliales podría explicar la aparición de este edema en pacientes de edad avanzada.43
Algunos perros viejos (más de 8 años de edad) también desarrollan, sin motivo aparente, edema corneal difuso de diferente grado que puede afectar a la totalidad de la superficie corneal. Desafortunadamente, hoy por hoy, no hay estudios sobre la DES en veterinaria. Los autores del presente trabajo han observado que la mayoría de los perros con edema corneal difuso asociado a la edad no tienen historia de enfermedades oculares previas ni han sido sometidos a cirugías intraoculares. Así, hipotetizan que estos animales podrían haber nacido con una densidad celular situada en el rango bajo de lo que se considera normal y que, con la pérdida de células endoteliales que se produce a lo largo de la vida, acaben llegando al límite crítico en el cual se produce descompensación corneal en una edad avanzada (a diferencia de la distrofia endotelial, en la que la sintomatología clínica aparece en edades tempranas). Esta hipótesis es compatible con un cuadro de distrofia endotelial de aparición tardía. Son necesarios estudios clínicos que confirmen la presente hipótesis.
Diagnóstico, tratamiento y pronóstico
De manera empírica, los autores del presente artículo tratan inicialmente a los pacientes diagnosticados de DES con agentes hiperosmóticos tópicos. En casos graves, el tratamiento quirúrgico sería idéntico al descrito previamente para la DEC, pudiendo optar por técnicas de tratamiento paliativo o curativo.
Endoteliopatías secundarias en el perro
Algunos procesos que afectan al endotelio corneal pueden deberse a enfermedades oculares localizadas en otros tejidos oculares que alteran de forma secundaria al endotelio corneal, tales como uveítis, glaucoma o luxación de cristalino. También se han descrito lesiones endoteliales tras cirugías intraoculares o en enfermedades como diabetes mellitus o hepatitis infecciosa canina.
Uveítis anterior
En el caso de la uveítis anterior, la inflamación intraocular aumenta la permeabilidad del endotelio y disminuye la actividad de la bomba endotelial.44-47 La uveítis, además, se ha asociado a pérdida de densidad celular, y aumento de pleomorfismo y polimegatismo. Es común, también, observar precipitados queráticos y “blebs” endoteliales, manifestándose estos últimos como zonas oscuras en el patrón endotelial que se corresponden con vacuolas intercelulares llenas de fluido que separan las células endoteliales. Los “blebs” se han asociado a estrés endotelial y, en inflamaciones crónicas y/o recurrentes, pueden dar lugar a descompensación corneal.47
Glaucoma
El glaucoma se asocia frecuentemente a edema corneal, siendo la compresión directa del endotelio el mecanismo patogénico más probable.48 Estudios experimentales han demostrado cambios morfológicos del endotelio corneal, así como disminución de la densidad endotelial tras cuadros agudos de hipertensión ocular.48 El mecanismo patogénico en estos casos se ha subdividido en dos fases: en la primera, se afecta la bomba endotelial y en la segunda, se producen daños celulares (rupturas, hinchazón de mitocondrias, desorganización del retículo endoplasmático y aparición de cuerpos mielínicos).49 Además, se ha sugerido que un retraso en el inicio del tratamiento del glaucoma podría causar daños endoteliales irreversibles (hipoxia).50
Entre los fármacos destinados a tratar el glaucoma cabe destacar los inhibidores de la anhidrasa carbónica. Este enzima, aparte de mediar la formación del humor acuoso, tiene un papel importante en el control de la bomba endotelial, por lo que su supresión se ha asociado a aumento del edema corneal en algunos casos. Clínicamente el uso de inhibidores de la anhidrasa carbónica tópicos no debería afectar las córneas normales, presumiblemente porque llega poca concentración a la superficie endotelial. Sin embargo, los inhibidores de la anhidrasa carbónica pueden producir edema corneal en córneas que per se presenten densidad endotelial baja, lo que sugiere que hay un umbral de reserva de la actividad de este enzima o que la inhibición de su actividad tiene mayor impacto cuando otros elementos del endotelio (por ejemplo, la función de barrera) están comprometidos.51
Luxación anterior de cristalino
La luxación anterior de cristalino se ha asociado clínicamente con edema corneal difuso. Este edema se ha caracterizado principalmente en medicina humana, donde la microscopía especular en pacientes con síndrome de Marfan, enfermedad hereditaria que cursa con laxitud del tejido conectivo, ha evidenciado gotas endoteliales, pleomorfismo celular, puntos negros en el patrón endotelial y células anormales.52 El contacto directo del cristalino con el endotelio parece ser la causa más probable del daño endotelial y de la aparición del edema.53 Este edema puede mejorar clínicamente con el tiempo, aunque en la mayoría de los casos pueden quedar secuelas postquirúrgicas.
Cirugías intraoculares: facoemulsificación y extracción extracapsular del cristalino
Cualquier traumatismo directo sobre el endotelio, quirúrgico o no, puede inducir una reducción de la densidad celular endotelial. Tanto en personas como en el perro, la facoemulsificación se ha asociado a reducción variable de la densidad endotelial.54,55 La alteración sobre el endotelio ha demostrado ser más severa tras una cirugía de extracción extracapsular de cristalino convencional o intracapsular de cristalino.54 Algunos autores apuntan a que el daño endotelial puede asociarse a algunos factores tales como el instrumental, la manipulación del núcleo del cristalino, la potencia de los ultrasonidos y la duración de la facoemulsificación.56
Diabetes mellitus
La diabetes mellitus puede afectar a prácticamente todas las estructuras del ojo, incluido el endotelio corneal. En esta capa se ha descrito aumento del polimegatismo y pleomorfismo57-59 produciendo edema corneal en estadios avanzados. Si los niveles de glucemia son prolongados, puede llegar a reducirse la densidad endotelial y aumentar el área celular media. Se ha sugerido reducir el edema corneal mediante el uso tópico de inhibidores de la aldosa reductasa, como el sorbinilo.57-58
Endotelitis canina por adenovirus o enfermedad del ojo azul
Definición, incidencia y signos clínicos
El adenovirus canino de tipo 1 (CAV1) es el agente causal de la hepatitis infecciosa canina. Esta enfermedad fue descrita por primera vez por Rubarth en 1947, denominándose inicialmente Enfermedad de Rubarth.60 El primer contacto con el agente viral se produce por orina, saliva o secreciones respiratorias y tras un periodo de incubación de 4 a 7 días, los animales infectados pueden mostrar desde signos respiratorios leves – sobre todo aquellos infectados por el adenovirus canino de tipo 2 (CAV2) – a signos de enfermedad sistémica grave (CAV1). En infecciones por CAV1 el virus se replica inicialmente en linfonodos y amígdalas para acabar extendiéndose a otros tejidos con predilección por el parénquima hepático, el endotelio vascular y el sistema reticuloendotelial. La sintomatología más frecuente incluye hepatomegalia, ictericia y hemorragias que pueden llevar, en algunos casos, a coagulación intravascular diseminada. Los signos oculares suelen manifestarse en el 20 % de los casos de infección natural.61 Estas lesiones suelen presentarse de 1 a 3 semanas después de la infección, son unilaterales e incluyen principalmente edema corneal severo (la infección, de hecho, también se denomina enfermedad del ojo azul). El edema corneal comúnmente aparece en la zona límbica, pudiendo permanecer focal o bien extenderse a toda la córnea (presentación más frecuente). El cambio de coloración ocular producido por el edema es el signo clínico ocular más fácilmente identificable por el propietario, pudiendo o no presentarse asociado a uveítis anterior. Menos frecuentemente, algunos perros pueden mostrar signos bilaterales (10-30 % de los casos).62
La prevalencia de la enfermedad ha disminuido considerablemente gracias a la vacunación obligatoria, por lo que hoy en día se diagnostican muy pocos casos de infección natural por CAV1. La vacunación inicial con cepas vivas de CAV1 se asoció a incidencias elevadas de signos oculares idénticos a los previamente descritos en la enfermedad natural (enfermedad del ojo azul) (0,4 %).63 La elevada incidencia de reacciones postvacunales hizo optar por cepas atenuadas de CAV2 como estímulo antigénico. Gracias a estas cepas se redujeron marcadamente las reacciones vacunales, pero aún hoy en día se producen de forma esporádica.62 Los signos oculares suelen presentarse de 1 a 3 semanas después de la vacunación, y son idénticos a los producidos por la infección natural con CAV1. A pesar de no haber descripciones bibliográficas sobre la incidencia de lesiones oculares en animales infectados de forma natural con CAV2, los autores han diagnosticado recientemente lesiones oculares en pacientes jóvenes, aún no vacunados y diagnosticados de tos de las perreras (CAV2) (información no publicada).
Los signos oculares, tanto en infecciones naturales como en reacciones vacunales, se asocian a una reacción de hipersensibilidad de tipo 3 o reacción de Arthus (antígeno-anticuerpo). El antígeno vírico se ubica en las células corneales endoteliales desde donde provoca la activación de la cascada inflamatoria de la cámara anterior que induce la formación de anticuerpos que, una vez unidos a los antígenos, formarán inmunocomplejos que serán fagocitados por células inflamatorias de respuesta aguda (neutrófilos).64
Debido a que la mayoría de animales afectados son jóvenes y aún presentan cierta capacidad regenerativa del endotelio, el edema puede ser transitorio, permaneciendo únicamente durante 2 o 3 semanas. Sin embargo, en otros casos el edema puede ser permanente o tardar meses en desaparecer, sobretodo en el Lebrel Afgano en el que se ha descrito un mayor porcentaje de aparición de lesiones oculares asociadas a CAV1, probablemente por una mayor susceptibilidad.63
Diagnóstico, tratamiento y pronóstico
El diagnóstico se realiza en base a la clínica, en la mayoría de casos asociando un cuadro ocular compatible con historia de infección o vacunación reciente en un animal joven. El diagnóstico definitivo precisa de inmunohistoquímica y/o PCR.
El tratamiento de los animales afectados consiste en la administración de sustancias hiperosmóticas tópicas y antiinflamatorios esteroideos para el control de la inflamación intraocular. En algunos casos se recomienda la administración de midriáticos de corta duración para evitar sinequias posteriores secundarias a la inflamación del segmento anterior.63 El pronóstico varía de forma individual, pudiendo recuperarse totalmente sin secuela alguna o dejar diferentes grados de edema y fibrosis corneal que pueden afectar la agudeza visual.
Conclusiones
El endotelio corneal juega un papel vital en el mantenimiento del estado de deshidratación parcial de la córnea, siendo imprescindible para preservar la transparencia corneal. Puede afectarse por enfermedades primarias y secundarias, que en la mayoría de los casos pueden diagnosticarse mediante examen oftalmológico completo y microscopía especular.
A pesar de que las endoteliopatías presentan asombrosas similitudes entre humanos y animales, en estos últimos no han sido tan ampliamente descritas. Por lo tanto, el estudio del endotelio corneal y sus enfermedades en animales sigue siendo una tarea pendiente.
Fuente de financiación: este trabajo no se realizó con fondos comerciales, públicos o del sector privado.
Conflicto de intereses: los autores declaran que no existen conflictos de intereses.
Bibliografía
- 1.
Samuelson DA. Ophthalmic anatomy. En: Gelatt KN, editor. Veterinary Ophthalmology. Iowa: Wiley-Blackwell. 2013. p. 39-170.
- 2.
Gwin RM, Lerner I, Warren JK, Gum G. Decrease in canine corneal endothelial cell density and increase in corneal thickness as functions of age. Invest Ophthalmol Vis Sci ARVO 1982;22(2):267-71.
- 3.
La Rosa FA, Gross RL, Orengo-Nania S. Central corneal thickness of Caucasians and African Americans in glaucomatous and nonglaucomatous populations. Arch Ophthalmol Am Med Assoc 2001;119(1):23.
[PubMed] - 4.
Montiani-Ferreira F, Petersen-Jones S, Cassotis N, Ramsey DT, Gearhart P, Cardoso F. Early postnatal development of central corneal thickness in dogs. Vet Ophthalmol 2003;6(1):19-22.
[PubMed] - 5.
Landers JA, Billing KJ, Mills RA, Henderson TR, Craig JE. Central corneal thickness of indigenous Australians within Central Australia. Am J Ophthalmol 2007;143(2):360-2.
[PubMed] - 6.
Franzen AA, Pigatto JAT, Abib FC, Albuquerque L, Laus JL. Use of specular microscopy to determine corneal endothelial cell morphology and morphometry in enucleated cat eyes. Vet Ophthalmol 2010;13(4):222-6.
- 7.
Coyo N, Peña MT, Costa D, Ríos J, Lacerda R, Leiva M. Effects of age and breed on corneal thickness, density, and morphology of corneal endothelial cells in enucleated sheep eyes. Vet Ophthalmol 2016;19(5):367-72.
[PubMed] - 8.
Merindano M, Costa J, Canals M, Potau J. A comparative study of Bowman’s layer in some mammals: relationships with other constituent corneal structures. Eur J Anat 2003;6(3):133-40.
- 9.
Dua HS, Faraj LA, Said DG, Gray T, Lowe J. Human corneal anatomy redefined: a novel pre-Descemet’s layer (Dua’s layer). Ophthalmology 2013;120(9):1778-85.
[PubMed] - 10.
Bourne WM. Biology of the corneal endothelium in health and disease. Eye (Lond) 2003;17(8):912-8.
[PubMed] - 11.
Bonanno JA. Molecular mechanisms underlying the corneal endothelial pump. Exp Eye Res 2012;95(1):2-7.
[PubMed] - 12.
Watsky MA, Olsen TW, Edelhauser HF. Cornea and sclera. En: Tasman W, Jaeger EA, editors. Duane’s Foundation of Clinical Ophthalmology. Philadelphia: J.B. Lippincott; 1995. p. 1-29.
- 13.
Kafarnik C, Fritsche J, Reese S. In vivo confocal microscopy in the normal corneas of cats, dogs and birds. Vet Ophthalmol 2007;10(4):222-30.
[PubMed] - 14.
Murphy C, Alvarado J, Juster R, Maglio M. Prenatal and postnatal cellularity of the human corneal endothelium. A quantitative histologic study. Invest Ophthalmol Vis Sci 1984;25(3):312-22.
[PubMed] - 15.
Tuft SJ, Coster DJ. The corneal endothelium. Eye 1990;4(3):389-424.
[PubMed] - 16.
Berliner ML. Biomicroscopy of the eye: Slit lamp microscopy of the living eye. New York: Hafner Publishing; 1966.
- 17.
Vogt A. Die Sichtbarkeit des lebenden Hornhautendothels im Lichtbüschel der gullstrandschen Spaltlampe. Klin Monatsbl Augenheilkd. 1919;63:233-4.
- 18.
McCarey BE, Edelhauser HF, Lynn MJ. Review of corneal endothelial specular microscopy for FDA clinical trials of refractive procedures, surgical devices, and new intraocular drugs and solutions. Cornea 2008;27(1):1-16.
[PubMed] - 19.
Stapleton S, Peiffer Jr RL. Specular microscopic observations of the clinically normal canine corneal endothelium. Am J Vet Res 1979;40(12):1803.
[PubMed] - 20.
Yee RW, Edelhauser HF, Stern ME. Specular microscopy of vertebrate corneal endothelium: a comparative study. Exp Eye Res 1987;44(5):703-14.
[PubMed] - 21.
Kulkarni A, Aasuri M, Satish G. Endothelial evaluation including its role in refractive surgery. En: Agarwal S, Agarwal A, Apple D, editors. Textbook of Ophthalmology. New Delhi: Jaypee Brothers Publishers; 2002. p. 971-9.
- 22.
Fuchs E. Dystrophia epithelialis corneae. Albr von Graefes Arch für Ophthalmol 1910;76(3):478-508.
[PubMed] - 23.
Borboli S, Colby K. Mechanisms of disease: Fuchs’ endothelial dystrophy. Ophthalmol Clin North Am 2002;15(1):17-25.
[PubMed] - 24.
Eghrari AO, Gottsch JD. Fuchs’ corneal dystrophy. Expert Rev Ophthalmol 2010;5(2):147-59.
[PubMed] - 25.
Martin C, Dice P. Corneal endothelial dystrophy in the dog. J Am Anim Hosp Assoc 1982;18:327-36.
[PubMed] - 26.
Genetics Committe of the American College of Veterinary Ophthalmologists. Ocular disorders presumed to be inherited in purebred dogs. 7th ed. American College of Veterinary Ophthalmologists, editor. 2014.
- 27.
Cooley PL, Dice PF. Corneal dystrophy in the dog and cat. Vet Clin North Am Small Anim Pract 1990;20(3):681-92.
[PubMed] - 28.
Ledbetter EC, Gilger BC. Diseases and Surgery of the Canine Cornea and Sclera. En: Gelatt KN, Gilger BC, Kern TJ, editors. Veterinary Ophthalmology. 5th ed. Iowa: Wiley-Blackwell; 2013. p. 976-1049.
[PubMed] - 29.
Pot SA, Gallhöfer NS, Walser-Reinhardt L, Hafezi F, Spiess BM. Treatment of bullous keratopathy with corneal collagen cross-linking in two dogs. Vet Ophthalmol 2015;18(2):168-73.
[PubMed] - 30.
Famose F. Evaluation of accelerated corneal collagen cross-linking for the treatment of bullous keratopathy in eight dogs (10 eyes). Vet Ophthalmol 2016;19(3):250-5.
[PubMed] - 31.
Bower KS, Trudo EW, Ryan DS, Sia RK, Mines MJ, Stutzman RD, et al. Photorefractive keratectomy in posterior polymorphous dystrophy with vesicular and band subtypes. J Cataract Refract Surg 2011;37(6):1101-8.
[PubMed] - 32.
Sella R, Rootman D, Bahar I. Descemet’s stripping automated endothelial keratoplasty for posterior polymorphous corneal dystrophy in an 8-month-old boy. J Am Assoc Pediatr Ophthalmol Strabismus 2013;17(1):94-6.
[PubMed] - 33.
Michau TM, Gilger BC, Maggio F, Davidson MG. Use of thermokeratoplasty for treatment of ulcerative keratitis and bullous keratopathy secondary to corneal endothelial disease in dogs: 13 cases (1994-2001). J Am Vet Med Assoc 2003;222(5):607-12.
[PubMed] - 34.
Ortiz J, Lisbão C, Brito F, Martins B. Superficial keratectomy and 360o conjunctival flap for bullous keratopathy in a dog: a case report. Arq Bras Med Veterinária e Zootec 2011;63(3):773-7.
- 35.
Guerreiro C, Lowe R. A novel surgical approach to canine bullous keratopathy. Proceedings of the 44th Annual ACVO Conference. Puerto Rico: American College of Veterinary Ophthalmologists; 2013. p. 154.
- 36.
Allgoewer I, McLellan GJ, Agarwal S. A keratoprosthesis prototype for the dog. Vet Ophthalmol 2010 J;13(1):47-52.
[PubMed] - 37.
Isard P-F, Dulaurent T, Regnier A. Keratoprosthesis with retrocorneal fixation: preliminary results in dogs with corneal blindness. Vet Ophthalmol 2010;13(5):279-88.
[PubMed] - 38.
Koeppe L. Klinische Beobachtungen mit der Nernstspaltlampe und dem Hornhautmikroskop. Graefe’s Arch Clin Exp Ophthalmol 1916;92(3):341-420.
- 39.
Kiel J. Posterior polymorphous dystrophy. Clin Exp Optom 1999;82(1):20-2.
[PubMed] - 40.
Weisenthal R, Krachmer J. Posterior polymorphous corneal dystrophy. En: Cavanagh D, editor. The cornea: Transactions of the World Congress on the Cornea III. New York; 1988. p. 457-66.
[PubMed] - 41.
Rosa JM da S, Andrade Sobrinho MV de, Lipener C. Contact lens fitting in a patient with Alport syndrome and posterior polymorphous corneal dystrophy: a case report. Arq Bras Oftalmol 2016;79(1):42-3.
[PubMed] - 42.
Wigham CG, Hodson SA. Physiological changes in the cornea of the ageing eye. Eye (Lond) 1987;1 ( Pt 2):190-6.
[PubMed] - 43.
Kaufman HE, Katz JI. Pathology of the corneal endothelium. Invest Ophthalmol Vis Sci 1977;16(4):265-8.
[PubMed] - 44.
Olsen T. Transient changes in specular appearance of the corneal endothelium and in corneal thickness during anterior uveitis. Acta Ophthalmol 1981;59(1):100-9.
[PubMed] - 45.
Macdonald JM, Geroski DH, Edelhauser HF. Effect of inflammation on the corneal endothelial pump and barrier. Curr Eye Res 1987;6(9):1125-32.
[PubMed] - 46.
Brooks AM, Grant G, Gillies WE. Differentiation and assessment of corneal endothelial changes associated with diseases of the anterior segment of the eye. Aust N Z J Ophthalmol 1987;15(1):65-70.
[PubMed] - 47.
Pillai CT, Dua HS, Azuara-Blanco A, Sarhan AR. Evaluation of corneal endothelium and keratic precipitates by specular microscopy in anterior uveitis. Br J Ophthalmol 2000;84(12):1367-71.
[PubMed] - 48.
Gagnon MM, Boisjoly HM, Brunette I, Charest M, Amyot M. Corneal endothelial cell density in glaucoma. Cornea 1997;16(3):314-8.
[PubMed] - 49.
Melamed S, Ben-Sira I, Ben-Shaul Y. Corneal endothelial changes under induced intraocular pressure elevation: a scanning and transmission electron microscopic study in rabbits. Br J Ophthalmol 1980;64(3):164-9.
[PubMed] - 50.
Setälä K. Corneal endothelial cell density after an attack of acute glaucoma. Acta Ophthalmol 1979;57(6):1004-13.
[PubMed] - 51.
Sun XC, Li J, Cui M, Bonanno JA. Role of carbonic anhydrase IV in corneal endothelial HCO3- transport. Invest Ophthalmol Vis Sci 2008;49(3):1048-55.
[PubMed] - 52.
Setälä K, Ruusuvaara P, Karjalainen K. Corneal endothelium in Marfan syndrome. A clinical and specular microscopic study. Acta Ophthalmol 1988;66(3):334-40.
[PubMed] - 53.
Miller PE. The glaucomas. En: Maggs DJ, Miller PE, Ofri R, editors. Slatter’s Fundamentals of Veterinary Ophthalmology. 4th ed. St. Louis, Missouri: Elsevier; 2008. p. 230-57.
- 54.
Gwin RM, Warren JK, Samuelson DA, Gum GG. Effects of phacoemulsification and extracapsular lens removal on corneal thickness and endothelial cell density in the dog. Invest Ophthalmol Vis Sci 1983;24(2):227-36.
[PubMed] - 55.
Bourne RRA, Minassian DC, Dart JKG, Rosen P, Kaushal S, Wingate N. Effect of cataract surgery on the corneal endothelium: modern phacoemulsification compared with extracapsular cataract surgery. Ophthalmology 2004;111(4):679-85.
[PubMed] - 56.
Polack FM, Sugar A. The phacoemulsification procedure. II. Corneal endothelial changes. Invest Ophthalmol 1976;15(6):458-69.
[PubMed] - 57.
Meyer LA, Ubels JL, Edelhauser HF. Corneal endothelial morphology in the rat. Effects of aging, diabetes, and topical aldose reductase inhibitor treatment. Invest Ophthalmol Vis Sci 1988;29(6):940-8.
[PubMed] - 58.
Datiles MB, Kador PF, Kashima K, Kinoshita JH, Sinha A. The effects of sorbinil, an aldose reductase inhibitor, on the corneal endothelium in galactosemic dogs. Invest Ophthalmol Vis Sci 1990;31(11):2201-4.
[PubMed] - 59.
Choo M, Prakash K, Samsudin A, Soong T, Ramli N, Kadir A. Corneal changes in type II diabetes mellitus in Malaysia. Int J Ophthalmol 2010;3(3):234-6.
- 60.
Rubarth S. An acute virus disease with liver lesions in dogs (hepatitis contagiosa canis): a pathologico-anatomical and etiological investigation. Acta Pathol Microbiol Scand 1947;suppl 69:1-207.
[PubMed] - 61.
Carmichael L. The Pathogenesis of Ocular Lesions of Infectious Canine Hepatitis: 1. Pathology and Virological Observations. Pathol Vet 1964;1:73-95.
- 62.
Cullen CL, Webb AA. Ocular Manifestations of Systemic Disease. En: Gelatt K, Gilger B, Kern T, editors. Veterinary ophthalmology. 5th ed. Iowa: Wiley-Blackwell; 2013. p. 1897-977.
- 63.
Curtis R, Barnett KC. The “blue eye” phenomenon. Vet Rec 1983;112(15):347-53.
[PubMed] - 64.
Carmichael LE, Medic BL, Bistner SI, Aguirre GD. Viral-antibody complexes in canine adenovirus type 1 (CAV-1)ocular lesions: leukocyte chemotaxis and enzyme release. Cornell Vet 1975;65(3):331-51.
[PubMed]



